Сравнительный анализ клинической эффективности модифицированной технологии контактной транссклеральной диодлазерной циклофотокоагуляции в непрерывно-волновом и микроимпульсном режимах у пациентов с некомпенсированной глаукомой
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Выполнен ретроспективный анализ амбулаторных карт пациентов с диагнозом открытоугольной нестабилизированной глаукомы, которым была выполнена транссклеральная диодлазерная ЦФК в непрерывно-волновом и микроимпульсном режимах. Всего проанализировано 102 амбулаторные карты пациентов (102 глаза).
Результаты. У пациентов исследуемых групп после операции наблюдались статистически значимое снижение внутриглазного давления и уменьшение количества применяемых гипотензивных препаратов (р < 0,05). Острота зрения оставалась стабильной на протяжении 12 месяцев наблюдения. Выявлены стабильные показатели данных компьютерной периметрии и оптической когерентной томографии, а также уменьшение проявлений токсико-аллергических реакций со стороны глазной поверхности. Частота послеоперационных осложнений в основной группе составила 8,5%, в группе сравнения – 11,31%, что достоверно ниже представленных литературных данных.
Согласно указанным критериям, эффективность оптимизированной нами методики в основной группе составила 84,5%, в группе сравнения – 79,5%.
Заключение. На основании анализа полученных результатов методика микроимпульсной ЦФК в собственной модификации более безопасна по сравнению со стандартной методикой ЦФК. С учетом улучшенного профиля безопасности по сравнению с непрерывной транссклеральной ЦФК методика микроимпульсной ЦФК заслуживает рассмотрения в качестве первичной процедуры.
Материал и методы. Выполнен ретроспективный анализ амбулаторных карт пациентов с диагнозом открытоугольной нестабилизированной глаукомы, которым была выполнена транссклеральная диодлазерная ЦФК в непрерывно-волновом и микроимпульсном режимах. Всего проанализировано 102 амбулаторные карты пациентов (102 глаза).
Результаты. У пациентов исследуемых групп после операции наблюдались статистически значимое снижение внутриглазного давления и уменьшение количества применяемых гипотензивных препаратов (р < 0,05). Острота зрения оставалась стабильной на протяжении 12 месяцев наблюдения. Выявлены стабильные показатели данных компьютерной периметрии и оптической когерентной томографии, а также уменьшение проявлений токсико-аллергических реакций со стороны глазной поверхности. Частота послеоперационных осложнений в основной группе составила 8,5%, в группе сравнения – 11,31%, что достоверно ниже представленных литературных данных.
Согласно указанным критериям, эффективность оптимизированной нами методики в основной группе составила 84,5%, в группе сравнения – 79,5%.
Заключение. На основании анализа полученных результатов методика микроимпульсной ЦФК в собственной модификации более безопасна по сравнению со стандартной методикой ЦФК. С учетом улучшенного профиля безопасности по сравнению с непрерывной транссклеральной ЦФК методика микроимпульсной ЦФК заслуживает рассмотрения в качестве первичной процедуры.




Одной из актуальных проблем современной офтальмологии является разработка эффективных методов лечения глаукомы. По данным официальной статистики, ежегодно глаукомой вновь заболевает в среднем один человек из 1000 в возрасте старше 40 лет. В России в 2018 г. зарегистрировано 1 336 508 больных глаукомой. В большинстве регионов РФ глаукома занимает первое место (29%) среди причин инвалидности вследствие офтальмопатологии [1].
Глаукома – тяжелое заболевание с неясной этиологией и сложными, недостаточно изученными звеньями патогенеза. На долю первичной открытоугольной глаукомы (ПОУГ) приходится от 72,3 до 96,1% всех форм глаукомы. Отсутствие жалоб пациентов, трудности диагностики, хроническое прогредиентное течение приводят к сужению полей зрения, снижению зрительных функций и, как следствие, утрате работоспособности и инвалидизации [1, 2]. Необходимость значительных социальных вложений государства в реабилитацию слепых и слабовидящих делает глаукому социально значимым заболеванием [3].
Основная задача лечения глаукомы – снижение уровня внутриглазного давления (ВГД), что позволяет замедлить прогрессирование заболевания и сохранить качество жизни. Как правило, лечение глаукомы начинают с применения медикаментозных препаратов, направленных на снижение уровня ВГД за счет уменьшения продукции водянистой влаги и (или) увеличения ее оттока [4]. В отсутствие эффекта от консервативного лечения прибегают к хирургическим, в том числе лазерным, методам.
Основными преимуществами лазерных методов являются малая травматичность, отсутствие серьезных интра- и послеоперационных осложнений, возможность лечения в амбулаторных условиях и проведения вмешательств у пациентов с отягощенным соматическим анамнезом. Кроме того, лазерная хирургия выполняется при некоторых формах рефрактерной глаукомы. Лазерные вмешательства можно проводить неоднократно при снижении гипотензивного действия в отдаленном послеоперационном периоде [1].
Широкое внедрение в клиническую практику контактной транссклеральной диодлазерной циклофотокоагуляции (ЦФК) позволило по-новому взглянуть на проблему лечения глаукомы. Данный вид хирургического воздействия имеет преимущества перед хирургическим вмешательством, поскольку может быть выполнен амбулаторно, а также у пациентов с различными соматическими заболеваниями и противопоказанием к полостным операциям [5–7].
ЦФК направлена на снижение продукции внутриглазной жидкости (ВГЖ) вследствие достижения в процессе операции частичной атрофии цилиарного тела (ЦТ) и его отростков. Однако, несмотря на неоспоримые преимущества метода, из-за наличия исходной атрофии ЦТ различной степени выраженности у пациентов с терминальной глаукомой не всегда удается добиться прогнозируемых результатов [8, 9]. Проведение традиционной непрерывно-волновой ЦФК может сопровождаться развитием послеоперационных осложнений, таких как реактивный иридоциклит – 75,5%, гифема – 3,3–11,4%, гемофтальм – 0,5–4%, увеит – 10–19%, а также гипотония – 0,8–18% с переходом в субатрофию глазного яблока – 0,8–3,5% [10]. Указанные осложнения могут быть обусловлены передозировкой лазерной энергии при проведении транссклеральной диодлазерной ЦФК [11].
Непредсказуемость гипотензивного эффекта и ряд серьезных осложнений при выполнении контактной транссклеральной ЦФК существенно ограничивали ее применение при глаукоме. В результате был разработан новый метод, известный как микроимпульсная ЦФК (мЦФК) [11, 12].
При мЦФК в ЦТ доставляется серия повторяющихся коротких импульсов лазерной энергии длиной волны 810 нм, которая хорошо поглощается меланином. Предполагается, что окружающие ткани (не производящие меланин) не повреждаются во время процедуры отчасти потому, что получают меньше энергии за один импульс (энергия рассеивается в промежутке между импульсами). Соответственно ткани накапливают меньше энергии в единицу времени и с меньшей вероятностью достигают критического энергетического порога, необходимого для фотокоагуляции [4, 13, 14].
Таким образом, при использовании микроимпульсного режима не происходит деструктивного коагулирующего эффекта на структуру трабекулярной сети в проекции шлеммова канала, что обусловливает щадящее действие и безопасность метода [15, 16]. Гипотензивный эффект операции связан с деструкцией цилиарных отростков, активацией путей оттока ВГЖ, снижением ее выработки, а также вазодилататорным действием за счет выброса медиаторов воспаления [17, 18].
Исходя из сказанного, в послеоперационном периоде можно минимизировать развитие осложнений, таких как нестабильность гипотензивного эффекта, выраженная гипотония в результате полного деструктивного воздействия на волокна ЦТ.
Несмотря на то что механизм микроимпульсного воздействия на ЦТ остается не до конца изученным, мЦФК является одним из методов выбора при ПОУГ. Однако ряд проблем применения контактной ЦФК в микроимпульсном режиме у пациентов с глаукомой определили целесообразность настоящего исследования, его цель и задачи.
Цель – провести сравнительный анализ клинической эффективности модифицированной технологии контактной транссклеральной диодлазерной ЦФК в непрерывно-волновом и микроимпульсном режимах у пациентов с некомпенсированной глаукомой и оптимизировать тактику их ведения.
Материал и методы
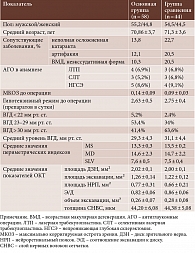
Исследование выполнялось на базе ООО «Глазная клиника доктора Беликовой» в период с марта 2019 по декабрь 2020 г. Для решения поставленной в работе цели исследование выполнялось в рамках двух серий. В рамках первой обследовано 102 пациента (204 глаза) с верифицированным диагнозом ПОУГ стадии III в–с, из них 56 (54,9%) мужчин и 46 (45,1%) женщин. Возраст пациентов составил от 61 до 81 года, средний возраст – 71,05 ± 3,6 года. Распределение пациентов по полу и возрасту представлено в табл. 1.
Основные критерии включения в исследование:
- наличие признаков нестабилизированной глаукомы, по данным отрицательной динамики периметрии, оптической когерентной томографии (ОКТ), визометрии, субкомпенсации ВГД на максимальном капельном гипотензивном режиме;
- отсутствие признаков стабилизации глаукомного процесса после лазерных и фистулизирующих операций;
- наличие признаков токсической и аллергической реакции глазной поверхности на медикаментозную терапию.
Критерии исключения из исследования:
- острые воспалительные заболевания глазного яблока;
- различные виды дистрофий и помутнений роговицы;
- наличие признаков набухающей катаракты;
- экссудативные формы макулярной дегенерации;
- тяжелые формы соматической патологии.
Всем пациентам выполнено комплексное клинико-функциональное обследование зрительного анализатора с использованием стандартных общепринятых и специальных дополнительных методов, согласно международным стандартам исследования пациентов с глаукомой, включая биомикроскопию переднего и заднего отрезка глазного яблока, гониоскопию, пахиметрию, визометрию без коррекции (некорригированная острота зрения, НКОЗ) и с максимальной коррекцией остроты зрения (МКОЗ), бесконтактную тонометрию с автоматической поправкой на данные пахиметрии (компьютерный тонометр СТ-1Р (Топкон)), ОКТ зрительного нерва и макулярной зоны сетчатки, статическую периметрию, офтальмоскопию глазного дна.
В рамках второй серии выделены две равнозначные по возрасту, полу, состоянию зрительной системы глаза (стадии глаукомного процесса, показателям ВГД, данным компьютерной периметрии, ОКТ) группы пациентов, которым с целью стабилизации глаукомного процесса проведена транссклеральная ЦФК. При этом основную группу составили пациенты после транссклеральной мЦФК, а группу сравнения – пациенты после непрерывно-волновой транссклеральной ЦФК (нвЦФК).
Основными параметрами для проведения сравнительного анализа были пол, возраст, максимально корригированная острота зрения вдаль (МКОЗ, до/после операции), ВГД (до и после операции), характеристика гипотензивного режима (количество гипотензивных препаратов до и после операции), наличие послеоперационных осложнений, данные компьютерной периметрии (до и после операции), ОКТ (до и после операции).
В основную группу (мЦФК) вошли 58 пациентов (58 глаз) с диагнозом ПОУГ стадии III в–с, которым была выполнена мЦФК в собственной модификации. До выполнения операции пациенты наблюдались с диагнозом ПОУГ стадии III в–с в среднем 5,0 ± 2,3 года (возраст – от 61 до 80 лет, средний возраст – 70,9 ± 3,7 года, 26 (44,8%) женщин и 32 (55,2%) мужчины (табл. 1)).
Группу сравнения (нвЦФК) составили 44 пациента (44 глаза), которым была выполнена нвЦФК. До выполнения операции пациенты наблюдались с диагнозом глаукомы в среднем 5,75 ± 1,75 года (возраст – от 61 до 82 лет, средний возраст – 71,3 ± 3,5 года, 20 (44,5%) женщин и 24 (54,5%) мужчины). Пациентам группы сравнения проведена нвЦФК (табл. 1).
Согласно результатам исследования, МКОЗ в основной группе до операции составила 0,14 ± 0,09, в группе сравнения – 0,09 ± 0,03.
Уровень ВГД до операции в основной группе составил 29,3 ± 4,3 (19–38) мм рт. ст., в группе сравнения – 31,1 ± 4,4 (20–44) мм рт. ст.
Все пациенты до операции находились на максимальном гипотензивном режиме (два-три препарата). В среднем количество применяемых гипотензивных препаратов до операции в группе мЦФК составило 2,63 ± 0,5 в сутки, в группе нвЦФК – 2,75 ± 0,4 в сутки (табл. 1).
В 23 (21,6%) случаях ранее выполнены антиглаукомные операции: у 7 (6,9%) пациентов – лазерная трабекулопластика, 7 (6,9%) пациентов – селективная лазерная трабекулопластика, 9 (8,8%) пациентов – непроникающая глубокая склерэктомия с коллагеновым дренажом (НГСЭ). Распределение по группам показано в табл. 1.
У всех пациентов исследуемых групп при биомикроскопии были зарегистрированы изменения: неравномерное сужение артериол и расширение венул конъюнктивы и эписклеры; диффузная дистрофия зрачкового пояска и деструкция пигментной каймы радужной оболочки. Были также обнаружены помутнения хрусталика различной степени интенсивности на 18 (17,6%,) глазах, артифакия – на 16 (15,7%) глазах. У 15 (14,7%) пациентов выявлена неэкссудативная форма возрастной макулярной дегенерации. Распределение по группам представлено в табл. 1.
С учетом длительности применения гипотензивных препаратов и максимального капельного режима особое внимание уделялось оценке состояния глазной поверхности на предмет обострения синдрома сухого глаза и токсико-аллергических реакций на лекарственные препараты. Длительность проявлений токсико-аллергической реакции составила в среднем 10,75 ± 3,45 месяца (от одного до 18 месяцев).
У 21 (20,6%) пациента исследуемых групп выявлены признаки токсико-аллергической реакции со стороны глазной поверхности на гипотензивную терапию: 14 (13,7%) пациентов предъявляли жалобы на покраснение, 11 (10,8%) – на чувство инородного тела (песка), 6 (5,9%) – на жжение, 14 (13,7%) – на слезотечение, 6 (5,9%) пациентов – на светобоязнь.
При биомикроскопическом обследовании выявлены 14 (13,7%) случаев незначительного слизистого отделяемого, 14 (13,7%) – гиперемии конъюнктивы (2 балла по классификации Ю.В. Евстигнеевой (2018)), 5 (4,9%) – хемоза конъюнктивы, 7 (6,9%) случаев – эпителиопатии роговицы.
Наличие токсико-аллергической реакции на гипотензивные препараты существенно снижало приверженность пациентов лечению и затрудняло возможность достижения давления цели. В связи с этим пациенты данной категории использовали дополнительную схему лечения, предусматривавшую применение препаратов гиалуроновой кислоты и противоаллергических средств.
При гониоскопии у всех пациентов угол передней камеры (УПК) был открыт, средней ширины. На 21 (47,7%) глазу отмечалась умеренная экзогенная, на 23 (52,3%) глазах – выраженная экзогенная пигментация трабекулярной сети УПК.
При проведении офтальмоскопии у всех пациентов выявлены следующие изменения диска зрительного нерва (ДЗН): деколорация ДЗН, расширение экскавации со сдвигом сосудистого пучка в носовую сторону (соотношение экскавации к диску Э/Д 0,6–0,9), соответствовавшие ПОУГ стадии III в–с.
При проведении компьютерной периметрии обнаружены расширение слепого пятна и кольцевидное сужение поля зрения, относительные и абсолютные скотомы в поле зрения, дугообразная скотома в зоне Бьеррума, изменения показателя MD (mean deviation) – среднее отклонение дефекта в анализируемой группе от возрастной нормы. Изменения показателей компьютерной периметрии у пациентов исследуемых групп наглядно представлены в табл. 1.
По данным ОКТ, у всех пациентов зарегистрированы изменения основных морфометрических параметров ДЗН: уменьшение площади и объема нейроретинального пояска, увеличение площади экскавации ДЗН, уменьшение толщины слоя нервных волокон сетчатки (СНВС), которые подтверждали наличие у данных пациентов глаукомных изменений, соответствовавших ПОУГ стадии III в–с. Результаты сравнительного анализа клинико-морфологических особенностей у пациентов исследуемых групп до оперативного лечения представлены в табл. 1.
С целью компенсации ВГД и стабилизации глаукомного процесса всем пациентам выполнена транссклеральная диодлазерная ЦФК по оптимизированной методике.
Методы статистического анализа
Статистическая обработка результатов исследования проводилась с использованием прикладной компьютерной программы Statistica v. 11.5 (Rus) на основе стандартных параметрических методов оценки среднего и ошибки среднего значения показателя (М ± m), а также критерия Стьюдента. При этом анализ выполнялся как по стандартным, так и по дельтовым (после/до операции) показателям каждого пациента. В общем виде статистически достоверными считались различия, при которых уровень достоверности (p) превышал либо 95% (p < 0,05), либо 99% (p < 0,01). В остальных случаях различия были статистически недостоверны (p > 0,05).
Оптимизированная методика транссклеральной диодлазерной непрерывно-волновой и микроимпульсной циклофотокоагуляции
Для проведения контактной транссклеральной диодлазерной ЦФК применяли импульсный полупроводниковый диодный лазер «АЛОД-01» (ООО «Алком медика», Россия), работающий в непрерывном режиме с длиной волны 810 нм, рабочим наконечником 2,5 мм.
ЦФК в непрерывно-волновом и микроимпульсном режимах в собственной модификации выполняли трансконъюнктивально в проекции цилиарного тела в верхней и нижней половинах глазного яблока в 4 мм от лимба с помощью диодного офтальмокоагулятора отечественного производства «АЛОД-01». Зонд лазера прикладывали плотно в 4 мм от лимба, коагуляты наносили в верхнем и нижнем сегментах, за исключением меридиана 3 и 9 часов.
Параметры применения непрерывно-волновой ЦФК: экспозиция – 3 с, мощность – 2,000–2,500 мВт. Всего наносили от 16 до 24 аппликаций. При возникновении симптома «щелчка» мощность уменьшали на 100 мВт.
За основу ЦФК в микроимпульсном режиме были взяты параметры нвЦФК, выполненной на отечественном приборе «АЛОД-01», с учетом схожести их патогенетического воздействия на структуру глазного яблока, а также параметры мЦФК, проведенной на приборе Cyclo G6 Laser System (IRIDEX, США), которые были адаптированы и модифицированы для работы на отечественном диодном офтальмокоагуляторе «АЛОД-01». Лечение осуществлялось по апробированной и описанной в литературе методике. Модификация методики заключалась в специально разработанной медикаментозной поддержке процедуры и применении индивидуальных энергетических и временных параметров проведения лечения с учетом характеристик отечественного прибора.
Выполняли мЦФК с длиной волны 810 нм и суммарной экспозицией 120–160 с в микроимпульсном режиме. При этом первый цикл воздействия проводили по дуге окружности в одну сторону, второй цикл – по этой же дуге окружности в противоположную сторону. Последующие циклы были аналогичны первым двум. Обычно проводят пять-шесть циклов в нижней половине и аналогичным образом пять-шесть циклов в верхней половине глазного яблока при мощности 2000–2500 мВт, прицельном пучке 30%, длительности импульса 0,05–0,08, интервале 0,01–0,03 с. При возникновении симптома «щелчка» мощность уменьшают на 100 мВт.
Суть предложенной методики заключается в применении ЦФК в микроимпульсном режиме у пациентов с некомпенсированной глаукомой, в отсутствие болевого синдрома, в том числе с сохраненными зрительными функциями.
Успех хирургической техники достигается благодаря специальной предоперационной подготовке, применению определенных параметров лазерной энергии и количества аппликаций во время процедуры, а также выполнению ряда мероприятий медикаментозной реабилитации, направленных на предупреждение послеоперационных осложнений. Алгоритм проведения модифицированной ЦФК представлен в табл. 2.
Для предупреждения развития воспалительной реакции в течение трех дней перед оперативным вмешательством проводили инстилляции нестероидного противовоспалительного препарата (НПВП) (непафенак 0,1% по одной капле три раза в день) в оперируемый глаз. За 3–5 дней до хирургического вмешательства назначали увлажняющие капли, не содержащие консервантов (например, Хилабак по одной капле три раза в день). За 30 минут до операции закапывали дважды антибиотик (Максифлокс). Стандартная обработка операционного поля и конъюнктивальной полости выполнялась так же, как при полостной хирургии. Процедура проводилась в условиях стерильной операционной. На операционном столе для анестезии вводились инстилляции 1%-ного раствора Алкаина, в субтеново пространство вводили 2 мл 2%-ного раствора лидокаина. В 4 мм от лимба наносили круговую разметку, исключая меридианы 3 и 9 часов. Затем на роговицы наносили сплошной слой адгезивного вискоэластика Вискот для защиты роговицы от лазерного воздействия, перегревания и возникновения послеоперационных эрозий.
Операцию завершали субконъюнктивальным введением 1 мл дексаметазона + 1 мл гентамицина, наложением асептической повязки. В послеоперационном режиме выполняли инстилляции антибактериальных, гормональных средств и НПВП (например, ДексаТобропт, непафенак 0,1%) для предупреждения развития воспалительных осложнений в раннем послеоперационном периоде, а также увлажняющих капель без консервантов длительно (3–12 месяцев или постоянно). Алгоритм проведения методики представлен в табл. 2.
Разработанный алгоритм проведения методики позволил снизить вероятность развития послеоперационных осложнений в раннем и отсроченном послеоперационном периоде, а также способствовал плавному (без скачков) снижению уровня ВГД. Гипотензивный режим уменьшался постепенно в зависимости от уровня ВГД в каждом конкретном случае.
Результаты и обсуждение
Клиническую эффективность лечения оценивали по основным клинико-функциональным показателям:
- нормализации уровня ВГД – достижению целевого давления;
- стабильности состояния зрительного нерва и СНВС;
- стабилизации полей зрения;
- остроте зрения;
- возможности уменьшения гипотензивного режима.
Стабильность результатов оценивали по длительности сохранения достигнутых показателей после проведения лечения:
- снижение ВГД не менее чем на 20% от исходного начиная с первого месяца и сохранение достигнутого результата на протяжении всего срока наблюдения (12 месяцев);
- стабильные показатели периметрических индексов компьютерной периметрии и средне-суммарных показателей ОКТ на протяжении всего срока наблюдения (12 месяцев).
Безопасность оценивали по количеству осложнений во время операции, в раннем и позднем послеоперационном периоде.
Операция была безболезненной и комфортной в 76 (74,5%) случаях. 26 (25,5%) пациентов отмечали во время процедуры покалывание и жар в области воздействия лазерного наконечника.
Наблюдение за пациентами после операции осуществлялось в течение 12 месяцев: первый осмотр пациента проводился через 1,5–2 часа после операции, на первые сутки после операции, далее на 7-й, 30-й день, через три, шесть и 12 месяцев.
Оценивали течение послеоперационного периода, жалобы пациента, офтальмологический статус.
Во время операции у пациентов исследуемых групп осложнений не выявлено.
В первые сутки после операции у 2 (3,4%) пациентов основной группы и 2 (4,5%) пациентов группы сравнения отмечалась гиперемия конъюнктивы (2 балла по классификации Ю.В. Евстигнеевой (2018)), которая сохранялась четыре-пять дней и сопровождалась жалобами пациентов на ощущение инородного тела в глазу. Данное состояние купировалось самостоятельно без назначения дополнительного лечения. В первые сутки после операции на одном глазу у 1 (1,7%) пациента основной группы и 1 (2,27%) пациента группы сравнения был зарегистрирован реактивный подъем ВГД на 4,0 мм рт. ст., который купировался в течение двух суток посредством назначения ацетазоламида 250 мг однократно внутрь. Признаки реактивного иридоциклита выявлены у 2 (3,4%) пациентов основной группы и 2 (4,5%) пациентов группы сравнения, что потребовало применения противовоспалительного лечения в течение 5–7 дней в виде субконъюнктивальных инъекций антибактериальных, гормональных, мидриатических средств. В раннем послеоперационном периоде у 2 (3,4%) пациентов основной группы и 2 (4,5%) пациентов группы сравнения в передней камере выявлена гифема, которая разрешилась самостоятельно в течение двух суток без применения дополнительного лечения. У 1 (2,3%) пациента группы сравнения наблюдался умеренный отек эпителия роговицы, который после назначения корнеопротекторов и магнитотерапии купировался в течение четырех дней.
В позднем послеоперационном периоде у пациентов основной группы осложнений не зафиксировано. В группе сравнения зарегистрирован 1 (2,3%) случай гипотонии, потребовавший медикаментозного сопровождения кортикостероидами и мидриатиками. К четвертому месяцу он был купирован. Случаев макулярного отека, субатрофии глазного яблока и гемофтальма не отмечалось (табл. 3).
МКОЗ через 12 месяцев после операции у пациентов основной группы составила -0,1 ± 0,04, у пациентов группы сравнения 0,16 ± 0,09. Для исследуемых групп статистически значимых изменений остроты зрения не выявлено (р < 0,05).
Уровень ВГД у пациентов основной группы на следующие сутки после операции снизился с 29,3 ± 4,3 до 18,9 ± 2,0 (14,0–24,0) мм рт. ст. Через неделю уровень ВГД составил 18,1 ± 2,3 (10,0–25,0) мм рт. ст., через месяц – 18,1 ± 1,9 (15,0–24,0) мм рт. ст., через три месяца – 17,9 ± 1,7 (15,0–23,0) мм рт. ст., через шесть месяцев – 17,7 ± 1,5 (14,0–21,0) мм рт. ст., через 12 месяцев – 17,5 ± 1,3 (14,0–21,0) мм рт. ст. (табл. 4).
У пациентов группы сравнения на следующие сутки после операции было достигнуто снижение дооперационного уровня ВГД с 31,1 ± 4,4 до 19,5 ± 1,8 (16,0–26,0) мм рт. ст. Через неделю уровень ВГД составил 18,8 ± 1,5 (15,0–24,0) мм рт. ст., через месяц – 18,1 ± 1,4 (15,0–24,0) мм рт. ст., через три месяца – 18,0 ± 1,3 (14,0–24,0) мм рт. ст., через шесть месяцев – 17,8 ± 1,3 (14,0–23,0) мм рт. ст., через 12 месяцев – 17,75 ± 1,1 (13,0–22,0) мм рт. ст. Через 12 месяцев после операции уровень ВГД снизился на 42,9% (табл. 4).
Представленные данные свидетельствуют о статистически значимом снижении уровня ВГД на 47,2% у пациентов основной группы и на 42,9% у пациентов группы сравнения к концу срока наблюдения (табл. 5). У пациентов с более темным цветом глаз отмечался более выраженный гипотензивный эффект, что может быть связано с большим количеством пигментированного эпителия, который значимо реагирует на воздействие.
Количество применяемых гипотензивных препаратов к концу срока наблюдения у пациентов основной группы снизилось на 46,5% – с 2,64 ± 0,5 до 1,41 ± 0,6 препарата (p < 0,001), у пациентов группы сравнения на 48% – с 2,75 ± 0,4 до 1,37 ± 0,6 препарата (p < 0,01) (табл. 5).
У 5 (8,6%) пациентов основной группы и 4 (9,1%) пациентов группы сравнения сохранялись признаки токсико-аллергической реакции на гипотензивную терапию.
При анализе показателей компьютерной периметрии в течение 12 месяцев после операции отрицательной динамики не выявлено (табл. 5). Состояние средне-суммарных показателей ОКТ оставалось стабильным на протяжении всего срока динамического наблюдения. У 3 (5,2%) пациентов основной группы и 2 (4,5%) пациентов группы сравнения отмечалась положительная динамика компьютерной периметрии и данных ОКТ, хотя разница не была статистически достоверна (p > 0,05) (табл. 5).
К концу срока наблюдения достичь уровня целевого ВГД без применения гипотензивных капель удалось 6 (10,3%) пациентам основной группы и 4 (9,1%) пациентам группы сравнения.
У 24 (41,4%) пациентов основной группы и 20 (45,5%) пациентов группы сравнения уровень целевого ВГД был достигнут при сохранении одного гипотензивного препарата.
Уровень целевого ВГД достигнут посредством применения двух-трех гипотензивных препаратов у 28 (48,3%) пациентов основной группы и 20 (45,5%) пациентов группы сравнения.
В основной группе неэффективность лечения зафиксирована у 8 (13,9%) пациентов, которым через шесть месяцев после первой лазерной операции было проведено повторное вмешательство: в четырех случаях – повторная мЦФК, в двух – имплантация дренажа Ex-press, в двух – НГСЭ.
В группе сравнения неэффективность лечения отмечалась у 8 (18,2%) пациентов, которым через шесть месяцев после первой лазерной операции было проведено повторное вмешательство: четверым – ЦФК в микроимпульсном режиме, двум – НГСЭ, двум – имплантация дренажа Ahmed.
Таким образом, у пациентов исследуемых групп после операции наблюдалось статистически значимое снижение ВГД (р < 0,05). Достоверных различий между группами не зафиксировано. Коррекцию гипотензивного режима в послеоперационном периоде необходимо выполнять индивидуально, исходя из степени снижения уровня ВГД на момент контрольного осмотра. Однако следует отметить более плавное снижение уровня ВГД в группе мЦФК, что может быть связано с более щадящим микроимпульсным режимом воздействия. Благодаря этому тканям удается сильнее остывать во время проведения операции, тем самым эпителий ЦТ сохраняется и не происходит его полной атрофии. Наиболее выраженный гипотензивный эффект отмечался у пациентов с более темным (карим) цветом радужки, что может быть связано с большим количеством пигментного эпителия. У пациентов со светлой радужкой применялись изначально большие параметры энергии.
В обеих группах зарегистрировано статистически значимое уменьшение количества применяемых гипотензивных препаратов (р < 0,05), что благоприятно сказывалось на приверженности пациентов лечению. У тех, у кого до операции была зафиксирована токсико-аллергическая реакция на гипотензивные препараты, в послеоперационном периоде снижались жалобы и клинические проявления, что было обусловлено меньшей частотой инстилляций гипотензивных препаратов.
Острота зрения в обеих группах оставалась стабильной на протяжении 12 месяцев наблюдения, отмечалось статистически недостоверное (p > 0,05) улучшение данных визометрии (на 2% в групе мЦФК и на 1% в группе нвЦФК). У 5,2% пациентов группы мЦФК и 4,5% пациентов группы нвЦФК имела место положительная динамика со стороны дополнительных методов исследования (ОКТ и компьютерной периметрии), что также статистически недостоверно (p > 0,05) и может объясняться гипотензивной разгрузкой.
Частота послеоперационных осложнений в основной группе составила 8,5%, в группе сравнения – 11,3%, что достоверно ниже представленных литературных данных.
Относительно высокий процент осложнений связан с тем, что в статистику были включены осложнения, которые не требовали назначения специального лечения, например гифема.
Согласно указанным выше критериям, эффективность оптимизированной нами методики в основной группе составила 84,5%, в группе сравнения – 79,5%.
Поскольку мЦФК является неинвазивной и малотравматичной методикой, имеет низкий процент интра- и послеоперационных осложнений, она может выполняться не только в стационарном, но и амбулаторном порядке у пациентов с сохраненными зрительными функциями, на более ранних стадиях глаукомного процесса, в том числе при непереносимости гипотензивных капель и высоких показателях остроты зрения.
На основании анализа полученных результатов методика мЦФК в собственной модификации более безопасна по сравнению со стандартной методикой ЦФК. С учетом улучшенного профиля безопасности по сравнению с непрерывной транссклеральной ЦФК методика микроимпульсной ЦФК заслуживает рассмотрения в качестве первичной процедуры.
Выводы
1. Данные статистического анализа клинико-функциональных результатов применения непрерывно-волновой и микроимпульсной ЦФК на диодном офтальмокоагуляторе отечественного производства «АЛОД-01» свидетельствуют в пользу высокой клинической эффективности обеих модифицированных методик, обеспечивающих статистически достоверную компенсацию ВГД (p < 0,05); уменьшение количества применяемых гипотензивных препаратов (p < 0,05). Как следствие – стабилизация глаукомного процесса в 84,5% случаев.
2. Модифицированные методики статистически достоверно обеспечивают коррекцию гипотензивного режима посредством уменьшения количества применяемых гипотензивных препаратов, что особенно важно для пациентов с токсико-аллергической реакцией со стороны глазной поверхности, ассоциируемой с длительным применением гипотензивных препаратов. В результате значительно улучшается качество жизни пациентов.
3. Разработанная методика ЦФК в микроимпульсном режиме обеспечивает (по сравнению с непрерывно-волновой) более эффективное снижение уровня ВГД с меньшим процентом осложнений (на 7,2%). Это позволяет считать данную методику более безопасной, предсказуемой, с более высоким прогнозируемым результатом и рекомендовать ее для применения в качестве первичной процедуры у пациентов на более ранних стадиях развития глаукомы с сохраненными зрительными функциями.
Авторы не имеют финансовой заинтересованности в представленных материалах или методах и заявляют об отсутствии конфликта интересов.
I.Ye. Shvailikova, Ye.I. Belikova, PhD, Prof.
LLC ῾Eye clinic of Doctor Belikova’
Contact person: Inna Ye. Shvailikova, innashvailikova@yandex.ru
Purpose – to conduct a comparative analysis of the clinical effectiveness of the modified technology of contact transscleral diodlaser cyclophotocoagulation (DCPC) in continuous-wave and micro-pulse mode in patients with uncompensated glaucoma and to optimize the management tactics of such patients.
Material and methods. The retrospective analysis of outpatient records of patients diagnosed with open-angle unstabilized glaucoma, who underwent transscleral diodlaser CPK in continuous-wave and micro-pulse mode, was performed. A total of 102 outpatient records of patients (102 eyes) were analyzed.
Results. Thus, in the patients of the studied groups after surgery, there was a statistically significant decrease in IOP and a decrease in the number of antihypertensive drugs used (p < 0.05); visual acuity remained stable during 12 months of follow-up; stable indicators of computer perimetry and OST data were revealed, as well as a decrease in the manifestations of toxic-allergic reactions from the eye surface; the frequency of postoperative complications in the main group was 8.5%, while in the comparison group – 11.31%, which is significantly lower than the literature data.
According to the above-mentioned efficiency criteria, the efficiency of the method optimized by us in the main group was 84.5 %, in the comparison group – 79.5%.
Conclusion. Based on the analysis of the obtained results, the micro-pulse DCPC method in its own modification is a safer method compared to the standard CCF method. Given the improved safety profile compared to continuous transscleral DCPC, the micro-pulse DCPC technique deserves to be considered as a primary procedure.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.