Стратегии лечения меланомы с мутацией BRAF. Конференция RUSSCO
- Аннотация
- Статья
- Ссылки



![Рис. 1. Алгоритм терапии неоперабельной и метастатической меланомы с мутацией BRAF (адаптировано из Практических рекомендаций ESMO, 2024) [2]](/upload/resize_cache/iblock/f7a/195_350_1/RUSSCO4.jpg)






Встречу открыл Евгений Наумович Имянитов, руководитель отдела биологии опухолевого роста лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, заведующий кафедрой общей и молекулярной медицинской генетики в Санкт-Петербургском государственном медицинском педиатрическом университете, член-корреспондент РАН, профессор, д.м.н., который подробно остановился на распространенности мутаций в гене BRAF и их влиянии на онкологическую практику. Ученый отметил, что частота мутации в гене BRAF при меланоме у людей белой расы довольно высока ‒ 60%. Диагностика мутации BRAF – это простой тест, рутинно применяемый в онкологии, но он практически всегда выполняется вместе с тестами на другие значимые онкомаркеры. Как отметил профессор Имянитов, согласно клиническим рекомендациям по меланоме, одобренным научно-практическим советом Минздрава России [1], на сегодняшний день необходимо проводить тестирование на мутацию в гене BRAF всем пациентам с меланомой кожи, если заподозрены или диагностированы регионарные либо отдаленные метастазы или при метастазах без выявленного первичного очага (по сути речь идет о меланоме III или IV стадий), поскольку это может повлиять на выбор лекарственной терапии. Аналогичный подход можно увидеть и в рекомендациях по молекулярно-генетическому тестированию Европейского общества медицинской онкологии (ESMO) [2]. В них отмечено, что тестирование на наличие драйверных мутаций рекомендовано для всех пациентов с меланомой III или IV стадий, а также должно быть рассмотрено для пациентов с меланомой IIB, IIC стадий, которые относятся к группе высокого риска из-за дальнейшего прогрессирования заболевания или появления отдаленных метастазов. Тестирование на наличие мутаций BRAF V600 также является обязательным для пациентов как с резектабельной, так и с нерезектабельной меланомой III, IV стадий, но при нерезектабельной меланоме IIIC и D-IV стадий рекомендовано тестирование методом секвенирования нового поколения (NGS).
Что касается лечения меланомы с мутацией в гене BRAF, то зарегистрированные лекарственные препараты существуют только для мутаций в позиции V600 (V600E, V600K, V600R, V600M и т.д.). «В начале 90-х годов пришло понимание, что именно для киназ, для фосфорилирующих белков легче всего изготовить лекарства-ингибиторы, – сообщил профессор Имянитов. – Была запущена программа, в рамках которой анализировали статус в опухоли всех генов тирозин-киназ, которых насчитывается несколько сотен. В результате была найдена мутация, которая активирует киназу (V600), и для нее был разработан препарат – BRAF-ингибитор». По словам ученого, сегодня есть понимание того, что терапия меланомы для таких больных должна быть обязательно комбинированной. Схема лечения включает совместное применение ингибиторов BRAF и MEK.
Кристина Вячеславовна Орлова, старший научный сотрудник отделения опухолей кожи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н., подчеркнула высокую значимость проблемы меланомы в России. В стране показатель заболеваемости составляет 8 случаев на 100 000 населения. Болезнь чаще диагностируется у людей старше 60 лет, но страдают меланомой и молодые люди. За последние 10 лет отмечается увеличение темпа роста заболеваемости меланомой примерно на 4%. Ежегодно от меланомы умирают около 3400 человек, летальность в РФ составляет 2,35:100 000 [3].
Эксперт особо подчеркнула, что в России неуклонно растет количество вновь зарегистрированных случаев меланомы. «Если раньше в своих выступлениях мы говорили о том, что ежегодно диагностируется порядка 9000 новых случаев, затем 10 000 случаев, то теперь это примерно 13 000 случаев, – сообщила Кристина Вячеславовна. – Это связано как, с внутренними факторами риска, такими как, например, генетически обусловленный фототип кожи, множественные невусы, состояние иммуносупрессии или какие-то наследственные болезни, на которые зачастую мы не можем повлиять, так и с внешним фактором – воздействием ультрафиолетовых лучей. Именно воздействие ультрафиолета является основным фактором риска развития большинства меланом. Особенно опасны солнечные ожоги».
Важный вопрос связан с определением мутации в гене BRAF при меланоме. Как отметила К.В. Орлова, в реальной клинической практике далеко не всем 100% пациентам, которым требуется определение мутации в гене BRAF, оно проводится. Это может быть связано с временем ожидания результатов молекулярно-генетического тестирования, которое составляет в среднем 15 дней (от 3 до 35 дней), тогда как решение о начале терапии в ряде случаев приходится принимать за 2–3 дня. В таких ситуациях, советует К.В. Орлова, пациенту можно назначить лекарственную терапию первой линии, как правило иммунотерапию. Но тестирование все равно должно быть проведено для выбора дальнейшего лечения, в т.ч. BRAF-таргетной терапии, демонстрирующей выраженную эффективность в отношении меланомы с мутацией в гене BRAF. При этом мутация BRAF V600 рассматривается в настоящее время как прогностический и предиктивный биомаркер ответа на терапию.
Согласно рекомендациям NCCN (National Comprehensive Cancer Network), версия 2.2025 [4], при метастатической и/или неоперабельной меланоме в качестве первой линии терапии предпочтительно использовать комбинированную иммунотерапию или анти-PD-1-монотерапию. При этом больным меланомой с мутацией BRAF, большой опухолевой массой и высокой скоростью прогрессирования заболевания следует отдавать предпочтение комбинированной таргетной терапии BRAF/MEK-ингибиторами, которая включает лекарственные комбинации дабрафениб + траметиниб, вемурафениб + кобиметиниб, энкорафениб + биниметиниб. При прогрессировании заболевания, непереносимой токсичности, либо прогнозируемом риске прогрессирования на терапии BRAF/MEK-ингибиторами назначается терапия второй линии, в качестве которой предпочтительны анти-PD-1-монотерапия, комбинированная иммунотерапия, а также комбинированная таргетная терапия (дабрафениб + траметиниб, вемурафениб + кобиметиниб, энкорафениб + биниметиниб), если таковая не была назначена в первой линии.
В соответствии с клиническими рекомендациями Минздрава России «Меланома кожи и слизистых оболочек» (взрослые), 2023 г. [1], для пациентов с мутацией в гене BRAF с большой опухолевой массой и высокой скоростью прогрессирования заболевания также предпочтительна комбинация таргетных препаратов. При отсутствии ярко выраженных симптомов болезни пациентам показана иммунотерапия (рис. 1).
Эксперт отдельно отметила серьезную проблему в России и за рубежом, связанную с доступностью комбинированной иммунотерапии первой линии у пациентов с нерезектабельной и метастатической меланомой. Поэтому очень важно то, что сегодня у врачей есть возможность выбора между иммунотерапией и таргетной терапией при лечении пациентов с мутацией в гене BRAF.
С докладом «Новая таргетная комбинация BRAF-ингибиторов: от открытия до клинической практики» выступил Алексей Викторович Новик, старший научный сотрудник отдела терапевтической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, д.м.н., который отметил, что за последнее время выживаемость пациентов с меланомой значительно увеличилась благодаря внедрению новых методов лечения. «С одной стороны, появились новые классы препаратов в иммунотерапии (анти-PD-1 и анти-CTLA-4-препараты), стало возможно проведение виротерапии, внедряется клеточная терапия, – констатировал эксперт. – А с другой стороны, у нас появилась таргетная терапия, и мы поняли, что она может воздействовать эффективно на меланому с мутацией BRAF V600».
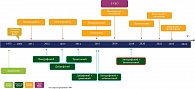
А.В. Новик перечислил основные вехи в эволюции лекарственной терапии нерезектабельной и метастатической меланомы с мутацией BRAF. В 1975 г. начал применяться дакарбазин (химиотерапия), в 2002 г. была открыта мутация BRAF, в 2011 г. одобрен и начал применяться ипилимумаб начиная со второй линии терапии (иммунотерапия), в 2012 г. Европейская комиссия одобрила к применению вемурафениб (таргетная терапия) и т.д. В 2015 г. впервые в клинической практике применили комбинированную таргетную терапию, включающую дабрафениб + траметиниб, вемурафениб + кобиметиниб (рис. 2).
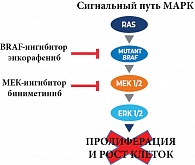
«Тогда уже стало понятно, что комбинированная таргетная терапия лучше, чем монотерапия, – сообщил докладчик. – Так, если таргетная монотерапия давала до 60% объективного ответа, то комбинированная терапия еще больше увеличила этот показатель». Серьезный прорыв был совершен в 2018 г., когда впервые была зарегистрирована третья, усовершенствованная комбинация BRAF/MEK-ингибиторов – энкорафениб + биниметиниб, которая стала активно применяться для лечения взрослых пациентов с неоперабельной или метастатической меланомой с мутацией BRAF V600. А.В. Новик подробно рассказал об ингибиторе киназы RAF – энкорафенибе. Препарат подавляет сигнальный путь МАРК в опухолевых клетках, экспрессирующих некоторые мутированные формы киназы RAF (V600E, D и K), ингибирует рост опухолевых клеток и индуцирует регрессию опухоли in vivo (рис. 3).
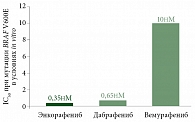
Диссоциационный период полувыведения T1/2diss энкорафениба составляет более 30 часов, обеспечивая длительное ингибирование сигнального пути МАРК. Биниметиниб (ингибитор киназы MEK) обратимо ингибирует MEK1 и MEK2, снижает жизнеспособность клеток с мутацией BRAF и ингибирует рост опухоли in vivo. Доказано, что комбинация энкорафениб + биниметиниб обладает более выраженной антипролиферативной активностью в клетках опухолей с мутацией BRAF по сравнению с любым из препаратов по отдельности. «Эта последняя в данном ряду комбинация таргетных препаратов значительно улучшила объективные ответы, – отметил эксперт. – Она помогает подавляющему большинству пациентов». По его словам, добавление биниметиниба к энкорафенибу позволило использовать более высокую дозу энкорафениба для еще более устойчивого подавления сигнального пути МАРК с одновременным уменьшением токсичности за счет снижения парадоксальной активации сигнального пути в нормальных клетках, которая свойственна всем BRAF-ингибиторам. При применении этих противоопухолевых препаратов в монотерапии частота нежелательных явлений (НЯ) увеличивается, тогда как комбинированная терапия резко снижает вероятность наступления парадоксальной активации. Эксперт пояснил, что высокий парадоксальный индекс энкорафениба, по-видимому, способствует более длительному подавлению парадоксальной активации пути МАРК и меньшему числу развития новых злокачественных новообразований кожи. Кроме того, энкорафениб характеризуется самой низкой концентрацией полумаксимального ингибирования из всех BRAF-ингибиторов, что обеспечивает более высокую ингибирующую активность пролиферации опухолевых клеток при меньшей концентрации лекарственного препарата (рис. 4).
Если сравнивать фармакокинетические характеристики энкорафениба с другими препаратами данного ряда, то он является наиболее сильным из доступных на сегодняшний день BRAF-ингибиторов и потенциально более безопасным, что подтверждено клинической практикой. Что касается комбинации энкорафениба и биниметиниба, то она дает наименьшее количество кожных НЯ по сравнению с другими комбинациями, а также по сравнению с монорежимами энкорафениба, вемурафениба и дабрафениба по отдельности.
Эксперт привел клинический пример действия комбинированной терапии энкорафениб + биниметиниб для больной с BRAF-мутированной меланомой кожи с метастазами в легкие и мягкие ткани правого бедра, принявшей участие в исследовании COLUMBUS [5]. У пациентки было отмечено развитие НЯ со стороны кожи, но по сравнению с пациентами, которые находились на монотерапии BRAF-ингибитором, данные НЯ проявлялись позже, с отсрочкой примерно на 1,5–2 года. Кожная токсичность проявлялась гиперкератозом подошв, сухостью и гиперкератозом кожи, гиперпластическими процессами на слизистых десен. Среди НЯ при длительном применении комбинации наблюдался стоматит 2-й степени, а также анемия 2-й степени, артериальная гипертензия 3-й степени (частое НЯ при применении практически всех BRAF-ингибиторов, у энкорафениба оно внесено в общую характеристику лекарственного препарата), а также гиперкератоз 1-й степени и холестатический синдром 3-й степени. Все НЯ корректировались на фоне сопутствующей терапии и редукции доз препаратов.
С момента начала терапии комбинацией энкорафениб + биниметиниб у данной пациентки прошло почти 11 лет. Во время терапии постепенно регрессировали множественные очаги в легких. В сентябре 2024 г. впервые было получено заключение о полном регрессе заболевания у этой пациентки. На сегодняшний день она продолжает лечение.
Схемы применения препаратов новой комбинированной терапии: энкорафениб назначается в дозе 450 мг один раз в день, 6 капсул по 75 мг. При этом есть возможность в два раза снижать дозу препарата при наличии НЯ. Биниметиниб назначается два раза в день ежедневно по 45 мг. Согласно инструкции, его дозу также можно снижать, но такая потребность для MEК-ингибиторов возникает намного реже, чем для BRAF-ингибиторов. «Надо сразу подчеркнуть, что, если по каким-то причинам мы отменяем биниметиниб, прием энкорафениба может быть продолжен», – добавил эксперт. Он отдельно остановился на вариантах дозирования препаратов у особых групп пациентов – пожилых людей и лиц с печеночной и почечной недостаточностью: для пациентов пожилого возраста никакой коррекции доз не требуется; для пациентов с почечной недостаточностью (на сегодняшний день нет данных о пациентах с выраженным нарушением функции почек, когда скорость клубочковой фильтрации (СКФ) меньше 20 мл/мин по CKD-EPI на стандартную площадь поверхности тела), в остальных случаях коррекция дозы не требуется; для пациентов с печеночной недостаточностью умеренной и тяжелой степени данное лечение не рекомендуется (в случае легкой степени печеночной недостаточности (класс А по Чайлд – Пью) назначение комбинации возможно, но доза энкорафениба должна быть снижена до 300 мг).
Сегодня, резюмировал А.В. Новик, в арсенале врачей есть новая эффективная комбинация BRAF/MEK-ингибиторов, включающая энкорафениб – самый сильный BRAF-ингибитор 3-го поколения. Лечение характеризуется высокой эффективностью и благоприятным профилем безопасности.
Галина Юрьевна Харкевич, ведущий научный сотрудник отделения опухолей кожи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н., подробно остановилась на долгосрочных результатах клинического исследования COLUMBUS, в котором участвовали большинство ранее не леченных пациентов с метастатической или неоперабельной меланомой. Больные были рандомизированы на три группы: получающие комбинацию энкорафениб + биниметиниб, монотерапию энкорафенибом (в более низких дозах из-за риска, связанного с токсичностью), а также монотерапию вемурафенибом в стандартной дозе.
Эксперт сообщила об опубликованных недавно результатах семилетнего наблюдения за пациентами, которые участвовали в этом исследовании. Было показано, что пациенты, получавшие комбинацию энкорафениба и биниметиниба, имели более длительную выживаемость без прогрессирования (ВБП) (медиана ВБП 15 мес.) по сравнению с пациентами, получавшими только вемурафениб. Через 7 лет после начала исследования примерно 20% пациентов с метастатической меланомой с мутацией BRAF, ранее включенных в исследование COLUMBUS, все еще живут без прогрессирования, получая комбинированную таргетную терапию. Кроме того, отмечен существенный прирост показателя общей выживаемости (ОВ). Медиана ОВ достигла 33,6 мес., что существенно выше, чем при использовании BRAF-ингибиторов в монорежиме, а результаты являются более обнадеживающими, чем ранее показанные в исследованиях комбинаций дабрафениб + траметиниб (25,9 мес.) и вемурафениб + кобиметиниб (22,5 мес.). Семилетняя ОВ в группе комбинированной терапии энкорафениб + биниметиниб составила 27%, тогда как в группе вемурафениба – 18%. То есть примерно треть пациентов от начала таргетной терапии комбинацией энкорафениб + биниметиниб были живы через 7 лет после начала терапии.
Сравнение профиля безопасности и переносимости лечения показало, что по общей частоте НЯ комбинация энкорафениб + биниметиниб не давала прироста токсичности по сравнению с монотерапией энкорафенибом. Но если рассматривать НЯ, связанные непосредственно с лечением и считающиеся серьезными, то в исследовании COLUMBUS было показано некоторое уменьшение частоты осложнений в сравнении с монотерапией только BRAF-ингибитором – до 24%. Наиболее частыми НЯ при использовании данной комбинации были желудочно-кишечные нарушения (тошнота, рвота, диарея), артралгия и утомляемость. Как отметила эксперт, сегодня уже есть рассчитанный показатель девятилетней ОВ, основанный на математической модели, который в целом подтверждает уже представленные данные. Предположительно девять лет переживут порядка 26% пациентов, получающих комбинированную таргетную терапию. Докладчик проинформировала о других комбинациях BRAF/MEK-ингибиторов, представив данные непрямого сравнения эффективности их действия с комбинацией энкорафениб + биниметиниб. Так, например, у пациентов с низким уровнем лактатдегидрогеназы (ЛДГ) в крови комбинация энкорафениба с биниметинибом продемонстрировала более высокую медиану ВБП – 22 мес. по сравнению с 17 и 15 мес. при комбинациях дабрафениб + траметиниб и вемурафениб + кобиметиниб соответственно. Такая же тенденция прослеживается у показателей ОВ. При использовании комбинации энкорафениб + биниметиниб у пациентов данной подгруппы медиана ОВ достигает 52 мес., тогда как при применении комбинации вемурафениб + кобиметиниб – 38,5 мес. Новая комбинация имеет преимущество и в отношении частоты объективного ответа (ЧОО). По оценке исследователей, ЧОО составляет 76%, тогда как у других комбинаций – менее 70%.
«И конечно, очень важное значение имеет то, как в целом пациенты переносят любое лечение, в том числе и комбинированную таргетную терапию, насколько оно влияет на качество их жизни, – подчеркнула Г.Ю. Харкевич. – Комбинация энкорафениб + биниметиниб способствовала улучшению качества жизни, как отмечали пациенты в течение всего периода сбора данных». По ее словам, при том что спектр НЯ практически один и тот же для любой из трех комбинаций таргетных препаратов, свои нюансы здесь имеются. В частности, для комбинаций энкорафениб + биниметиниб и дабрафениб + траметиниб наблюдается меньшая частота развития диареи в сравнении с комбинацией вемурафениб + кобиметиниб. Лихорадка и озноб чаще возникают при использовании комбинации дабрафениб + траметиниб и существенно реже при назначении комбинации энкорафениб + биниметиниб. А такие НЯ, как фоточувствительность и различные проявления кожной токсичности, наиболее часто встречаются именно при использовании комбинации вемурафениб + кобиметиниб и намного реже наблюдаются при использовании двух других комбинаций. Кроме того, при применении комбинации энкорафениб + биниметиниб было зарегистрировано меньше НЯ «серозная ретинопатия», чем при использовании комбинации вемурафениб + кобиметиниб. «В отношении развития таких НЯ, как лихорадка, кожная токсичность, печеночная токсичность (в виде повышения уровня печеночных ферментов), артериальная гипертензия и диарея, комбинация энкорафениб + биниметиниб имеет преимущество в сравнении с другими комбинациями», – подчеркнула эксперт.
Г.Ю. Харкевич также привела данные сетевых метаанализов, в которых оценивались эффективность и безопасность таргетных комбинаций. Данные сетевого метаанализа, проведенного Р. Corrie и соавт., 2022 г. [6], в котором сравнивались эффективность и безопасность монотерапии и таргетных комбинаций у пациентов с нерезектабельной или метастатической меланомой с мутацией BRAF, подтвердили бóльшую эффективность комбинаций таргетных препаратов BRAF/MEК- ингибиторов по сравнению с монотерапией только BRAF-ингибитором или дакарбазином. Комбинация энкорафениб + биниметиниб продемонстрировала сопоставимый профиль эффективности и более благоприятный профиль безопасности по сравнению с другими двух- и трехкомпонентными комбинациями.
Весьма показательны и результаты метаанализа M. Garutti и соавт., 2023 г. [7], в котором проведено сравнение безопасности таргетных комбинаций BRAF/MEK-ингибиторов у пациентов с нерезектабельной или метастатической меланомой с мутацией BRAF. Как оказалось, по частоте выраженных НЯ лидирует комбинация дабрафениб + траметиниб, затем идут энкорафениб + биниметиниб и вемурафениб + кобиметиниб. Представляют большой практический интерес практические рекомендации M. Garutti и соавт., 2023 г. [7], по выбору таргетной комбинации в зависимости от сопутствующих заболеваний у пациента. В них говорится, что «с учетом профиля безопасности комбинация энкорафениб + биниметиниб может быть комбинацией выбора у пациентов с сопутствующей патологией: с гепатотоксичностью (например, при метастатическом поражении печени), с кардиоваскулярными заболеваниями, с ревматологическими и дегенеративными заболеваниями с поражением суставов».
Подводя итог всему сказанному, докладчик констатировала, что исследование COLUMBUS [5] продемонстрировало устойчивое преимущество комбинации энкорафениба с биниметинибом при длительном применении в качестве первой линии терапии у пациентов с неоперабельной и метастатической меланомой с мутацией BRAF V600. Наилучшие результаты достигаются у пациентов с нормальным уровнем ЛДГ и низкой опухолевой нагрузкой. Комбинация энкорафениб + биниметиниб обладает управляемым профилем безопасности и позволяет добиваться увеличения выживаемости и длительного сохранения качества жизни пациентов. Профиль безопасности комбинации энкорафениб + биниметиниб представляется более благоприятным по сравнению с BRAF/MEK-ингибиторами 1-го и 2-го поколений (меньше частота пирексии, кожной токсичности и артериальной гипертензии).
В подтверждение сделанных выводов эксперт привела клинический случай применения комбинации энкорафениб + биниметиниб в первой линии терапии у молодой пациентки с метастатической меланомой с мутацией BRAF, невыявленным первичным очагом и с серьезной сопутствующей патологией. Как показал этот клинический случай, назначение данной комбинации позволило достичь быстрого клинического ответа и достигнуть ВБП в течение длительного времени – 17 мес. Качество жизни пациентки значительно улучшилось за счет купирования болевого синдрома, уменьшения объема метастазов в подмышечной области и улучшения функционирования левой верхней конечности. Из-за врожденного заболевания пациентка передвигается на инвалидном кресле, которым она может вновь управлять самостоятельно. «Данный клинический случай демонстрирует эффективность применения BRAF/MEK-ингибиторов в первой линии терапии у пациентов с метастатической меланомой с мутацией BRAF V600 с выраженным прогрессированием заболевания, которым необходим быстрый ответ. Назначенная терапия позволяет добиться значительного уменьшения объема новообразования в короткие сроки и улучшить качество жизни», – подытожила Г.Ю. Харкевич.
Реальной практикой применения комбинации энкорафениб + биниметиниб у пациентов с меланомой с мутацией BRAF также поделилась Наталия Николаевна Петенко, заведующая отделением организации и проведения клинических исследований ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н. Она обратила внимание на важность сопоставления результатов лечения пациентов с распространенной меланомой с мутацией BRAF комбинацией энкорафениб + биниметиниб, показанных в клиническом исследовании COLUMBUS, с результатами наблюдательных исследований, полученных в реальной клинической практике в Европе и Северной Америке [5, 8, 9]. Выяснилось, что показатели эффективности и безопасности сопоставимы и раннее применение комбинации энкорафениб + биниметиниб (в первой линии терапии) приводит к улучшению выживаемости пациентов.
Эксперт также представила несколько клинических случаев с участием российских пациентов. Один из них ‒ лечение пациентки в рамках исследования COLUMBUS. У женщины, возраст 51 год, была выявлена метастатическая меланома с поражением слизистой оболочки желудка, печени, селезенки, лимфоузлов средостения, костей. В октябре 2015 г. пациентке была назначена комбинированная таргетная терапия энкорафенибом с биниметинибом. Спустя два года процедура ПЭТ/КТ не выявила признаков заболевания, но в марте 2018 г., а затем в феврале 2022 г. были обнаружены новые метастазы в головном мозге. В том и в другом случае была проведена стереотаксическая лучевая терапия (СЛТ) на аппарате «КиберНож». Дополнительная СЛТ обеспечила контроль заболевания при интракраниальном олигопрогрессировании.
По словам Н.Н. Петенко, спустя более девяти лет после начала лечения пациентка продолжает получать таргетную терапию энкорафенибом и биниметинибом с регулярным контрольным обследованием в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» с удовлетворительной переносимостью. Комбинированная таргетная терапия позволила добиться длительного экстракраниального и, как выяснилось, интракраниального контроля заболевания, несмотря на распространенность и объем опухолевого поражения. Комбинированная иммунотерапия в качестве терапии второй линии у этой пациентки пока остается невостребованной.
Другой клинический случай, который представила эксперт, был связан с проведением комбинированной терапии энкорафениб + биниметиниб во второй линии у пациентки 63 лет, страдающей распространенной меланомой с мутацией BRAF V600, после прогрессирования на иммунотерапии. Учитывая анамнез заболевания, состояние пациентки, данные гистологического и молекулярно-генетического исследования и нерезектабельный характер опухоли, в первой линии системной терапии был назначен ниволумаб. Ввиду выраженного прогрессирования заболевания принято решение во второй линии использовать таргетную комбинацию энкорафениб + биниметиниб.
Данная комбинация продемонстрировала эффективность, несмотря на негативные прогностические факторы (метастазы в кости и повышенный уровень ЛДГ), и позволила контролировать заболевание в течение длительного времени – более 38 мес. Побочных эффектов не наблюдалось за весь период терапии, начатой в январе 2021 г.
«BRAF/MEK-ингибиторы могут применяться в числе прочих у пациентов из группы неблагоприятного прогноза, что позволяет добиться длительного терапевтического эффекта при хорошей переносимости лечения и сохранении качества жизни», – высказала уверенность Н.Н. Петенко.
Тему продолжила Наталья Владимировна Жукова, член рабочей группы по разработке практических рекомендаций RUSSCO и клинических рекомендаций Минздрава России, к.м.н. Она остановилась на особенностях подходов к лечению пациентов с меланомой с мутацией BRAF и метастазами в головном мозге.
Докладчик сообщила, что, согласно клиническим рекомендациям «Меланома кожи и слизистых оболочек» Минздрава России, 2023 г. [1], при наличии мутации V600 у пациентов с меланомой и с метастазами в головном мозге также рекомендуется отдавать предпочтение комбинированной таргетной терапии BRAF/MEK-ингибиторами. При наличии мутации V600 у пациентов с меланомой и с метастазами в головном мозге и наличии неврологических симптомов рекомендуется отдавать предпочтение комбинированной иммунотаргетной терапии – BRAF/MEK-ингибиторам в сочетании с анти-PD-L1.
В практических рекомендациях ESMO [2] таргетная терапия рекомендована следующим пациентам с меланомой с мутацией BRAF и метастазами в головном мозге, включая пациентов в стабильном состоянии:
- при наличии неврологической симптоматики и получающим кортикостероиды ≤ 4 мг;
- при наличии неврологической симптоматики и получающим кортикостероиды в дозе > 4 мг.
По словам Н.В. Жуковой, комбинация энкорафениб + биниметиниб, разработанная специально для лечения взрослых пациентов с неоперабельной или метастатической меланомой с мутацией BRAF V600, показала преимущества в отношении выживаемости, переносимости и качества жизни у таких пациентов независимо от типа и локализации метастазов, включая пациентов с метастазами в головном мозге. Клиническая эффективность комбинации энкорафениб + биниметиниб у пациентов с неоперабельной или метастатической меланомой с мутацией BRAF V600 и метастазами в головном мозге была показана в ряде клинических исследований. Так, в ретроспективном исследовании Holbrook, 2020 г., ЧОО составила 33%, клинический ответ отмечен у 63% пациентов [10].
Высокая эффективность применения данной комбинации была убедительно продемонстрирована в когортном несравнительном исследовании II фазы E-BRAIN-MEL [11]. В первую когорту входили пациенты с несимптоматическим поражением головного мозга, во вторую – с симптоматическим поражением головного мозга. В исследовании было показано, что у пациентов с метастазами в головном мозге с последующей лучевой терапией головного мозга ЧОО достигала 70,8% (рис. 5). У пациентов с симптоматическими метастазами ВБП составила 8,7 мес., ОВ – 16,1 мес. вне зависимости от применения кортикостероидов.
При анализе данных Датского национального регистра [12], в который вошли данные 203 пациентов с меланомой с мутацией BRAF и метастазами в головной мозг, получавших энкорафениб + биниметиниб, ЧОО составила 68,4%, ВБП – 5,6 мес., ОВ – 10,9 мес.
По словам эксперта, требуется дальнейшее проведение рандомизированных исследований с разными комбинациями и последовательностями таргетной терапии, иммунотерапии и лучевой терапии.
Н.В. Жукова привела пример клинического случая, продемонстрировавшего возможности применения комбинированной таргетной терапии и последовательной лучевой терапии в лечении меланомы с мутацией BRAF и метастазом в головной мозг. Лечение проводилось мужчине, возраст 61 год, у которого наблюдалось постепенно увеличивающееся пигментированное новообразование на коже в области передней поверхности живота справа. Было отмечено, что во время проведения лучевой терапии внутричерепного очага для уменьшения токсичности возможно временное прекращение системной терапии BRAF/MEK-ингибиторами на 24 часа до и после и в течение всего курса лучевой терапии с полноценным сохранением терапевтического эффекта.
Назначение комбинации энкорафениб + биниметиниб в первой линии терапии позволило достичь контроля заболевания и хорошей переносимости терапии в течение длительного времени – 30 мес. и более.
Механизмы резистентности к BRAF/MEK-ингибиторам и целесообразность повторного назначения этой группы препаратов раскрыл в своем докладе Игорь Вячеславович Самойленко, старший научный сотрудник отделения опухолей кожи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н. Он сообщил, что примерно 5–7%, иногда до 10%, больных меланомой с мутацией BRAF не отвечают на терапию BRAF/MEK-ингибиторами. Это обусловлено как исходной, так и приобретенной резистентностью к BRAF/MEK-ингибиторам, которая является основной проблемой в лечении таких пациентов.
По словам эксперта, несмотря на позитивные результаты, полученные в регистрационных исследованиях [5], на самом деле очень небольшое число пациентов не прогрессирует дольше нескольких лет – примерно 20–30% больных. Если, к примеру, взять клиническое исследование COLUMBUS, даже через 7–8 лет пациентам приходится отменять терапию в связи с прогрессированием.
И.В. Самойленко перечислил основные механизмы резистентности к BRAF/MEK-ингибиторам при меланоме:
- Реактивация MAPK-каскада, обусловливающая более 50% случаев резистентности к комбинации BRAF/MEK-ингибиторов. В ее основе могут лежать вторичные мутации BRAF (например, BRAF L505H) или амплификация BRAF или МЕК; потеря гетерозиготности гена NF1 и мутации в MEK1/2.
- Активация внутриклеточного сигнального пути PI3K/AKT, вызванная мутациями гена PTEN, а также гиперактивацией рецептора инсулиноподобного фактора роста 1 (IGF-1R) или рецептора тромбоцитарного фактора роста (PDGFRβ).
- Фенотипическая пластичность и транскрипционные изменения, в основе которых лежат переход к мезенхимальному фенотипу и повышение экспрессии факторов EMT (ZEB1, TWIST, SNAIL), а также повышение экспрессии генов MITF, AXL и SOX10, что способствует выживанию опухолевых клеток.
- Изменение состава опухолевого микроокружения и другие механизмы.
Среди возможных стратегий преодоления резистентности докладчик выделил:
- Повторное назначение BRAF/MEK-ингибиторов после периода отмены терапии, когда чувствительность опухолевого клона клеток может восстановиться.
- Комбинация с другими терапевтическими препаратами, такими как иммунотерапия или ингибиторы других сигнальных путей, для увеличения эффективности повторного применения (ингибиторами PI3K, CDK4/6 или других альтернативных путей).
- Использование эпигенетических модуляторов, например ингибиторов гистондеацетилазы (HDAC), для снижения пластичности опухоли.
- Комбинация с новыми стратегиями, такими как клеточная терапия и онколитические вирусы.
«Перерыв в лечении таргетными препаратами может способствовать восстановлению чувствительности опухоли к BRAF/MEK-ингибиторам, – уверен эксперт. – На исходном уровне опухоли с BRAF-мутацией представляют собой гетерогенную популяцию чувствительных и резистентных к таргетной терапии клонов клеток. В ходе лечения клоны, чувствительные к таргетной терапии, погибают, и в опухоли начинают преобладать резистентные клоны, что в конечном итоге ведет к прогрессированию или рецидиву заболевания. Во время периода без лечения или применения терапии, не нацеленной на BRAF, чувствительные клетки могут восстановить свою численность, что вернет опухоли чувствительность к BRAF/MEK-ингибиторам. Именно это и обосновывает подход с возобновлением таргетной терапии».
По словам докладчика, ответ на повторную терапию может достигать 30–40%, а значит, и ВБП может составлять несколько месяцев. «Комбинированная таргетная терапия обладает преимуществом по сравнению с монотерапией, если вы к ней возвращаетесь, – отметил И.В. Самойленко. – Важно, чтобы при возвращении к таргетной терапии выбор был именно за комбинацией препаратов, поскольку MEK-ингибитор играет здесь значительную роль».
Таким образом, необходимо своевременно выявлять больных меланомой с мутацией BRAF для выработки оптимальной стратегии терапии и начала лечения таргетными препаратами, особенно у пациентов с большой опухолевой массой и высокой скоростью прогрессирования. Поскольку правильная и своевременная диагностика мутации BRAF определяет успешность лечения пациентов, врачам необходимо знать преимущества и недостатки каждого из применяемых молекулярно-генетических методов тестирования для возможного подбора тактики ведения пациента в каждом конкретном случае. С учетом спектра токсичности существующих в настоящее время двух таргетных комбинаций BRAF/MEK-ингибиторов с целью оптимального подбора терапии, улучшения исходов лечения и качества жизни больных нерезектабельной и метастатической меланомой с мутацией BRAF в арсенале онкологов обязательно должна быть третья комбинация BRAF/MEK-ингибиторов – энкорафениб + биниметиниб. Энкорафениб является самым сильным BRAF-ингибитором из зарегистрированных и в комбинации с биниметинибом снижает частоту и тяжесть НЯ, что позволяет увеличить дозу энкорафениба в комбинации. Комбинация энкорафениб + биниметиниб продемонстрировала клиническую пользу, управляемый профиль токсичности и поддержание качества жизни не только в клинических исследованиях, но и в реальной клинической практике у больных нерезектабельной и метастатической меланомой с мутацией BRAF V600.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.