Телмисартан и новые перспективы контроля артериального давления и нефропротекции у больных сахарным диабетом
- Аннотация
- Статья
- Ссылки
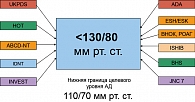

Наличие нарушений углеводного обмена диктует необходимость относить больного к категории крайне высокого сердечно-сосудистого риска, в связи с чем целевые показатели артериального давления (АД) при диабете ниже, чем в общей популяции гипертоников, что доказано многоцентровыми клиническими исследованиями и утверждено в национальных рекомендациях по лечению артериальной гипертонии и сахарного диабета (рисунок 1). При сахарном диабете значительно повышаются требования к метаболическим свойствам антигипертензивных лекарственных средств и важными характеристиками, которыми должны обладать препараты первого ряда, их способность положительно влиять на углеводный обмен, липидный спектр крови и вызывать снижение массы тела или быть нейтральными в отношении этого показателя. Крайне желательны органопротективные свойства антигипертензивных препаратов, их способность задерживать прогрессирование поздних микрососудистых осложнений сахарного диабета, в том числе и за счет улучшения функции эндотелия сосудов (1).
Все перечисленные свойства препаратов должны находить практическое отражение в виде сокращения общей и сердечно-сосудистой смертности, уменьшения частоты сердечно-сосудистых катастроф и новых случаев развития сахарного диабета, сердечной и почечной недостаточности.
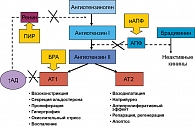
Со времени открытия возможности снижать АД путем воздействия на ренин-ангитензин-альдостероновую систему (РААС) разработано несколько групп препаратов: ингибиторы ангиотензин-превращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина (БРА) и прямые ингибиторы ренина (ПИР), которые, помимо доказанной гипотензивной активности, обладают рядом положительных свойств, обусловленных противодействием негативным физиологическим эффектам ангиотензина II и ренина (рисунок 2).
Рецепторы ангиотензина II являются основным компонентом, определяющим функционирование РААС. В настоящее время идентифицированы два типа таких рецепторов в организме человека – АТ1 и АТ2. Вазоспазм, стимуляция высвобождения альдостерона и вазопрессина, реабсорбция натрия, задержка воды, активация симпатической нервной системы, а также многие другие физиологические эффекты ангиотензина II опосредованы через рецепторы АТ1.
Многочисленными исследованиями доказано, что активация АТ1-рецепторов играет важную роль в процессах развития гипертрофии левого желудочка сердца при артериальной гипертензии, в постинфарктном ремоделировании миокарда, в развитии нефросклероза, гипертрофии медии сосудов, в развитии эндотелиальной дисфункции и атеротромбоза (2).
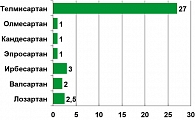
Используемые в современной клинической практике БРА обладают различными фармакокинетическими и фармакодинамическими свойствами (таблица). Степень сродства к рецепторам ангиотензина II 1 типа у препаратов данной группы различна и в порядке убывания выглядит так: телмисартан > олмесартан > кандесартан > эпросартан > валсартан > лозартан (3).
Телмисартан – мощный, длительно действующий непептидный антагонист рецепторов ангиотензина II типа 1, который избирательно и необратимо блокирует АТ-1-рецепторы, не оказывая влияния на другие рецепторные системы, участвующие в регуляции кровообращения. Высокая липофильность в сочетании с большим объемом распределения дают телмисартану преимущество в способности к проникновению в ткани и клетки, а длительный период полувыведения обеспечивает устойчивый контроль АД в течение суток при однократном приеме в дозе от 40 до 80 мг.
Необходимо отметить, что телмисартан не является пролекарством, а действует целой молекулой, что положительно сказывается на его биодоступности. Благодаря высокой степени связывания с белками плазмы, телмисартан выводится почками не более чем на 1%, что помогает избежать эффекта кумуляции при почечной недостаточности и дает весьма важное преимущество в случае лечения больных с поражением почек различного генеза.
Одним из новых и перспективных аспектов действия телмисартана следует считать недавно выявленную способность этого препарата взаимодействовать с γ-рецепторами, активируемыми пролифератором пероксисом (PPARγ) – универсальными мультилигандными триггерами транскрипции ДНК и регуляции внутриклеточных процессов обмена веществ и энергии, расположенными в клеточном ядре.
Эффекты стимуляции PPARγ-рецепторов многочисленны и разнообразны. Наиболее изученным из них является влияние на чувствительность к инсулину, которое активно применяется в лечении сахарного диабета 2 типа с преобладающей инсулинорезистентностью. Предполагают также, что вместе с другими подтипами PPAR-рецепторов они участвуют в регуляции экспрессии молекул клеточной адгезии на мембране эндотелиоцитов, влияя на способность к тромбообразованию и формированию клеточного воспалительного ответа в стенке сосуда. Продукция провоспалительных цитокинов, таких как фактор некроза опухоли α, интерлейкин-6 и интерлейкин-1β, также находится в сфере отрицательной регуляции PPARγ-рецепторов. Помимо этого активация PPARγ-рецепторов способна модулировать процессы оксидативного стресса путем повышения экспрессии противостоящих ему факторов – таких как CuZn-супероксиддисмутаза. Еще одно известное свойство стимуляции PPARγ-рецепторов – способность снижать концентрацию матриксных металлопротеиназ макрофагов – компонентов, ответственных за дестабилизацию атеросклеротической бляшки, а также образование и накопление конечных продуктов гликирования (4).
Следует подчеркнуть, что сродство телмисартана к этим структурам примерно в 10-30 раз сильнее, чем у других БРА (рисунок 3), и в то же время в 10 раз слабее, чем у тиазолидиндионов – прямых агонистов PPARγ (5).
Таким образом, телмисартан способен оказывать PPARγ-опосредованные эффекты без характерных побочных явлений, свойственных прямым PPARγ-агонистам пиоглитазону и росиглитазону, которые активно используются в современных схемах лечения сахарного диабета 2 типа. Благодаря этому телмисартан может быть отнесен к так называемым селективным модуляторам PPARγ-рецепторов.
В ряде исследований показано, что телмисартан in vitro способен угнетать стимулированную фактором некроза опухоли экспрессию интерлейкина-6 в гладкомышечных клетках сосудистой стенки по тому же механизму, что и пиоглитазон, то есть опосредованно через PPАRγ-рецепторы (6). Имеются сведения, что телмисартан путем взаимодействия с PPARγ-рецепторами может стимулировать пролиферацию клеток-предшественников эндотелиоцитов, играя важную роль в ангиогенезе (7).
Очевидно, что PPAR-стимулирующая активность телмисартана является многообещающим свойством, не характерным для других антигипертензивных препаратов, однако его перспективы и практическая польза еще должны быть подтверждены контролируемыми исследованиями.
Диабетическая нефропатия – медленно прогрессирующее осложнение сахарного диабета, которое является наиболее частой причиной развития терминальной почечной недостаточности. Данное осложнение диабета является многофакторной комбинацией гемодинамических и метаболических нарушений, которые вносят совместный вклад в повреждение клубочкового аппарата, что проявляется сначала возникновением микроальбуминурии и протеинурии, а затем снижением гломерулярной фильтрации, вплоть до развития азотемии.
На основании клинически доказанного замедления прогрессирования микроальбуминурии в протеинурию и азотемию при лечении ингибиторами АПФ и блокаторами рецепторов ангиотензина национальные комитеты большинства стран мира рекомендуют преимущественное использование препаратов указанных групп в качестве антигипертензивных средств у больных сахарным диабетом (1).
В экспериментальных исследованиях на лабораторных животных было доказано, что как возникновение, так и прогрессирование микроальбуминурии сопровождается увеличением содержания ангиотензина II в почечной ткани и нарушением структуры подоцитов. Блокада АТ1-рецепторов с помощью телмисартана способствовала прекращению нарастания дефекта подоцитов и экскреции альбумина (8).
C момента инициации проведения многоцентровых рандомизированных исследований с применением телмисартана стала очевидной высокая способность этого препарата уменьшать экскрецию белка при диабетической нефропатии, т.е. оказывать нефропротективный эффект у больных сахарным диабетом. В настоящее время телмисартан считается наиболее исследованным препаратом группы БРА в отношении нефропротекции при диабете, который прошел необходимые клинические испытания у больных с практически всеми, в том числе и наиболее ранними стадиями развития диабетической нефропатии (1). Так, в одном из первых рандомизированных исследований DETAIL (Diabetics Exposed to Telmisartan and EnalaprIL) сравнивалась способность телмисартана (80 мг/сут.) и эналаприла (20 мг/сут.) предупреждать развитие диабетической нефропатии, которая впервые оценивалась по прямому измерению скорости клубочковой фильтрации. Оказалось, что по выраженности нефропротективного эффекта телмисартан не уступает эналаприлу, многие годы по праву считавшемуся «золотым стандартом» антигипертензивной терапии, однако имеет существенные преимущества по переносимости, так как реже вызывает кашель и другие побочные эффекты (9).
В исследовании TRENDY (Telmisartan versus Ramipril in renal Endothelial Dysfunction) была предпринята уникальная попытка сравнить влияние телмисартана и рамиприла на эндотелиальную функцию и развитие протеинурии у больных сахарным диабетом и мягкой/умеренной АГ с отсутствием белка в анализах мочи или микроальбуминурией. Прием обоих препаратов в течение 9 недель с титрацией дозы на 3-й неделе с 40 до 80 мг/сут. телмисартана и с 5 до 10 мг/сут. рамиприла приводил к значимому повышению продукции NO почечным эндотелием, более выраженному в группе телмисартана. При этом снижение экскреции альбумина за сравнительно небольшой период наблюдения у больных, принимавших телмисартан, было достоверным, в то время как в группе рамиприла значимых изменений этого показателя не наблюдалось (10).
Исследование INNOVATION (INcipieNt to OVert: Angiotensin II receptor blocker, Telmisartan, Investigation On type 2 diabetic Nephropathy) продемонстрировало, что телмисартан в дозе 40 мг/сут. способен предотвращать прогрессирование микроальбуминурии в протеинурию у больных сахарным диабетом. Так, у 23 и 12,8% пациентов, принимавших телмисартан в дозах 80 и 40 мг/сут. соответственно, микроальбуминурия регрессировала. При этом ренопротективный эффект имел место и у пациентов с исходно нормальным уровнем АД. Данный факт в очередной раз убеждает в необходимости дополнительно исследовать потенциальные механизмы нефропротекции телмисартана, напрямую не связанные с гипотензивным эффектом, обусловленным блокадой АТ1-рецепторов, а влиянием других факторов, например PPARγ-агонизмом (11).
VIVALDI (inVestIgate the efficacy of telmIsartan versus VALsartan in hypertensive type 2 DIabetic patients with overt nephropathy) – исследование, в котором сравнивалась способность телмисартана и валсартана снижать выраженность протеинурии у больных сахарным диабетом. Оба препарата практически одинаково уменьшали экскрецию белка у обследуемых пациентов, однако в группе валсартана достоверно чаще требовалось добавление к терапии второго антигипертензивного препарата из-за недостаточного снижения АД (12).
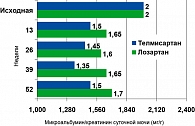
По результатам исследования AMADEO (A comparison of telMisartan versus losArtan in hypertensive type 2 DiabEtic patients with Overt nephropathy), где первичной конечной точкой было принято изменение соотношения альбумин/креатинин суточной мочи (13), телмисартан достоверно эффективнее лозартана предотвращал прогрессирование протеинурии (рисунок 4).
Основной целью масштабного многолетнего клинического исследования ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) было изучение и сравнение влияния комбинации БРА и ИАПФ по сравнению с монотерапией препаратами указанных групп на исходы заболевания у пациентов* с сахарным диабетом высокого сердечно-сосудистого риска. Выбор дозировок определялся оптимальным антигипертензивным эффектом телмисартана и рамиприла, учитывались результаты исследования НОРЕ, где рамиприл продемонстрировал максимальный положительный эффект в дозе 10 мг. Несмотря на то что наиболее ожидаемый результат, а именно доказательство преимуществ комбинации БРА и ИАПФ на конечные точки, в том числе и на предупреждение развития новых случаев сахарного диабета, получен не был, тем не менее стало очевидно, что телмисартан не уступает рамиприлу по степени влияния на выживаемость пациентов и контроль показателей АД, а комбинация значительных доз исследуемых препаратов в большинстве случаев оказалась нецелесообразной, особенно учитывая отсутствие корреляции между гипотензивным и органопротективным эффектами.
Подводя итог пока еще недолгой, но уже насыщенной интересными результатами истории изучения и применения БРА в доказательной кардиологии и диабетологии, следует заключить, что телмисартан является современным и эффективным антигипертензивным препаратом, который имеет ряд преимуществ по сравнению с другими препаратами группы БРА в отношении способности предупреждать развитие и прогрессирование нефропатии у больных сахарным диабетом и обладая сходным с ИАПФ нефропротективным действием характеризуется лучшей переносимостью. Кроме того, дальнейшее изучение новых механизмов положительного действия телмисартана на углеводный, жировой виды обмена веществ и сердечно-сосудистую систему через модуляцию PPARγ может существенно расширить показания для его применения в клинической практике.
* Исследование было проведено среди пациентов высокого сердечно-сосудистого риска. В исследование были включены пациенты в возрасте старше 55 лет и с наличием одного из следующих заболеваний: СД типа 2 с признаками органных поражений, ИБС, заболевания периферических артерий и др.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.