Три стадии медленного сна: хронофизиологическая реальность или всего лишь условное деление процесса постепенного углубления сна?
- Аннотация
- Статья
- Ссылки
- English
Введение
Наука о сне возникла и развивалась в тесной связи с открытиями, указывающими на стадийную природу сна. Сначала A.L. Loomis и соавт. опубликовали примеры записей электроэнцефалографического (ЭЭГ) сигнала, снятого с поверхности головы спящего человека. Записи свидетельствовали о том, что волновая структура ЭЭГ претерпевает определенные стадийные изменения в ходе погружения в сон и по мере его последующего углубления [1]. Затем E. Aserinsky и N. Kleitman дополнили данное описание наблюдением периодически возникающих вкраплений необычной фазы сна, быстроволновая структура которых напоминала таковую при дремоте или бодрствовании [2]. Более детальные инструментальные исследования, осуществленные на протяжении последующих 15 лет, привели к созданию единой стандартной системы объективного описания сна в форме гипнограммы. Суть этого описания заключается в делении исходной записи на интервалы, относящиеся к состояниям бодрствования и сна, двум фазам – медленного (иначе ортодоксального) и быстрого (иначе парадоксального) сна – и четырем стадиям медленного сна (первой, второй, третьей и четвертой) [3].
Первоначально практическое применение такой системы означало многочасовую работу одного, а лучше двух опытных специалистов – «скореров» (англ. scoring – считать – прим. ред.). Каждый из них должен был независимо от другого составить свой вариант гипнограммы. Иначе говоря, разбить полный многочасовой набор 20- или 30-секундных эпох ночного сна на интервалы, обозначенные как определенное состояние (бодрствование или сон), фаза сна (медленная или быстрая) и стадия медленного сна (первая, вторая, третья или четвертая).
История этой простой системы удивительна тем, что, несмотря на весь дальнейший прогресс науки о сне и компьютеризацию его лабораторных исследований, она до сих пор входит в число обязательных процедур научного и клинического исследования сна. Такая процедура считается необходимым условием для последующей обработки и публикации результатов практически любого научного эксперимента по изучению сна и практически любого клинического исследования его расстройств. Только сравнительно недавно была предпринята самая радикальная за пятидесятилетнюю историю этой стандартной классификации попытка ее ревизии [4, 5]. Она по большому счету свелась лишь к объединению третьей и четвертой стадий, что, кстати сказать, и так на протяжении многих предшествующих лет уже делалось в большинстве фундаментальных и клинических исследований. Эта объединенная стадия обычно именовалась медленноволновым сном (также используется термин «дельта-сон» – прим. ред.), а теперь термин «третья стадия» попросту превратился в синоним медленноволнового сна. Кроме того, обсуждалась идея введения новой стадии сонливости, которая должна была частично перекрываться с первой стадией сна и состоянием бодрствования, но это предложение было в конце концов отвергнуто [4]. Между тем с устной или печатной критикой в адрес стадийной системы описания сна не выступал разве что только ленивый [6]. Не вдаваясь во все разнообразные аспекты этой критики, отметим лишь несколько важных для последующего изложения недостатков стадийной классификации сна и те следствия, к которым эти недостатки приводят.
Традиционно сон определяют как поведенческое состояние целого организма. Для выделения стадий сна используются данные, полученные с одного из участков на поверхности головы или даже иные, чем ЭЭГ, полисомнографические сигналы. Примерами могут служить электроокулограмма и электромиограмма, которые записываются одновременно с ЭЭГ для выявления фазы быстрого сна, а также данные электроокулографии плюс запись ЭЭГ, полученная от конкретной (обычно затылочной) области, которые используются для разграничения бодрствования и первой стадии сна. Однако спектральный анализ ЭЭГ, записанной с электродов, расположенных на разных участках головы (например, переднем и затылочном), указывает на топографическую постепенность и неоднородность изменений паттернов ЭЭГ, а также на то, что сон не обязательно начинается одновременно во всех участках коры головного мозга [7, 8]. Более того, сон и бодрствование не являются взаимно исключающими состояниями, поскольку характерные для каждого из этих состояний волновые паттерны ЭЭГ могут сосуществовать достаточно длительное время [7–9]. Кроме того, возможна диссоциация между этими паттернами и поведенческими или субъективными критериями начала сна [10–12].
Применение количественных компьютеризированных методов обработки ЭЭГ, в первую очередь спектрального анализа, обычно обнаруживает постепенные, а не резкие изменения спектральной композиции ЭЭГ-сигнала в процессе погружения в сон и в ходе его последующего углубления. Иными словами, эти методы не выявляют четко очерченных границ, отделяющих бодрствование от сна, а также одну стадию медленного сна от другой [13–15]. В частности, применение спектрального анализа позволяет описать динамику наиболее мощного спектрального компонента ЭЭГ-сигнала – дельта-волн (частота 0,5–4,5 Гц) или медленноволновой активности. Она максимально снижена во время бодрствования, но обнаруживает непрерывный рост сразу после перехода ко сну и затем в процессе его дальнейшего углубления. Рост начинается сразу после смены бодрствования (обозначается как W) коротким переходным интервалом первой стадии сна (N1). Затем рост продолжается во время более длительного интервала второй стадии (N2) и достигает пика на интервале третьей стадии (N3). Эту последнюю стадию назвали медленноволновым сном из-за доминирования высокоамплитудных низкочастотных волн (более 75 мВ, 0,5–2,0 Гц). Произвольные пороговые критерии, используемые для выявления этой стадии, упоминают три таких порога (численный, частотный и амплитудный). Более 20% данной 20- или 30-секундной эпохи сна должно обнаруживать активность < 2 Гц амплитудой > 75 мкВ [3]. Медленноволновая активность не уникальна для третьей стадии. Она обычно присутствует во второй стадии сна, и наоборот, свойства ЭЭГ, по которым выявляют вторую стадию (сонные веретена и К-комплексы), обнаруживаются и в третьей стадии сна [16]. Практика показала, что такие критерии сложно применять даже при изучении сна здорового человека, так что необходимость в подобном субъективном оценивании порогов может стать причиной слабой степени согласованности между результатами работы разных «скореров» [17, 18].
Действительно, невысокая степень согласия была обнаружена при классификации соседних стадий (W/N1, N1/N2 и N2/N3), причем особенно слабый результат был выявлен при разграничении первой и третьей стадий. В частности, сравнения результатов пяти «скореров» обнаружили, что процент одновременного согласия между ними (пять из пяти) при классификации первой и третьей стадий составил только 3,6 и 18,6% соответственно [18]. Такого рода проблемы могут стать причиной ненадежной оценки длительности стадий сна, включая медленноволновой сон [17]. Важно отметить один факт. До недавнего времени медленноволновой сон и медленноволновая активность рассматривались в основном как полезные индикаторы (маркеры) глубины сна и его интенсивности. Однако исследования последних лет показали, что из-за уникальной жизненной функции измерение медленноволнового сна и медленноволновой активности может представлять специальный интерес для изучения нормального и патологического сна. В частности, была выявлена их существенная роль для нормального процесса запоминания и обучения [19–23]. В связи с тем что наличие и целостность медленноволнового сна связаны со способностью к формированию и сохранению следов памяти, недостаток именно этой стадии сна может объяснить некоторые когнитивные нарушения при бессоннице в пожилом возрасте [24, 25]. Следовательно, более надежное определение границ медленноволнового сна становится особенно актуальным для оценки его влияния на такие нарушения.
Несмотря на то что стадийная классификация дает возможность довольно экономного количественного описания сна путем выделения небольшого количества да-или-нет-переменных, именуемых стадиями, она полностью игнорирует вопрос о нейробиологическом значении и валидности такого подразделения [6]. Возникает вопрос: можно ли свести спектральные представления ЭЭГ-сигнала к такому же экономичному описанию сна, какое дает его стадийная классификация, но в то же время получить нейробиологически осмысленное описание? В ряде предыдущих публикаций мы представили экспериментальные доказательства того, что анализ ЭЭГ-спектра методом главных компонент позволяет экономично представить такой спектр в виде небольшого набора значений независимых (ортогональных и некоррелированных) компонент [26–33]. Была также высказана гипотеза, что, во-первых, традиционные спектральные характеристики ЭЭГ-сигнала (медленноволновая активность и активность в альфа-, тета-, сигма- и прочих диапазонах) отражают комбинированное воздействие нескольких оппонирующих процессов регуляции цикла «сон – бодрствование». Во-вторых, извлечение главных компонент этого спектра позволяет обнаружить ЭЭГ-подписи этих отдельных оппонирующих процессов, а не их совместное влияние [26–28].
Идея антагонистической природы хронорегуляции полностью согласуется с нейронаучными открытиями, предполагающими, что регуляция цикла «сон – бодрствование» заключается во взаимодействии оппонирующих процессов. Одни являются промоторами сна и ингибиторами бодрствования, а другие, наоборот, промоторами бодрствования и ингибиторами сна или отдельных его фаз [34–36]. В частности, исследования указывают на то, что вентролатеральные преоптические ядра гипоталамуса содержат и нейроны-промоторы сна, и нейроны-промоторы бодрствования, которые контролируют смену состояний сна – бодрствования, а также чередование медленной и быстрой фаз сна [35].
Цель
Проверка гипотезы о том, что возможность описывать любые ЭЭГ-записи сна в виде последовательности небольшого числа да-или-нет-переменных, называемых стадиями, объясняется таким свойством механизмов регуляции сна – бодрствования, как реципрокные взаимодействия между процессами-промоторами сна и бодрствования, которые ингибируют друг друга при смене одного состояния/субсостояния сна – бодрствования другим.
Материал и методы
Для проверки гипотезы были проанализированы данные двух экспериментов.
Первый эксперимент включал ЭЭГ-записи сна и бодрствования 14 женщин. Каждая из них приняла участие в двух идентичных экспериментах. Участница эксперимента находилась в лаборатории адаптационную ночь, в следующую ночь проводилась полисомнографическая запись сна. Свет выключался в 23 часа, и длительность сна не ограничивалась. В последующие сутки участнице эксперимента предлагалось заснуть в течение 20 минут в 10, 12, 14, 16, 18, 23, 01, 03 и 05 часов.
Второй эксперимент включал ЭЭГ-записи сна и бодрствования 18 молодых мужчин. Девять экспериментов с двумя участниками было проведено в экспериментальном комплексе в интервале между утром субботы и утром понедельника. Оба бодрствовали в субботу до 23 часов, а затем один из них спал до 06 часов утра, а второй бодрствовал до того же часа. Следующие 24 часа включали 12 ультрадианных циклов «сон – бодрствование», состоящих из 20-минутной попытки сна и 100 минут бодрствования. Экспериментальные протоколы более подробно описаны в предыдущей публикации [26].
Запись сна велась с помощью восьмиканального полиграфа Medicor (EEG8S, Micromed, Hungary). Она включала запись подбородочной электромиограммы (один канал), электроокулограммы (два канала) и ЭЭГ (пять каналов). Обрабатывались данные отведения Cz-A1 (вершина головы и мочка левого уха). Для фиксации электродов использовалась паста Ten20 (Nicolet Biomedical, Madison, Wisconsin, USA). Записи расшифровывались двумя независимыми «скорерами» по стандартным критериям [3]. ЭЭГ-сигнал фильтровался, оцифровывался и записывался на диск компьютера. Участки записи с артефактами выявлялись на пятисекундных интервалах, затем абсолютные спектральные мощности (µV2) вычислялись для всех остальных пятисекундных интервалов с помощью быстрого преобразования Фурье. Дальнейшая редукция информации включала усреднение значений на соседних частотах в пределах одногерцевого диапазона и усреднение полученных таким образом значений спектра на одноминутных интервалах. Значения в диапазоне от 1 до 16 Гц были конвертированы в натурально-логарифмическую шкалу и обработаны методом главных компонент. Лог-трансформированные значения дополнительно усреднялись в интервале 4 Гц, что примерно соответствует диапазонам дельта-, тета-, альфа- и сигма-активности (1–4, 5–8, 9–12 и 13–16 Гц соответственно). Из спектра такого частотного диапазона извлекались четыре главные компоненты. Для получения четырех значений главных компонент 16 значений спектральной мощности суммировались после их оптимального взвешивания в соответствии с их нагрузками на компоненту. Детальные описания методологии обработки ЭЭГ-спектра методом главных компонент были опубликованы ранее [26–33].
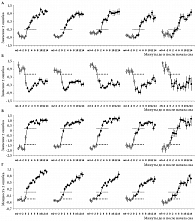
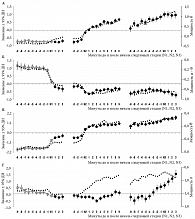
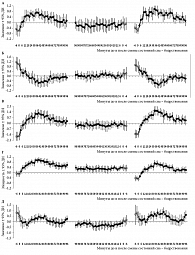
Результаты такого анализа данных отображены на рис. 1–3. Первые два рисунка основаны на данных по многократным 20-минутным попыткам сна (второй и первый эксперименты и второй эксперимент соответственно), а третий рисунок основан на данных двукратных записей ночного сна (первый эксперимент). Кривые значений главных компонент (ГК1, ГК2, ГК1-2 и ГК4) и традиционного ЭЭГ-индекса (медленноволновая активность) указаны либо с ошибкой среднего (ошибка; рис. 1), либо с доверительным интервалом (ДИ; рис. 2 и 3). Они рассчитаны путем усреднения сначала по каждому участнику эксперимента, а потом для всей группы участников одного (рис. 1 и 3) или двух экспериментов (рис. 2).
Результаты
Рисунок 1 иллюстрирует результаты подробного анализа первой стадии медленного сна («дремотный» сон) во время 20-минутных попыток заснуть. Эта стадия обычно является кратковременным переходным этапом между бодрствованием и более глубокой стадией «настоящего» сна (второй). Значения первой (ГК1) и второй (ГК2) главных компонент ЭЭГ-спектра, а также их разницы (ГК1-2) и медленноволновой активности – традиционного ЭЭГ-индекса – были рассчитаны для пяти разных задержек начала второй стадии сна (м1–м5) на 20-минутном интервале от минуты -5 до +14 относительно нулевой (0) минуты начала сна. Точечные и пунктирные линии показывают примерную границу, отделяющую первую стадию сна от бодрствования и второй стадии сна. Анализ структуры ЭЭГ-спектра методом главных компонент выявляет нейрофизиологическую природу этой стадии. Она служит «нейтральной полосой», разделяющей «противоборствующие» драйвы бодрствования и сна. Значение второй главной компоненты (предполагаемого маркера драйва бодрствования) резко снижается всегда на границе с бодрствованием (рис. 1Б), а значение первой компоненты (предполагаемого маркера драйва сна) резко возрастает всегда на границе со второй стадией (рис. 1А). На графике разницы значений этих компонент (рис. 1В) хорошо видны две «ступеньки», соответствующие стадии бодрствования и второй стадии сна, тогда как промежуток между ними занимает первая стадия. Увеличение от одной до пяти минут ведет к точно такому же увеличению промежутка между «ступенями». Напротив, если анализируется медленноволновая активность, измеренная как мощность активности в медленноволновом диапазоне ЭЭГ-спектра (рис. 1Г), такой четкой «ступенчатой» структуры не обнаруживается. После инициации сна этот традиционно используемый маркер «выплаты долга сна» просто постепенно «растает» по мере углубления сна.
Рисунок 2 представляет результаты, полученные для состояния бодрствования и всех трех стадий медленного сна в пределах 20-минутного интервала попыток сна. Значения главных компонент (первой, второй, их разницы и четвертой) и традиционные индексы были рассчитаны на трех двухстадийных интервалах (бодрствования и первой стадии сна, первой и второй стадий сна и второй и третьей стадий сна). Традиционные ЭЭГ-индексы, такие как мощность активности мозга в дельта-, альфа-, тета- и сигма-диапазонах ЭЭГ-спектра, а также их отношения, такие как разница альфа- и тета-мощности, могут довольно быстро меняться на границах первой стадии сна, хотя и не так стремительно, как значения первой (ГК1) и второй (ГК2) главных компонент ЭЭГ-спектра. Однако такие изменения традиционных индексов не обнаруживаются на границе между второй и третьей стадиями сна, поскольку она определяется исключительно условными количественными критериями (частоты, количества и амплитуды медленных волн). В противовес этим индексам значение четвертой (ГК4) главной компоненты ЭЭГ-спектра начинает свой быстрый рост где-то вблизи этой границы (рис. 2Г). Изменение знака одной из компонент происходит в районе границы между стадиями (второй – для границы между бодрствованием и первой стадией, первой – между первой и второй стадиями и четвертой – между второй и третьей стадиями). Причем такое определение границы стадии уже не является условным, поскольку граница указывает на нейрофизиологически осмысленные «ступенчатые» изменения уровня хронорегуляторных процессов. В результате появляется возможность объективно оценивать продолжительность каждой из стадий путем применения критерия пересечения нуля значением второй компоненты (рис. 2Б), первой компоненты или их разницей (рис. 2А и В) и значением четвертой компоненты (рис. 2Г). Значение компоненты меняется либо с положительного на отрицательное (ГК2), либо с отрицательного на положительное (ГК1, ГК1-2 и ГК4).
Рисунок 3 сравнивает маркеры процессов регуляции сна в начале и конце обычного ночного сна. Считается, что поэтапное снижение среднего уровня медленноволновой активности в череде ультрадианных циклов сна отражает процесс «выплаты долга сна», накопленного во время бодрствования. Значения медленноволновой активности (рис. 3Г) и значения главных компонент – ГК1 (рис. 3А), ГК2 (рис. 3Б), ГК1-2 (рис. 3В) и ГК4 (рис. 3Д) – были рассчитаны для 100-минутных интервалов в начале и конце обычного ночного сна. Для того чтобы иллюстрировать различия между этими интервалами, была дополнительно рассчитана разница между значениями, полученными в начале и конце сна. Сходство между динамикой медленноволновой активности (рис. 3Г) и динамикой ГК1-2 (рис. 3В) на всех трех интервалах позволяет предполагать, что медленноволновая активность отражает суммарный вклад драйвов сна и бодрствования в процесс регуляции «выплаты долга сна». Для того чтобы инициировать этот процесс в форме роста ГК1 (предположительно представляющей драйв сна) с минимального значения на границе первой и второй стадий до максимального уровня в третьей стадии первого цикла сна (рис. 3А), значение ГК2 (предположительно представляющей драйв бодрствования) должно заранее резко уменьшиться на границе бодрствования и первой стадии (рис. 3Б). Начало последующего этапа наиболее интенсивной «выплаты» совпадает с началом третьей стадии сна. Такое начало маркируется началом подъема ГК4 с минимального значения на интервале второй стадии (рис. 3Д). Это начало также совпадает с началом дальнейшего спада ГК2 (рис. 3Б), тогда как значение ГК1 остается стабильно высоким до самого конца третьей стадии (рис. 3А). Во время последующего перехода от медленного (ортодоксального) сна к последующей фазе быстрого (парадоксального) сна в конце первого ультрадианного цикла сна все значения компонент начинают «дружно» стремиться к значению, близкому к нулю. Наконец, после череды ультрадианных циклов сна примерно такое же соответствующее нулю значение достигается всеми компонентами на финальном этапе ночного сна (рис. 3А, Б, Д), когда «долг сна» полностью «выплачен».
Обсуждение результатов
Научное и клиническое описание сна неизменно включает создание гипнограммы, которая сводит все разнообразные паттерны ЭЭГ- и других входящих в полисомнограмму сигналов к небольшому числу да-или-нет-переменных, обозначенных как бодрствование или определенная фаза или стадия сна. На протяжении всей истории научного исследования сна одной из нерешенных научных проблем остается задача замены такого формального подхода более естественным методом, который предполагает возможность нейрофизиологически осмысленной демаркации границ между стадиями сна. Такой метод нужно не только разработать, но и теоретически обосновать. За основу предельно простого, но в то же время объективного и теоретически обоснованного подхода к определению границ между стадиями сна можно взять теоретические представления об участии оппонирующих хрононейробиологических механизмов регуляции смены состояний и субсостояний сна – бодрствования. Такую возможность подтверждают результаты анализа динамики значений главных компонент, которые, предположительно, являются ЭЭГ-маркерами антагонистических взаимодействий процессов-промоторов сна и бодрствования в фазах перехода состояний и субсостояний от одного к другому в суточном цикле «сон –бодрствование» и ультрадианных циклах сна.
Следует ожидать, что анализ ЭЭГ-спектра методом главных компонент может быть полезен для исследований в области медицины сна, причем не только тем, что позволит уменьшить субъективные влияния «скорера» на результаты описания сна в виде гипнограммы. Следует ожидать, что такой анализ может позволить лучше понять причины нарушений сна. Например, в одной из наших публикаций [33] мы описали возрастные изменения значений двух первых главных компонент. Оказалось, что процесс нормального старения сна, наиболее ранним и очевидным признаком которого является снижение медленноволновой активности и медленноволнового сна, можно объяснить не только ослаблением драйва сна (снижением значения первой компоненты), но и усилением драйва бодрствования (повышением значения второй компоненты) из-за дезингибирующего влияния ослабления драйва сна. Этот результат позволяет легко ответить на вопрос: «Почему старение сопровождается не только нарушениями цикличности состояний сна – бодрствования и нарушениями ночного сна (частыми и ранними пробуждениями), но и появлением некоторых преимуществ у пожилых людей перед молодыми людьми в условиях жизни в современном обществе?» Вероятнее всего, именно усиление драйва бодрствования позволяет пожилым людям реже засыпать непроизвольно в случае острой необходимости бодрствовать после длительного периода лишения сна или «недосыпа». Этот результат также позволяет объяснить довольно простыми причинно-следственными связями наблюдаемые с возрастом патологические изменения сна. Например, такие на первый взгляд далеко не очевидным образом связанные друг с другом симптомы, как недостаточный уровень дневного бодрствования, нежелательная дневная сонливость, появление привычки дремать днем, неспособность быстро засыпать, недостаточная продолжительность ночного сна, неудовлетворенность таким сном, поверхностность ночного сна, частые ночные пробуждения, нежелательные пробуждения ранним утром [33].
Кроме того, анализ ЭЭГ-спектра методом главных компонент позволит точнее оценивать участие процессов регуляции цикла «сон – бодрствование» в различных расстройствах ночного сна и цикла «сон – бодрствование». Например, если маркером начала процесса «выплаты долга сна» является не начало роста медленноволновой активности сразу после смены бодрствования сном, а начало роста значения первой компоненты на границе первой и второй стадий сна [30, 31], то при расчете эффективности ночного сна нужно не добавлять длительность первой стадии к общей длительности сна, а вычитать ее. Интервалы «дремотного» сна коротки только при нормальном сне, но они увеличены в два и более раз у пожилых людей и при многих расстройствах сна (бессоннице, апноэ сна и др.). Поэтому можно предположить, что субъективные ощущения нарушений ночного сна, характерные для этих людей и при этих расстройствах, не так уж существенно противоречат объективным оценкам этих нарушений, как это часто можно заключить по результатам расчета эффективности сна традиционным методом.
Наконец, такой анализ может быть направлен на обнаружение конкретных причин диссоциации между результатами объективного изучения расстройств сна и поведенческими или субъективными симптомами его нарушений. В отличие от традиционных критериев наступления сна и смены его стадий критерии, основанные на анализе ЭЭГ-спектра методом главных компонент, могут быть использованы для классификации субсостояний сна в любой области коры головного мозга [29]. Кроме того, эти критерии могут быть использованы для выявления конкретных субсостояний сонливости в пределах континуума «бодрствование –сонливость» [32]. Как известно, до сих пор градация дремотных состояний остается за пределами традиционной стадийной классификации, хотя неоднократно высказывалось мнение о том, что период, разграничивающий бодрствование и сон, является континуумом дремотных субсостояний, а не единой унифицированной стадией [14, 37].
Заключение
Результаты анализа динамики значений главных компонент обнаруживают совпадение моментов резкого изменения значений главных компонент ЭЭГ-спектра с переходами от одной стадии сна к другой. Успех традиционной стадийной системы, обеспечившей на полстолетия непрерывность научных и клинических описаний сна, может быть объяснен тем, что границы стадий сна примерно совпадают с моментами, когда состояния сна – бодрствования и субсостояния сна сменяют друг друга в результате антагонистического взаимодействия между процессами промоторами и ингибиторами сна – бодрствования.
A.A. Putilov
Scientific Research Institute of Molecular Biology and Biophysics, Novosibirsk
Contact person: Arkady Aleksandrovich Putilov, putilov@ngs.ru
Origin and history of sleep science were closely associated with discoveries leading to development of the traditional system of description of night sleep episodes as the sequences of few yes-or-no variables called sleep stages. The unexpected success of this simple system provided continuity in the scientific and clinical description of the sleep process for, at least, a half of century in despite of its numerous unresolved shortcomings. This success can be explained by a tendency for coincidence of the epochs of transition between sleep stages with the intervals of switching between sub-states of the sleep-wake continuum due to the antagonistic interaction between underlying wake- and sleep-promoting processes. This explanation was supported by the present analysis of the time courses of scores on principal components of the EEG spectrum that were utilized as the EEG indicators of these processes. Particularly, it was found that the rapid zero-crossing changes in these scores usually occurred during transition between wake and sleep states and sub-states. Prospects of implementation of this approach to principal component scoring of the EEG spectrum in sleep medicine are also discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.