Тройная терапия при хроническом гепатите C: реальные успехи
- Аннотация
- Статья
- Ссылки
- English





Еще 10 лет назад хронический гепатит C считался заболеванием, трудно поддающимся лечению. Благодаря внедрению новых схем терапии частота устойчивого вирусологического ответа (УВО) значительно возросла. В частности, особую роль сыграл переход от монотерапии интерфероном-альфа к комбинированной терапии пегилированным интерфероном-альфа (ПЭГ-ИНФ-альфа) и рибавирином. Комбинация ПЭГ-ИНФ-альфа и рибавирина является стандартом противовирусной терапии (ПВТ) у пациентов с хроническим гепатитом C. Длительность терапии – 16–48 недель в зависимости от генотипа вируса. Эффективность в виде достижения УВО составляет в среднем 42–52% у пациентов с 1 генотипом вируса гепатита С (HCV) и 76–82% – у пациентов с 2 и 3 генотипами [1, 2]. К недостаткам ПВТ можно отнести недостаточную эффективность, особенно у пациентов с 1 генотипом, и длительный курс лечения (при 1 генотипе – 24–48 недель, при 2 и 3 генотипах – 16–24 недели).
В 2011 г. Агентство по контролю пищевых продуктов и лекарственных препаратов США (United States Food and Drug Administration, FDA) и Европейское агентство лекарственных средств (European Medicines Agency, EMA) одобрили для клинического применения препараты прямого противовирусного действия – ингибиторы протеазы HCV – телапревир и боцепревир – для лечения хронического гепатита C у больных, инфицированных 1 генотипом HCV. Результаты рандомизированных клинических исследований (РКИ) показали, что у таких пациентов тройная терапия достоверно более эффективна по сравнению со стандартной ПВТ. Кроме того, тройная терапия – единственная альтернатива для пациентов с неэффективной предшествующей ПВТ.
Тройная терапия сложна как для пациента, так и для лечащего врача. От стандартной ПВТ тройную терапию отличают повышение эффективности лечения, сокращение сроков ПВТ, набор благоприятных предикторов УВО (до сегодняшнего дня продолжает уточняться), строгие правила отмены, при нарушении которых возникает риск развития резистентности к ингибиторам протеазы, риск лекарственных взаимодействий, дополнительные нежелательные явления.
Главное преимущество тройной терапии – повышение эффективности и сокращение сроков ПВТ при использовании принципа «терапия по ответу». Результаты множества опубликованных РКИ демонстрируют увеличение частоты УВО в группах пациентов, не получавших ранее лечения. Кроме того, частота УВО возрастала при неэффективности предшествующей терапии [2–5]. Основываясь на результатах РКИ II и III фазы применения боцепревира или телапревира в схемах тройной терапии, можно судить о достоверном повышении УВО как минимум на 20–25% (табл. 1).
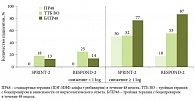
В ряде исследований выявлена зависимость УВО от полиморфизма гена IL28В и обозначен круг пациентов с заведомо низкой вероятностью достижения УВО. Так, среди представителей европеоидной расы частота УВО составила 69, 33 и 27% в группах генотипов СС, СТ, ТТ соответственно, среди пациентов негроидной расы – 48, 15 и 13%. При анализе показателей пациентов, не получавших ранее лечения, выявлено существенное увеличение частоты УВО при тройной терапии в группах «неблагоприятного» варианта полиморфизма гена IL28В. В исследовании III фазы SPRINT-2 частота достижения УВО составила 80, 71 и 59% в группах генотипов СС, СТ и ТТ, по результатам исследования ADVANCE – 90, 71 и 73% у пациентов с генотипами СС, СТ, ТТ соответственно. Эти данные позволяют рекомендовать тройную терапию пациентам, ранее не получавшим лечения, в зависимости от наличия «неблагоприятного» варианта полиморфизма гена IL28В (табл. 2).
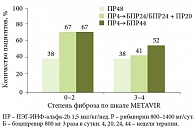
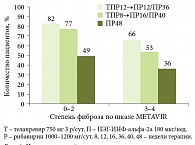
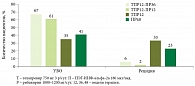
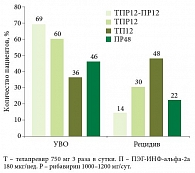
Данные исследований ADVANCE и SPRINT-2 демонстрируют снижение эффективности стандартной терапии по мере прогрессирования фиброза. Так, согласно результатам SPRINT-2, частота достижения УВО при стандартной терапии составила 38% [6], по данным ADVANCE – 49% при 0–2-й степени фиброза и 36% – при 3-й и 4-й степени. В то же время эффективность тройной терапии была существенно выше: у пациентов с выраженным фиброзом частота УВО при использовании боцепревира достигла 52% (рис. 1), телапревира – 66% (рис. 2). Несмотря на различия в схемах применения, группы тройной терапии сопоставимы по эффективности. Частота достижения УВО достоверно выше по сравнению с контрольной группой пациентов, получавших только ПЭГ-ИНФ-альфа и рибавирин.
Такая же закономерность прослеживается в группах с выраженным фиброзом у пациентов с неэффективной предшествующей ПВТ (нон-респондеры). Для обсуждения результатов исследований II и III фазы с применением препаратов боцепревир и телапревир нон-респондеров целесообразно разделить на три группы:
- первая – рецидив: неопределяемая HCV PHK по окончании стандартной терапии, но обнаружение HCV PHK в период наблюдения;
- вторая – частичный вирусологический ответ: при снижении виремии на 2 log10 и более в течение 12 недель терапии, но при этом неопределяемый уровень HCV PHK не достигнут;
- третья – нулевой ответ: при снижении HCV PHK менее 2 log10 к 12-й неделе терапии.
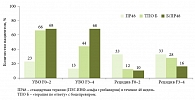
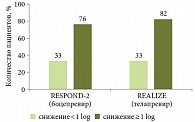
В исследовании RESPOND-2 (рис. 3) продемонстрировано влияние исходной стадии фиброза на достижение УВО при двойной терапии. В группе сравнения (при двойной терапии) частота достижения УВО составила 13–23% в зависимости от варианта вирусологического ответа, при тройной терапии – 68% [7].
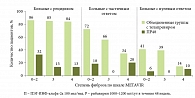
При анализе результатов исследования REALIZE (телапревир применяли в комбинации с ПЭГ-ИНФ-альфа и рибавирином) выявлена та же закономерность. Эффективность тройной терапии у больных с рецидивом при фиброзе 0–2-й, 3-й и 4-й степени составила 86, 85 и 84% соответственно. Меньшая эффективность отмечена в группах больных с частичным и нулевым ответом. Кроме того, при сравнении эффективности стандартной и тройной терапии установлена достоверная разница в частоте УВО у больных с частичным и нулевым ответом (рис. 4).
Важным теоретическим и практическим достижением стандартной терапии является обоснование принципа «терапии по ответу», что позволяет оптимизировать курс лечения, делая его более персонализированным и экономически выгодным. В РКИ II и III фазы тройной терапии также доказана возможность применения принципа «терапия по ответу», в результате чего у пациентов без цирроза печени появилась возможность не только увеличить частоту УВО, но и сократить курс лечения [8], что кроме всего прочего означает снижение и медикаментозной, и финансовой нагрузки на пациента.
В исследованиях PROVE-1
и PROVE-2 с применением телапревира продемонстрированы результаты в отношении достижения УВО в группах сокращенного курса на основе «терапии по ответу». Частота УВО в исследовании PROVE-1 достигла 67% в группе ПВТ в течение 48 недель и 61% в группе «терапии по ответу» в течение 24 недель (рис. 5). В исследовании PROVE-2 частота УВО составила 69 и 60% соответственно (рис. 6).
В исследовании III фазы SPRINT-2 показано, что эффективность «терапии по ответу» с боцепревиром при возможности сокращения курса лечения не уступала эффективности полного курса ПВТ. Результаты РКИ III фазы демонстрируют более высокую частоту УВО по сравнению со II фазой. Скорее всего это объясняется эффективной коррекцией нежелательных явлений [9, 10, 11].
Результаты РКИ позволили составить четкие алгоритмы ведения пациентов при тройной терапии в зависимости от категории больных, наличия цирроза, вирусологического ответа.
Для терапии боцепревиром обязательным условием является наличие вводной фазы (вводного периода). В связи с этим важно отметить несколько моментов.
Основная задача вводного периода – наметить группу пациентов, у которых стандартная ПВТ прогностически малоэффективна и которым требуется тройная терапия. Это позволит избежать необоснованных затрат на лечение и необязательной медикаментозной нагрузки в случае продолжения двойной терапии. Таким образом, можно говорить об использовании динамики снижения уровня HCV PHK после вводной фазы в качестве критерия прогнозирования достижения УВО и для решения вопроса о тактике дальнейшего лечения (рис. 7 и 8).
При изменении вирусной нагрузки менее чем на 2 log10 (а тем более – менее чем на 1 log10) можно говорить о низкой чувствительности пациента к ПЭГ-ИНФ-альфа, что дает основания для продолжения ПВТ только в виде тройной терапии.
Вводный период позволяет оценить переносимость стандартной терапии, темпы развития анемии, несколько снизить агрессивность развития последней. Так, по результатам РКИ [12] отсутствие вводной фазы можно считать предиктором и фактором риска развития тяжелой анемии, а также анемии, требующей проведения гемотрансфузии.
Результаты исследований RESPOND-2 и PROVE-2 продемонстрировали, что вводный период при отсутствии снижения виремии можно использовать как ранний предиктор развития мутантных штаммов HCV, резистентных к проводимой терапии. В этом случае своевременная отмена ПВТ позволит избежать развития лекарственной резистентности.
Перечислим схемы лечения с применением боцепревира в зависимости от категории пациентов.
Для пациентов, ранее не получавших лечения, по окончании 4 недель вводного периода дополнительно назначается боцепревир строго в сочетании со стандартной терапией ПЭГ-ИНФ-альфа и рибавирином:
- при отсутствии HCV PHK на 8-й и 24-й неделе терапии ее длительность составляет 28 недель;
- при наличии HCV PHK на 8-й неделе терапии и отсутствии на 24-й неделе тройная терапия продолжается 32 недели с последующим применением стандартной терапии ПЭГ-ИНФ-альфа и рибавирином в течение 12 недель.
Для нон-респондеров предусмотрен следующий алгоритм:
- при отсутствии HCV PHK после 8-й и 24-й недели для пациентов с рецидивом и частичным вирусологическим ответом продолжительность терапии составляет 32 недели;
- при наличии HCV PHK после 8 недель терапии и отсутствии после 24 недель тройная терапия продолжается 32 недели с последующим применением стандартной терапии ПЭГ-ИНФ-альфа и рибавирином в течение 12 недель.
Для пациентов с циррозом печени длительность тройной терапии всегда составляет 48 недель (табл. 3).
РКИ с применением телапревира показали отсутствие достоверной разницы в достижении УВО у пациентов при наличии и отсутствии вводной фазы [13], что послужило поводом для одобрения телапревира к использованию в клинической практике без вводной фазы.
У пациентов, ранее не получавших лечения, телапревир назначается с первого дня терапии строго в сочетании со стандартной терапией ПЭГ-ИНФ-альфа и рибавирином длительностью 12 недель:
- при отсутствии виремии, HCV PHK(-), после 4-й и 12-й недели длительность терапии составляет 24 недели;
- при обнаружении вируса, HCV РНК(+), после 4-й или 12-й недели – 48 недель.
Для нон-респондеров (рецидив, частичный вирусологический ответ, нулевой ответ), как и для пациентов с циррозом печени, возможен единственный вариант назначения тройной терапии с телапревиром – 12 недель, общая продолжительность ПВТ – 48 недель (табл. 4).
Важный момент: при проведении тройной терапии необходимо строго соблюдать правила отмены. Неэффективная тройная ПВТ с применением боцепревира должна быть вовремя остановлена, чтобы предотвратить формирование боцепревир-резистентных штаммов HCV. Если на 12-й неделе ПВТ (то есть на 8-й неделе тройной терапии) уровень HCV PHK составляет более 100 МЕ/мл или на 24-й неделе ПВТ (то есть на 20-й неделе тройной терапии) не достигнута авиремия, лечение должно быть остановлено.
Что касается телапревира, лечение должно быть прекращено, если уровень HCV PHK превышает 1000 МЕ/мл после 4-й и/или 12-й недели тройной терапии, и при определяемом количестве HCV PHK на 24-й неделе ПВТ (табл. 5) [14].
Эти правила основаны на данных доказательной медицины, полученных в ходе многоцентровых РКИ. Наличие HCV PHK в указанных выше титрах свидетельствует о неэффективной ПВТ, продолжение которой не обосновано ни клинически, ни экономически. Кроме того, продолжение терапии может стать причиной возникновения резистентных штаммов, что показано в РКИ II и III фазы в группах с рецидивом и отсутствием вирусологического ответа.
К особенностям тройной терапии можно отнести риск развития нежелательных явлений, не характерных для стандартной ПВТ. К сожалению, в РКИ тройная терапия показала множество нежелательных явлений, которые, вероятно, впоследствии станут ограничивать применение ингибиторов протеазы I поколения.
Исходя из изложенного можно сделать следующие выводы:
1. Новые препараты для лечения хронического гепатита C – ингибиторы сериновой протеазы (боцепревир, телапревир) послужили основой для создания схем тройной терапии. Эффективность лечения у пациентов с 1 генотипом HCV заметно возросла.
2. Применение принципа «терапия по ответу» максимально обеспечивает индивидуальный подход при проведении ПВТ, что позволяет сократить длительность лечения, снизить медикаментозную нагрузку и экономические расходы.
3. Максимальная эффективность лечения достигается при использовании дифференцированного подхода к выполнению всех режимов ПВТ в зависимости от исходных данных пациента, при наличии знаний и навыков по диагностике и коррекции нежелательных явлений и соблюдении правил отмены тройной терапии.
Triple therapy for chronic hepatitis C: therapeutic advances
I.G. Bakulin, A.A. Varlamicheva
Central Research Institute of Gastroenterology, Moscow
Contact person: Igor Gennadyevich Bakulin, igbakulin@yandex.ru
Novel hepatitis C virus protease inhibitors telaprevir and boceprevir are now available for the management of hepatitis C genotype 1 patients in Russia. Marketing authorization was granted for telaprevir in December 2012, and for boceprevir in May 2013. Numerous randomized clinical studies of triple therapy have demonstrated improved efficacy and decreased duration of antiviral treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.