Лекарственно-индуцированная организующаяся пневмония – редкое нежелательное явление при противовирусной терапии цирроза печени HCV-этиологии
- Аннотация
- Статья
- Ссылки
- English
Введение
Несмотря на активное внедрение в клиническую практику малодоступных безинтерфероновых комбинаций противовирусной терапии (ПВТ) по поводу HCV-инфекции, препаратами выбора у пациентов остаются схемы ПВТ, содержащие пегилированный интерферон (ПЭГ-ИФН-альфа) и рибавирин. Именно эти препараты требуют тщательного мониторинга и коррекции доз при проведении ПВТ у пациентов с циррозом печени (ЦП). В настоящее время в России стандартом лечения пациентов с генотипом 1 считается тройная терапия с применением ингибиторов протеазы (ИП) телапревира, боцепревира, симепревира. Имеются данные об эффективности тройной терапии в российской популяции с применением телапревира у пациентов с фиброзом и циррозом, включенных в программу раннего доступа. Частота устойчивого вирусологического ответа (УВО) составила у пациентов, ранее не получавших лечения, 82%, у пациентов с рецидивом – 96% и пациентов с «нулевым» ответом – 67%. Такие результаты скорее всего обусловлены преобладанием в России пациентов с генотипом 1b, при котором применение ИП эффективнее, чем при генотипе 1а [1].
По данным Центрального научно-исследовательского института гастроэнтерологии Московского клинического научно-практического центра (ЦНИИГ МКНЦ), за три квартала 2014 г. на стационарном лечении находилось 94 пациента с ЦП HCV-этиологии, 14 из них получали ПВТ. При этом стандартную терапию (ПЭГ-ИФН-альфа-2а и рибавирин) получали восемь пациентов, тройную ПВТ с ИП – шесть. Отметим, что из шести пациентов у двоих терапия была прервана досрочно: у одного пациента отмечалась декомпенсация основного заболевания с развитием асцита, кровотечения из варикозно расширенных вен пищевода, впоследствии зафиксирован рецидив виремии, у другого – развитие лекарственно-индуцированной организующейся пневмонии. У пяти пациентов констатирован непосредственный вирусологический ответ.
У всех пациентов отмечались гематологические нежелательные явления (НЯ) различной степени. Кроме того, зафиксированы такие НЯ, как телапревир-индуцированный дерматит и организующаяся пневмония.
Как известно, общая частота побочных эффектов, вследствие которых ПВТ может быть прекращена, составляет в среднем около 10–14%. Помимо распространенных и хорошо изученных гриппоподобных симптомов, психиатрических нарушений, гематологических, кожных НЯ встречаются более редкие: лекарственно-индуцированные аутоиммунные и пневмотоксические (интерстициальный фиброз легких, облитерирующий бронхиолит, легочный гранулематоз).
Организующаяся пневмония: современное представление об этиопатогенезе, диагностике, лечении
В настоящее время клиницисты и морфологи особое внимание уделяют организующейся пневмонии (ОП) (синонимы: облитерирующий бронхиолит с организующейся пневмонией, пролиферативный бронхиолит). В большинстве случаев причина развития заболевания остается неясной [2]. Однако в ряде случаев развитие ОП связывают с системными заболеваниями соединительной ткани (ревматоидный артрит) и триггерными агентами различной природы, в том числе лекарственными средствами (амиодарон, препараты золота и др.) [3].
Поражение легких лекарственной этиологии возникает из-за токсического или аллергического воздействия на паренхиму легких и приводит к повреждению легочных сосудов, агрегации воспалительных клеток. В 1994 г. японские исследователи отметили связь между развитием ОП и терапией интерферонами [4]. Как известно, интерфероны – многофункциональные белки, не только обладающие противовирусной активностью, но и влияющие на клеточную дифференцировку, выработку антигенов, регулирующих активность естественных киллеров и цитотоксичных Т-лимфоцитов, приводящих к ингибированию ангиогенеза. Таким образом, ОП дополняет спектр пневмотоксических НЯ, возникающих на фоне ПВТ с использованием интерферонов в 0,4% случаев [5].
Распространенность заболевания ОП – шесть-семь случаев на 100 000 населения [6]. Заболевание встречается в основном у пациентов в возрасте 50–60 лет независимо от пола. Типичные жалобы при ОП: непродуктивный кашель, одышка и лихорадка на протяжении нескольких месяцев. Часто (до 41% случаев) лихорадка носит интермиттирующий характер. В 23% случаев лихорадка острая, требует дифференциального диагноза с бактериальной пневмонией. В 30–50% случаев ОП манифестирует гриппоподобным состоянием [7].
Отличительными признаками патологического процесса при компьютерной томографии (КТ) и высокоразрешающей КТ являются двухсторонние участки уплотнения легочной ткани, расположенные преимущественно в нижних долях легких, кортикальных отделах или перибронхиально. Типичный признак – утолщение стенок бронхов и расширение их просвета в зонах уплотнения. Иногда в прилежащей легочной ткани обнаруживают очаговые образования разного размера. Подобные изменения обычно выявляют у больных с так называемой затяжной пневмонией. Основным, но необязательным отличием ОП от затяжной пневмонии является двухсторонний характер изменений в легких и длительное сохранение таких изменений несмотря на проводимую антибактериальную терапию. Зоны уплотнения легочной ткани по типу матового стекла выявляются у большинства больных с нормальным иммунным статусом и почти у всех пациентов с иммунодефицитом. В последнем случае изменения могут быть единственным проявлением патологического процесса. Описаны также атипичные проявления ОП в виде очаговой диссеминации или одиночных патологических образований, напоминающих злокачественную опухоль. Часто встречается двухсторонняя криптогенная (идиопатическая) пневмония – 60–70%. На долю ОП в прикорневой зоне приходится 25–30% случаев, в верхушке – 20–30% [7].
Рутинные лабораторные исследования неспецифичны. Обычно выявляются лейкоцитоз с палочкоядерным сдвигом, эозинофилия, увеличение скорости оседания эритроцитов (СОЭ) [8]. Аутоантитела всегда отрицательны или присутствуют в очень низком титре [9]. Отмечается увеличение титра интерлейкинов [9, 10, 11]. Бронхоальвеолярный лаваж (БАЛ) проводится для исключения других заболеваний, способных имитировать ОП, прежде всего эозинофильной пневмонии и интерстициального легочного фиброза. При ОП данные БАЛ представляют микст белых клеток крови: как правило, превалируют лимфоциты – 65%, нейтрофилы – до 10%, эозинофилы – около 5%. Остальные клетки представлены макрофагами, плазматическими клетками, редко эпителиальными клетками [9]. Дифференциальный диагноз ОП проводят с бактериальной пневмонией, хронической эозинофильной пневмонией, бронхоальвеолярным раком и лимфомой легких.
Единственный метод лечения ОП – терапия глюкокортикостероидами (ГКС). Авторы многочисленных исследований рекомендуют применять преднизолон в дозе 1–1,5 мг/кг в течение 2–4 недель. Если состояние пациента стабильное, впоследствии дозу можно снизить до 0,5 мг/кг и поддерживать ее в течение 3–6 месяцев [12, 13]. В большинстве случаев клиническое улучшение наступает на второй-третий день. Через месяц рентгенологические изменения полностью регрессируют. Мониторирование состояния рекомендовано проводить каждые 4–6 недель. Общая длительность терапии ГКС может составлять 6–12 месяцев, поскольку не исключен рецидив заболевания. При тяжелом течении к терапии добавляют циклофосфамид в дозе 1–2 мг/кг с постепенным увеличением дозы до 150 мг/сут [14, 15]. При использовании ГКС прогноз заболевания обычно благоприятный [7, 11].
Клиническое наблюдение
Больной М., 49 лет (1967 г.р.), в ноябре 2013 г. обратился в отделение хронических заболеваний печени ЦНИИГ МКНЦ для дообследования и решения вопроса о ПВТ.
Из анамнеза: ранее длительно занимался убоем крупного и мелкого рогатого скота, злоупотреблял алкоголем, с 2010 г. не работает. В 2010 г. впервые выявлены маркеры HCV-инфекции, установлен хронический гепатит С (ХГС). В августе 2013 г. находился на стационарном лечении по поводу острого кровотечения из варикозно расширенных вен прямой кишки. При обследовании установлен цирроз печени HCV-этиологии, осложненный асцитом.
После дообследования больному установлен диагноз цирроза печени HCV-этиологии, класс А (5 баллов) по шкале Чайлда – Пью, MELD – 7, умеренной степени активности, в стадии репликации (генотип 1b, высокая виремия), ИЛ-28В-СТ-генотип, степень фиброза F4 (по данным фиброэластометрии). Портальная гипертензия: варикозное расширение вен пищевода 1-й степени, расширение воротной вены. Спленомегалия. Гиперспленизм: тромбоцитопения и анемия легкой степени. Хронический комбинированный геморрой, вне обострения. Артериальная гипертензия 2-й степени. Острые эрозии желудка. Эрозивный бульбит. Хронический дуоденит.
Рекомендована ПВТ: ПЭГ-ИФН-альфа-2а (в дозе 180 мкг в неделю) и рибавирин (1200 мг/сут).
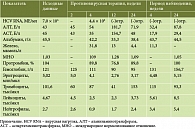
Исходные лабораторные показатели перед ПВТ представлены в таблице. Обращало на себя внимание наличие латентной тромбоцитопении (101 тыс/мкл), отсутствие признаков гепатодепрессии (альбумин – 45,5 г/л), минимальные проявления цитолитического синдрома (аланинаминотрансфераза (АЛТ)/аспартатаминотрансфераза (АСТ) – 43/45 Е/л).
Через две недели ПВТ в клиническом анализе крови отмечено снижение всех показателей: гемоглобин – 120 г/л, тромбоциты – 60 тыс/мкл, лейкоциты – 4,5 тыс/мкл. С целью коррекции тромбоцитопении был назначен элтромбопаг 25 мг/сут.
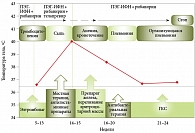
Через четыре недели ПВТ было констатировано снижение виремии – уровень HCV РНК уменьшился на 3log10 (до 4,4 × 103 МЕ/мл). Однако, учитывая отсутствие быстрого вирусологического ответа, а также наличие неблагоприятных предикторов УВО (генотип 1, ИЛ-28В-СТ-генотип, высокая вирусная нагрузка, мужской пол, возраст старше 40 лет, вес более 75 кг, цирроз печени), пациенту рекомендовали перейти на тройную ПВТ с добавлением к стандартному лечению телапревира (ингибитор протеазы NS3A) в дозе 2250 мг/сут (рис. 1).
Через восемь недель тройной ПВТ больной отметил першение в горле, повышение общей слабости, учащение носовых кровотечений, в связи с чем пациенту была предложена госпитализация в ЦНИИГ для коррекции терапии. При поступлении состояние удовлетворительное. Кожа смуглой окраски, кожа тыльной стороны обеих кистей сухая, шелушится. На коже плеч, груди – множественные телеангиоэктазии, в области плеч следы от инъекции ПЭГ-ИФН. Гиперемия передних дужек, пальпируется нижнеподчелюстной лимфатический узел слева, размер 1,5 см, безболезненный. Печень: нижний край левой доли выступает из-под края реберной дуги на 9–10 см, плотный, бугристый, селезенка +4 см из-под края левой реберной дуги. Размеры по Курлову 17 × 15 × 9 см. Со стороны других органов и систем без особенностей.
Клинический анализ крови: анемия средней степени (гемоглобин – 81 г/л), тромбоцитопения средней степени (67 тыс/мкл), легкая лейкопения (2,01 тыс/мкл), СОЭ – 29 мм/ч.
Биохимический анализ: проявления умеренного цитолиза (АЛТ/АСТ – 181/155 Е/л), гипоальбуминемия легкой степени (33,3 г/л). С учетом развития тяжелой анемии дозу рибавирина снизили до 200 мг (ранее ввиду развития рибавирин-индуцированной анемии проводилось пошаговое снижение).
Консультация ЛОР-врача: субатрофический фарингит, хронический ларингит; назначена небулайзерная терапия Флуимуцилом № 10.
Через десять недель тройной ПВТ у больного отмечалось повышение температуры до фебрильных цифр, появление на коже рук, туловища, задней поверхности бедра розеолезных высыпаний (рис. 1), склонных к слиянию, шелушащихся, сопровождающихся зудом.
Консультация дерматовенеролога: лекарственная сыпь – телапревир-индуцированный дерматит средней степени тяжести (диффузная сыпь с поражением менее 50% площади поверхности тела).
Несмотря на комплексную терапию (Эриус 5 мг/сут, Атаракс 50 мг/сут, мазь Тридерм два раза в сутки), в течение нескольких последующих дней отмечалось прогрессирование кожных проявлений. Это расценивалось как тяжелая кожная нежелательная реакция и потребовало отмены телапревира при сохранении стандартной терапии ПЭГ-ИФН-альфа-2а (в дозе 180 мкг/нед) + рибавирин (200 мг/сут).
В течение последующих шести недель у больного сохранялась лихорадка фебрильного характера, периодически с ознобами, что потребовало активного дифференциально-диагностического поиска и исключения инфекционной причины лихорадки. Для уточнения генеза лихорадки было проведено комплексное обследование: ультразвуковое исследование органов брюшной полости, эхокардиография, рентгенография легких, общий анализ крови, прокальцитониновый тест, бактериальный посев мочи и крови, аутоантигенный статус. В результате тщательного обследования в динамике каких-либо данных об инфекционном процессе, а также аутоиммунной природе лихорадки не выявлено.
Консультация инфекциониста: исключены заболевания дизентерийной и тифо-паратифозной групп, антропозоонозные заболевания, риккетсиоз, бруцеллез, малярия.
Наличие отрицательного диаскинтеста позволило фтизиатру исключить туберкулез.
Больному провели эмпирическую антибактериальную (рифаксимин 800 мг/сут в течение недели) и противогрибковую (флуконазол 200 мг/сут пять дней) терапию, что не привело к отчетливому регрессу лихорадки.
Все это время пациент получал двойную ПВТ: доза рибавирина составляла 200 мг/сут, за исключением двухнедельного периода, когда пациент не получал препарат из-за прогрессирования анемии. Необходимо также отметить, что за время госпитализации дважды были пропущены инъекции ПЭГ-ИФН-альфа-2а из-за повышения температуры до 39–40 0С. Из-за отсутствия достоверных данных об инфекционных осложнениях, а также вследствие полного купирования кожных НЯ было решено возобновить двойную ПВТ на 17-й неделе.
Кроме того, в период госпитализации имело место учащение носовых кровотечений, неоднократно отмечалось наличие крови в стуле.
Консультация проктолога: по поводу обострения хронического геморроя рекомендованы диета, микроклизмы с ромашкой, применение Дюфалака, Венаруса, мази Постеризан форте.
Несмотря на проводимую терапию, у больного развилось кровотечение из геморроидальных узлов, что привело к нарастанию анемии (гемоглобин – 58 г/л), по поводу чего проведено однократное переливание эритроцитарной массы, терапия препаратом железа (Тардиферон 80 мг/сут). Рибавирин временно отменили. Генез анемии расценивался как смешанный: постгеморрагический, гемолитический (рибавирин-индуцированный). При этом тяжелая степень анемии не снижала качество жизни.
Частое использование нестероидных противовоспалительных препаратов требовало проведения эзофагогастродуоденоскопии. Выявлено прогрессирование портальной гипертензии – варикозное расширение вен пищевода 2-й степени, хронический гастродуоденит с наличием эрозий. Были назначены ингибиторы протонной помпы в стандартной дозе.
Через 20 недель тройной ПВТ у больного внезапно появились сухой непродуктивный кашель, боли в грудной клетке, отмечался гектический характер температуры. Объективно: в правом легком по передней поверхности крепитация в верхних отделах.
Клинический анализ: лейкоциты – 4,3 тыс/мкл, палочкоядерный сдвиг – 31%, СОЭ – 21 мм/ч.
Рентгенография органов грудной клетки: правосторонняя верхнедолевая плевропневмония. Назначены антибактериальная терапия цефалоспоринами третьего поколения (Цефабол 2 г/сут внутривенно), Флуимуцил (300 мг/сут).
Бронхоскопия выявила хронический бронхит 1-й степени интенсивности воспаления.
Посев БАЛ отрицательный.
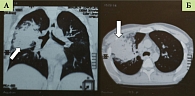
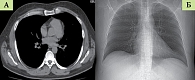
КТ органов грудной клетки: легочная ткань третьего сегмента верхней доли правого легкого уплотнена за счет выраженной инфильтрации различной степени, имеется тенденция к формированию множественных сливных участков уплотнения альвеолярной ткани. Воздушная бронхограмма в пораженных участках сохранена. Уплотненная легочная ткань резко ограничена междолевой щелью и широким основанием прилежит к реберной плевре. Плевральный выпот не выявляется. Сосудистый рисунок обоих легких усилен.
Заключение: КТ-картина верхнедолевой пневмонии правого легкого, легочной гипертензии, лимфоаденопатии средостения (рис. 2).
Положительная динамика в клинико-лабораторных данных отсутствовала, и пациента направили на консультацию к пульмонологу. Изменена схема антибактериальной терапии: назначен препарат из группы карбапенемов (Меронем 3 г/сут внутривенно), продолжено лечение Флуимуцилом (600 мг/сут внутривенно).
Несмотря на проводимую терапию, в клинической картине в течение последующих трех суток положительной динамики не наблюдалось: сохранялась фебрильная лихорадка, сопровождавшаяся ознобами, нарастание анемии (гемоглобин – 78 г/л) и тромбоцитопении (53 тыс/мкл).
С учетом клинической картины, прогрессирования заболевания на фоне антибактериальной терапии, высокой плотности инфильтратов в легком (по данным КТ) было высказано сомнение в отношении бактериального генеза пневмонии. К терапии добавили коротким курсом преднизолон (60 мг/сут внутривенно капельно № 5), эуфиллин (2,4% 10,0 в течение десяти суток), ванкомицин (1 г/сут семь дней), что способствовало нормализации температуры тела.
Повторная консультация пульмонолога: высказано предположение о наличии организующейся пневмонии, лекарственно-индуцированном генезе пневмонии (наиболее вероятно, интерферон-индуцированный генез). Продолжение антибактериальной терапии представлялось нецелесообразным, дозу ГКС увеличили до 120 мг/сут в течение трех дней с последующим переходом на 90 мг/сут в течение двух недель.
На 24-й неделе тройной ПВТ с учетом результатов клинико-лабораторных и инструментальных данных (наличие НЯ) было решено отменить ПВТ. Вместе с тем на фоне терапии ГКС в указанной дозе отмечалось улучшение состояния, температура нормализовалась. Пациент выписан с рекомендациями по применению ГКС (Метипред 20 мг/сут), препаратов железа (Тардиферон 80 мг/сут), ингибиторов протонной помпы (Нольпаза 20 мг/сут). В плане обследования рекомендовано проведение КТ органов грудной клетки с консультацией пульмонолога, эзофагогастродуоденоскопии, ультразвукового исследования органов брюшной полости, контрольного биохимического исследования крови, общего анализа крови, HCV РНК коагулограммы (каждые три месяца), исследование на альфа-фетопротеин (два раза в год).
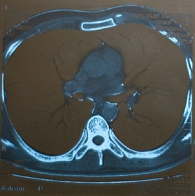
Через четыре недели наблюдения (после отмены ПВТ) согласно схеме мониторинга отмечена отчетливая положительная динамика: при контрольной КТ органов грудной клетки инфильтративных изменений в легких не выявлено (рис. 3), показатели клинического и биохимического анализов крови в норме, анализ крови на HCV РНК отрицательный.
Через шесть месяцев наблюдения (после отмены ПВТ) при контрольной КТ органов грудной клетки инфильтративных изменений в легких не выявлено (рис. 4), в связи с чем пациенту рекомендовано пошаговое снижение дозы Метипреда по 4 мг/нед до полной его отмены.
Клинический анализ крови: тромбоцитопения легкой степени (93 тыс/мкл).
Биохимический анализ крови: проявления минимального цитолиза (АЛТ – 87,8 Е/л). Согласно клинико-лабораторным данным степень тяжести осталась прежней: по шкале Чайлда – Пью – 5 баллов (до лечения 5 баллов), MELD – 7 баллов (до лечения 7 баллов). Наконец, вероятно, самый важный момент, прежде всего, с точки зрения прогноза и дальнейших рекомендаций для пациента: получен отрицательный анализ крови на HCV РНК, что указывает на достижение у пациента УВО.
Заключение
Лекарственно-индуцированные НЯ, наблюдаемые на фоне применения различных лекарственных средств (амиодарон, препараты золота, моноклональные антитела, ИФН, сульфасалазин, месалазин), нередко требуют отмены жизненно важных фармакоагентов и приводят к осложнениям или новому заболеванию. При подозрении на лекарственно-индуцированные НЯ в большинстве случаев требуется дифференциально-диагностический поиск, позволяющий исключить иные причины развившегося состояния.
Возникновение в представленном клиническом случае ИФН-индуцированных НЯ в виде организующейся пневмонии расширяет наши представления о возможных побочных эффектах и позволяет оценить не только спектр НЯ, но и трудности, с которыми может столкнуться практический врач при проведении ПВТ у пациентов с ЦП.
Важно помнить о таких известных гематологических НЯ, как анемия, лейко- и нейтропения, тромбоцитопения [16–18], которые у больных ЦП при проведении ПВТ отмечаются достоверно чаще. Кроме того, необходимо прогнозировать риски в зависимости от исходных характеристик пациентов, способные привести не только к декомпенсации основного заболевания и отмене препарата, но и к развитию инфекционных и лекарственно-индуцированных осложнений.
I.G. Bakulin1, 2, N.Kh. Dianova1, Yu.M. Yunusova1, Ye.V. Reyzen1
1 Moscow Clinical Research and Practical Center of the Moscow Healthcare Department
2 Moscow State University of Food Production
Contact person: Igor Gennadyevich Bakulin, igbakulin@yandex.ru
This article describes a rare clinical case of organizing pneumonia associated with interferon in the patient with HCV-cirrhosis treated by triple antiviral therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.