Цервикальная интраэпителиальная неоплазия и рак шейки матки. Вирус папилломы человека – единственный фактор риска?
- Аннотация
- Статья
- Ссылки
- English

Эпидемиология рака шейки матки
Ежегодно раком шейки матки (РШМ) заболевают более 570 тыс. женщин во всем мире, что составляет 6,6% в общей структуре злокачественных опухолей. Это четвертая по распространенности форма рака у женщин и причина смерти более 311 тыс. человек в год [1].
РШМ относится к опухолям визуальной локализации, что способствует обнаружению рака на ранних стадиях заболевания. Кроме того, у РШМ есть предшествующее заболевание (предрак) – дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (Cervical Intraepithelial Neoplasia – CIN). CIN – диспластические изменения в эпителии, нарушение его слоистости. Ежегодно в мире диагностируется более 40 млн новых случаев дисплазий различной степени выраженности (CIN I–III).
Поскольку CIN – это динамический процесс, то может наблюдаться и регрессия, и прогрессия дисплазий. CIN I регрессирует в 90% случаев [2], тогда как CIN II и CIN III только в 40 и 33% случаев соответственно [3]. CIN II+ является истинным (облигатным) предраком шейки матки.
Согласно обновленной Международной классификации болезней 11-го пересмотра 2018 г., дисплазии различной степени выраженности были распределены в разные нозологические рубрики. Так, CIN I внесена в группу «немезенхимальное доброкачественное новообразование матки, тела матки» (2F31.00), а CIN II (2E66.0) и III (2E66.1) – в раздел «карциномы in situ шейки матки» (2E66), что подчеркивает значимость проблемы и должно учитываться при принятии решения о лечении данной когорты больных.
В России РШМ остается глобальной проблемой. В последние десятилетия наблюдаются неуклонный рост заболеваемости инвазивным РШМ и высокие показатели смертности. Общий прирост заболеваемости РШМ в нашей стране в 2005–2017 гг. составил 24,28%. Ежегодно регистрируются более 17 тыс. новых случаев РШМ (17 212 случаев в 2017 г.) со средним возрастом заболевших 52 года [4]. До сих пор у 63% женщин РШМ обнаруживается случайно и только у 37% – активно (при профилактических осмотрах или в ходе диспансеризации). Удельный вес больных РШМ III–IV стадии от числа больных с впервые установленным диагнозом в 2005–2015 гг. составлял до 39%. У каждой десятой женщины заболевание выявляют в терминальной стадии, а у каждой четвертой – в III стадии, когда прогноз крайне не определен [5]. В 2017 г. впервые показатели смертности больных РШМ сравнялись с показателями смертности от рака яичника (наиболее агрессивной формы среди всех онкогинекологических заболеваний) [4].
Возможности профилактики рака шейки матки
В отличие от многих других злокачественных опухолей для РШМ (и CIN) существуют эффективные методы первичной и вторичной профилактики.
Первичная профилактика предполагает проведение мероприятий в отношении лиц, не имеющих признаков заболевания, с целью предотвращения его развития в дальнейшем. Наиболее часто обсуждается такой метод первичной профилактики CIN и РШМ, как вакцинация девочек двухвалентной (2vHPV), четырехвалентной (4vHPV) или девятивалентной (9vHPV) вакциной и мальчиков четырехвалентной (4vHPV) или девятивалентной (9vHPV) вакциной. Вторичная профилактика РШМ основана на социальных скрининговых программах (тестирование на выявление вируса папилломы человека (ВПЧ) и цервикальный скрининг), направленных на доклиническое обнаружение заболевания и снижение смертности. Однако, согласно данным за 2013–2018 гг., которые представил профессор и главный врач университета Хельсинки P. Nieminen на Всемирном конгрессе Международной федерации гинекологии и акушерства в 2018 г., среди всех заболевших РШМ в Финляндии 58% не проходили цервикальный скрининг или проходили его нерегулярно, а 42% до выявления заболевания четыре раза подверглись скрининговой программе.
Основными (пока нерешенными) проблемами профилактики РШМ и CIN в России остаются отсутствие обязательной вакцинации против ВПЧ в календарях прививок для девочек и женщин, мальчиков и юношей, низкий охват цервикальным скринингом, отсутствие рекомендаций по проведению ВПЧ-тестирования и др.
В соответствии с рекомендациями Всемирной организации здравоохранения, вакцинация против ВПЧ включена в национальные календари 86 стран мира. Чтобы достичь цели (снизить заболеваемость РШМ), охват вакцинацией должен составлять не менее 90% целевой группы населения. В России ВПЧ-вакцинация входит в региональные календари только 27 регионов и в общей сложности затрагивает только 160 тыс. подростков – всего несколько процентов от целевой группы.
Поиск путей эффективной первичной профилактики ВПЧ, его персистенции и прогрессии крайне актуален и должен быть направлен на здоровую популяцию женщин.
Вирус папилломы человека как причина рака шейки матки
Напомним, что ВПЧ представляет собой небольшой двуспиральный безоболочечный ДНК-содержащий вирус семейства Papillomaviridae. Геном ВПЧ заключен в белковую оболочку, состоящую из больших (L1) и малых (L2) структурных белков. На основе определения нуклеотидной последовательности генома L1, который кодирует основной капсидный белок, обнаружено и описано более 200 типов ВПЧ, из которых только 45 типов могут инфицировать эпителиальный слой урогенитального тракта [6, 7]. ВПЧ поражает только стратифицированные эпителиальные ткани и является наиболее распространенным вирусом, передаваемым половым путем.
По данным Всемирной организации здравоохранения, ежегодно отмечается около 6 млн случаев инфицирования ВПЧ. Основной механизм передачи ВПЧ – половой (генитально-генитальный, мануально-генитальный, орально-генитальный), возможна передача и при кожном контакте [8]. Пик инфицирования ВПЧ у женщин приходится на 16–25 лет.
Длительная персистенция ВПЧ высокого онкогенного риска инициирует развитие CIN, повышая риск возникновения РШМ [9]. С ВПЧ ассоциированы 99% случаев РШМ, 90% опухолей области заднего прохода, 40% случаев рака влагалища и вульвы, 10–15% случаев злокачественных опухолей ротовой полости и гортани. Именно ВПЧ 16 и 18 ответственны за 71% случаев инвазивного РШМ, а 31, 33, 45, 52 и 58-е типы выявляются в еще 19% случаев [10]. Так, отношение шансов РШМ, ассоциированного с ВПЧ-16, к ВПЧ неонкогенного типа составляет 435, а, например, отношение шансов рака легкого у курящих против рака легкого у некурящих – всего 83.
Методика определения ДНК ВПЧ (ВПЧ-тестирование), которая во многих странах мира используется в рамках первичного скрининга женской популяции и характеризуется более высокой (на 37,5%) чувствительностью по сравнению с ПАП-тестом, позволяет:
- выявить женщин с минимальным риском развития РШМ;
- сосредоточить внимание на пациентках с высоким риском CIN и РШМ;
- определить тех, кто нуждается в дальнейшем обследовании;
- увеличить интервалы скрининга ввиду более высокой чувствительности по сравнению с цитологическим исследованием;
- установить факт трансформации клеток в случае экспрессии онкомаркеров p16 и ki-67;
- не проводить ненужную кольпоскопию и снизить риск пропустить заболевание [11].
Однако на сегодняшний день в России ВПЧ-тестирование не используется в программах скрининга и не входит ни в один приказ о порядке проведения диспансеризации населения.
Вместе с тем в настоящее время в США к основным факторам риска развития РШМ отнесены курение, семейная история РШМ, многоплодная беременность, недостаточное потребление фруктов и овощей и только потом ВПЧ. С учетом распространенности ВПЧ, естественной истории его течения, возможности как регрессировать, так и персистировать и прогрессировать, необходим поиск эффективных и, главное, массовых методов первичной профилактики ВПЧ и CIN [2].
Доказано, что даже самая эффективная скрининговая программа не может повлиять на распространение папилломавирусной инфекции и ни один из существующих методов лечения ВПЧ не является эффективным. Таким образом, поиск методов, снижающих риски персистенции ВПЧ, развития диспластических изменений эпителия шейки матки и прогрессии от легкой степени к тяжелой и далее в преинвазивный и инвазивный рак, имеет огромное практическое значение.
Фолатный статус и развитие цервикальных дисплазий
C.J. Piyathilake и соавт. (2014) пришли к выводу, что персистенция ВПЧ и развитие CIN и РШМ зависят от метилирования ДНК самого вируса [12].
Полноценное метилирование ДНК ВПЧ после внедрения в клетку способствует подавлению синтеза его онкобелков. Онкобелки Е6 и Е7 оказывают следующие эффекты: стимулируют клеточную пролиферацию, препятствуют апоптозу раковых клеток, подавляют выработку интерферона, нарушают защитные регуляторные механизмы репарации ДНК, что способствует дестабилизации генома [13]. Внедрившись в клетку, ВПЧ использует донаторы метильных групп человеческого организма (фолаты и витамин В12) для метилирования (стабилизации) собственной ДНК. Метилирование генома ВПЧ-16 зависит от уровня фолатов как донаторов метильной группы и ведет к значительному подавлению синтеза онкобелков (в частности, Е6). Достижение оптимального уровня фолатов может приводить к снижению экспрессии генов онкобелков в клетках, инфицированных ВПЧ [12].
Позже в экспериментальной работе (2018), где изучалось влияние уровня фолатов на геномную интеграцию ДНК ВПЧ-16 in vivo на новой мышиной модели для быстрой онкогенной трансформации кератиноцитов человека, S. Xiao и соавт. продемонстрировали, что дефицит фолатов в рационе приводит к индуцированному канцерогенезу [14]. Авторы исходили из доказанной значимости Метафолина в снижении риска развития многих злокачественных новообразований. Кератиноциты человека, несущие ВПЧ-16, были дифференцированы в трехмерные органотипические плоты ВПЧ-16 в условиях как достаточной концентрации фолатов, так и их дефицита. Затем их подкожно имплантировали самкам мышей Beige Nude XID с выраженным иммунодефицитом, получавших либо диету с высоким содержанием фолатов (1200 нмоль фолатов/кг пищи), либо диету с дефицитом фолатов (600 или 400 нмоль фолатов/кг пищи) в течение двух месяцев. Агрессивные злокачественные новообразования сформировались в течение нескольких недель. Раковые опухоли, развившиеся в условиях дефицита фолатов, по сравнению с опухолями, развившимися в условиях достаточной концентрации фолатов, демонстрировали более высокую экспрессию онкогенных белков (E6 в 1,8 раза и Е7 в 2,8 раза, p = 0,001), а также в 2 раза большую интеграцию ВПЧ-16 в геномную ДНК (p < 0,05) [14].
Таким образом, в эксперименте была продемонстрирована связь между степенью экспрессии генов онкобелков Е6 и Е7 и количеством употребляемых фолатов и установлено, что диета с низким содержанием фолатов приводит к увеличению экспрессии генов онкобелков в инфицированных ВПЧ клетках [14].
В другой серии работ было показано, что именно фолаты участвуют в синтезе ДНК и предотвращают ее изменения путем метилирования [15], а дефицит фолатов ограничивает синтез ДНК, что особенно значимо для быстроделящихся клеток, например эпителиальных, подвергающихся воздействию ВПЧ [16].
Оказалось, что в персистенции ВПЧ и дальнейшем развитии дисплазии и РШМ важную роль играет нестабильность генома и эпителиальных клеток, что также зависит от уровня метилирования (стабилизации) ДНК [17]. Вирусная ДНК встраивается в поврежденные «ломкие» участки ДНК эпителиальных клеток и приводит к их изменению с последующим накоплением мутаций и злокачественной трансформации [18].
A. Kondo и соавт. (2011) установили, что оптимальная концентрация фолатов в сыворотке крови ассоциируется со снижением относительного риска развития CIN умеренной степени и выше [19]. Таким образом, нормализация уровня фолатов в периферической крови и эритроцитах открывает новые возможности для снижения риска персистенции ВПЧ и развития CIN.
Не менее важен вопрос влияния фолатного статуса на возможность регресса уже развившейся дисплазии шейки матки. Рандомизированное двойное слепое плацебоконтролируемое исследование, проведенное Z. Asemi (2016) и соавт., с участием 58 женщин в возрасте от 18 до 55 лет с диагнозом CIN I, разделенных случайным образом на две группы для приема 5 мг/сут фолиевой кислоты (n = 29) и плацебо (n = 29), показало, что в группе женщин, получавших фолаты, CIN I регрессировала в 83,3% случаев, а в группе плацебо – только в 52,0% (p = 0,019) [20].
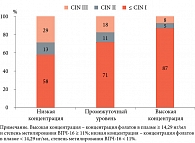
Более масштабная работа с участием 315 женщин в возрасте 19–45 лет, инфицированных ВПЧ и имеющих CIN различной степени выраженности, доказала, что уровень фолатов в плазме влияет на степень CIN (рис. 1). Получены статистически значимые результаты: у женщин с более высокой концентрацией фолатов в плазме (≥ 14,29 нг/мл) и более высокой степенью метилирования ВПЧ-16 (≥ 11%) вероятность возникновения CIN II+ была на 75% ниже. Авторы акцентировали внимание на значимости уровня фолатов для разработки профилактических мер в контроле за ВПЧ-ассоциированными CIN [12]. Последующие исследования лишь подтвердили полученные результаты. J. Yang и соавт. (2018) установили, что концентрация фолатов в сыворотке крови обратно пропорциональна риску развития CIN II и III (рис. 2) [21].
Таким образом, знания о влиянии фолатов на повышение риска персистенции ВПЧ и развитии цервикальных дисплазий, а также их прогрессии могут быть полезными для разработки профилактических мер в контроле за ВПЧ-инфицированными пациентками [12]. Им может быть рекомендован прием фолатов с целью оптимизации их уровня в организме [22].
Заключение
К сожалению, с помощью терапии полностью устранить ВПЧ невозможно. Наиболее перспективное и патогенетически обусловленное звено в борьбе с CIN и РШМ – выявление факторов риска, которые подразделяются на контролируемые и неконтролируемые. Повлиять можно только на контролируемые риски, один из которых – уровень фолатов в организме.
Помимо восстановления фолатного статуса, безусловно, необходимы полноценное питание, отказ от курения и уменьшение влияния социально значимых факторов: частая смена половых партнеров, раннее начало половой жизни, ранние беременности, несоблюдение половой гигиены и др.
Сегодня в арсенале врачей имеется низкодозированный комбинированный оральный контрацептив, содержащий Метафолин (Джес® Плюс). Одним из показаний к его назначению является контрацепция у женщин с дефицитом фолатов. Препарат может стать оптимальным источником фолатов для женщин репродуктивного возраста, ведущих половую жизнь и нуждающихся в контрацепции, поскольку его прием позволяет нормализовать уровень фолатов в организме, что само по себе может способствовать снижению риска персистенции ВПЧ, развития дисплазии и вероятности ее прогрессии.
A.E. Protasova, MD, PhD, Prof.
Saint Petersburg State University
North-Western State Medical University named after I.I. Mechnikov, Saint Petersburg
Almazov National Medical Research Centre, Saint Petersburg
Contact person: Anna E. Protasova, protasova1966@yandex.ru
The article discusses the possibilities of cervical cancer primary and secondary prevention. It is noted that the normalization of folate levels in peripheral blood and red blood cells opens up new opportunities to reduce the risk of human papillomavirus persistence, cervical neoplasia development and further cervical cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.