Цервикогенная головная боль: как диагностировать и обезвредить
- Аннотация
- Статья
- Ссылки
- English



Цервикогенная головная боль (ЦГБ) – одна из самых распространенных вторичных (симптоматических) форм головной боли [1]. В соответствии с общепринятым определением, ЦГБ – боль, возникающая в области головы вследствие патологии костных структур или мягких тканей шеи [2]. По данным различных эпидемиологических исследований, распространенность ЦГБ варьируется от 0,4 до 13,8% в общей популяции [3]. В специализированных клиниках по лечению боли пациенты с ЦГБ составляют 20% от всех пациентов с головной болью [4]. Среди хронических головных болей, а также головных болей с частыми, затяжными обострениями ЦГБ встречается в 15–20% случаев [2, 5, 6]. Под руководством ведущего специалиста по изучению ЦГБ O. Sjaastad в Норвегии было проведено крупное эпидемиологическое исследование, включавшее 1838 граждан в возрасте от 18 до 65 лет [7]. Авторы заключили, что распространенность ЦГБ в общей популяции составляет 4,1%. Вариабельность показателей распространенности ЦГБ в различных исследованиях связана с трудностями диагностики данного заболевания [8]. В практической деятельности более чем в 50% случаев пациентам с ЦГБ ставятся ошибочные диагнозы, среди которых наиболее часто встречаются «головная боль напряжения», «мигрень», «гемикраниа континуа» [5, 8].
Вероятность развития ЦГБ увеличивается с возрастом, особенно после 40 лет [6]. Считается, что средний возраст пациентов с ЦГБ составляет 42,9 года [4]. Женщины болеют ЦГБ в четыре раза чаще, чем мужчины [9]. У пациентов с ЦГБ наблюдается значимое снижение качества жизни, сопоставимое с таковым у пациентов с хронической мигренью и хронической головной болью напряжения. При этом ЦГБ приводит к большему снижению физической активности пациентов, чем указанные состояния [10].
Исторические аспекты цервикогенной головной боли: от первых описаний до наших дней
Первое клиническое описание головной боли, связанной с патологией шеи, появилось в 1853 г. и принадлежит профессору Schützenberger [11]. Позже, в 1913 г., профессор G. Holmes более подробно описал клиническую картину этого состояния [12]. Автор обнаружил болезненные участки в задней группе мышц шеи и обозначил данный феномен как «фиброзит», что послужило основой для обозначения головной боли, вызванной с патологией шеи, как «ревматическая головная боль». В дальнейшем было выполнено множество описаний пациентов с данной головной болью [13, 14].
Новое название головной боли, связанной с патологией шеи, появилось в 1926 г. [15]. M. Barre описал интенсивную головную боль в затылочной области, которая сочеталась с головокружением, нарушениями слуха и зрения, и ввел термин «задний цервикальный симпатический синдром». С 1940-х гг. использовался термин «затылочная невралгия», обсуждалась роль большого и малого затылочных нервов в патогенезе головной боли, рекомендовалось проведение терапевтических блокад с прокаином или алкоголем в области повышенной чувствительности [16–18]. Отмечают важность исследований B.S. Ray и H.G. Wolff. Ученые показали, что стимуляция чувствительных нервных окончаний над и под верхней поверхностью намета мозжечка вызывает головную боль, локализующуюся в теменной или лобной области [19]. В дальнейшем проводились исследования по изучению афферентных связей верхних шейных спинномозговых корешков [20].
Большой вклад в понимание происхождения этого типа головной боли внесли исследователи C.R. Hunter и F.H. Mayfield в 1949 г. [21]. Они наблюдали 11 пациентов с головной болью, вызванной патологией шеи. Была подробно описана клиническая картина заболевания, оценена эффективность диагностических блокад нервных структур и хирургических методов лечения. Авторы пришли к заключению, что для головной боли, связанной с патологией шеи, характерны высокая интенсивность, односторонняя локализация боли, начало болевого приступа с затылочной области с последующим распространением на теменную, височную, окологлазничную область. По мере прогрессирования приступа головная боль часто становилась двусторонней. В части случаев во время приступа головной боли на одноименной стороне наблюдались вегетативные симптомы (слезотечение, инъецирование конъюнктивы, покраснение лица, потоотделение на лице, заложенность носа). У многих пациентов отмечались травмы шеи в анамнезе. Блокада шейного спинномозгового нерва C2 с использованием анестетика купировала головную боль, связанную с патологией шеи. Блокада большого затылочного нерва с анестетиком также оказывала обезболивающий эффект, но в меньшей степени. Всем пациентам было проведено хирургическое лечение – авульсия большого затылочного нерва с интраспинальным пересечением чувствительных корешков C2 или С2 и С3 с положительным эффектом.
В работах W. Bärtschi-Rochaix’s на основании результатов радиологического исследования была обозначена вероятная патогенетическая роль повреждения шейных унковертебральных фасеточных суставов в развитии головной боли, связанной с патологией шеи [11, 22, 23]. Автор предложил новое название для такого типа боли – «цервикальная мигрень», поскольку головная боль высокой интенсивности, часто мигренеподобная, иногда сочетается с вегетативными симптомами, тошнотой. Интересно, что в тот период классическая мигрень называлась «каротидная мигрень».
В 1955 г. Pentecost и Adriani первыми продемонстрировали достаточно высокую эффективность блокад спинномозговых нервов C2 и C3 с помощью анестетика и незначительную эффективность блокад большого и малого затылочных нервов в купировании головной боли, связанной с патологией шеи [24].
Современный термин ЦГБ предложили O. Sjaastad и соавт. в 1983 г. [25]. Определение «цервикогенная» подчеркивает этиопатогенетическую связь патологии шеи и боли в области головы. Однако в первой Международной классификации головных болей (МКГБ) от 1988 г. использовался термин «цервикальная головная боль» [26], который в дальнейшем признали неоптимальным и уже во второй редакции МКГБ заменили на ЦГБ [27]. В 1987 г. во Флоренции O. Sjaastad создал Международную группу по изучению цервикогенной головной боли (МГЦГБ) [2]. Съезды экспертов данной группы продолжают проводиться ежегодно. Диагностические критерии ЦГБ были разработаны экспертами МГЦГБ в 1990 г. [28], пересмотрены в 1998 г. [29] и 2000 г. [30].
Патофизиология
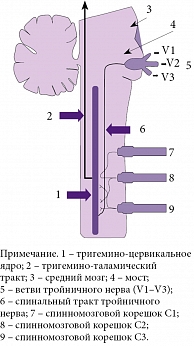
В практической деятельности трудности диагностики ЦГБ во многом обусловлены недостаточным пониманием ее патофизиологии. Механизмы развития и поддержания ЦГБ продолжают изучаться, но на сегодняшний день есть определенная патофизиологическая концепция. Считается, что нейроанатомической основой формирования ЦГБ служит тригемино-цервикальное ядро, располагающееся в сером веществе головного мозга на уровне шейных C1–C3 сегментов [31]. Тригемино-цервикальное ядро состоит из ноцицептивных нейронов второго порядка, которые получают аксоны и от тройничного нерва, и от трех верхних спинномозговых корешков (рисунок). Шейные спинномозговые корешки C1–C3 иннервируют межпозвонковые суставы, мышцы и связки шеи, межпозвонковый диск C2–C3, позвоночные и внутренние сонные артерии, твердую мозговую оболочку задней черепной ямки и верхнего отдела спинного мозга. Повреждение или травма перечисленных структур может стать причиной ЦГБ (табл. 1) [32]. Болевые импульсы идут по шейным корешкам C1–C3 от поврежденных структур шеи, поступают в тригемино-цервикальное ядро, конвертируются на нейронах второго порядка цервикальной и тригеминальной системы, а затем распространяются к таламусу и постцентральной извилине [31]. В сравнительном нейрофизиологическом исследовании, включавшем пациентов с ЦГБ и пациентов с дисфункцией в области шеи, но без головной боли, у первых обнаружен феномен центральной сенситизации [33]. Центральная сенситизация у пациентов с ЦГБ – основа формирования и поддержания персистирующей головной боли при повреждениях в области шеи. Ряд авторов сообщают об отдельной патофизиологической роли большого и малого затылочных нервов в формировании ЦГБ, но в меньшей степени, чем верхние шейные спинномозговые нервы [34].
Клиническая картина
В клинической картине ЦГБ нет патогномоничных симптомов, что создает трудности ее диагностики [35]. Однако выделяется ряд клинических особенностей ЦГБ [36]:
- односторонняя боль в области головы или лица, без смены стороны боли, в редких случаях боль может быть двусторонней;
- боль локализуется в затылочной, лобной, височной или орбитальной области;
- интенсивность боли – от умеренной до сильной;
- периодически повторяющиеся приступы боли, которые длятся часами в течение дня, постоянная боль или постоянная боль с эпизодами усиления боли;
- обычно боль «глубинная» и непульсирующая, пульсирующая боль может возникать при наличии у пациента с ЦГБ приступов мигрени;
- головная боль провоцируется движениями шеи, неудобным положением шеи, давлением пальцев на области выхода подзатылочного нерва (спинномозгового корешка С1), спинномозговых корешков С2, С3 и С4 или на область выхода большого затылочного нерва, проба Вальсальвы, кашель или насморк могут также провоцировать боль;
- ограничение объема активных и пассивных движений в шее, «скованность» шеи;
- сопутствующие симптомы могут напоминать классические симптомы мигрени:
- тошнота;
- рвота;
- фотофобия, фонофобия, головокружение;
- ипсилатеральное нарушение зрения, слезотечение и инъецирование конъюнктивы или ипсилатеральная боль в шее, плече или руке.
Продолжительность приступов/обострений ЦГБ варьируется в широких пределах: от нескольких часов до нескольких недель. Приступ ЦГБ начинается с затылочной области или шеи и распространяется на лобно-височно-периорбитальные отделы головы. Боль односторонняя. Вегетативные симптомы на стороне боли встречаются редко. Обычно в начале заболевания наблюдаются нечастые эпизоды головной боли. При этом ЦГБ имеет высокую тенденцию к хронизации [37].
Современные рекомендации по диагностике
Диагноз ЦГБ устанавливается на основании данных анамнеза, объективного осмотра, официальных диагностических критериев и при исключении «красных флажков» [31, 34]. На сегодняшний день для постановки диагноза ЦГБ рекомендуется использовать диагностические критерии МКГБ-3 (табл. 2) [38] или МГЦГБ от 2000 г. (табл. 3) [30].
Важный клинический признак ЦГБ – снижение подвижности в атланто-аксиальном (С1–С2) суставе [39]. Для выявления данного признака применяется специальный мануальный тест – цервикальное сгибание – ротация [34]. Тест позволяет определить «блок» атланто-аксиального сустава с точностью до 85–91% [40, 41].
Считается, что при объективном исследовании скелетно-мышечных структур шеи (их пальпации, определении объема движений) должна воспроизводиться типичная для пациента боль, распространяющаяся от шеи к голове. Если данный феномен не наблюдается, то диагноз ЦГБ сомнителен [35].
Пациентам с подозрением на ЦГБ рекомендуется проведение визуализационных методов исследования шеи (рентгенографии, компьютерной томографии, магнитно-резонансной томографии). Однако данные методы диагностики не повышают достоверность диагноза ЦГБ, так как оказываются малоинформативными [34]. По результатам магнитно-резонансной томографии, протрузии межпозвонковых дисков на шейном уровне у пациентов с ЦГБ встречаются так же часто (в 45,4% случаев), как и у клинически здоровых людей (в 45% случаев) [42]. Достоверные визуальные различия шейного отдела позвоночника у пациентов с ЦГБ и другими видами головной боли отсутствуют [34]. Так, по результатам магнитно-резонансной томографии шейного отдела позвоночника, состояние алярных и поперечных связок, межпозвонковых дисков, краниовертебрального перехода, межпозвонковых суставов схоже при ЦГБ, головной боли, вызванной хлыстовой травмой, и мигрени [43]. И только при мануальном исследовании у пациентов с ЦГБ обнаруживается заинтересованность связок и суставов шеи. Спондилез и остеохондроз шейного отдела позвоночника также не являются причинами развития ЦГБ [38].
Наиболее достоверное инструментальное подтверждение ЦГБ – разрешение головной боли в ответ на блокаду анестетиком структур шеи (вероятных источников боли) под рентгенологическим или ультразвуковым контролем [35, 36]. При ЦГБ диагностическая блокада может выполняться в область нескольких анатомических структур: большой затылочный нерв (дорсальная ветвь спинномозгового нерва C2), малый затылочный нерв, спинномозговой нерв C2 или C3, третий затылочный нерв (дорсальная ветвь спинномозгового корешка C3), фасеточный сустав, атланто-затылочный сустав, атланто-аксиальный сустав или межпозвонковый диск [44]. Структура шеи, в область которой будет проводиться диагностическая блокада, определяется по результатам объективного осмотра: локальная болезненность, воспроизводимость головной боли при пальпации, область распространения отраженной боли [36].
В диагностическом поиске к «красным флажкам» принято относить симптомы, которые могут свидетельствовать о каком-либо серьезном органическом заболевании как причине головной боли и боли в шее [8, 34]:
- прогрессивное ухудшение головной боли во времени при отсутствии предрасполагающих факторов;
- внезапное начало сильной головной боли;
- очаговая неврологическая симптоматика при осмотре;
- высокая температура тела, ригидность мышц шеи или кожная сыпь, сопровождающие головную боль;
- начало головной боли после травмы головы;
- ухудшение зрения или появление выраженного головокружения;
- онкологическое заболевание в анамнезе, системное заболевание, инфекция, вызванная вирусом иммунодефицита человека;
- провоцирование умеренной или сильной головной боли кашлем, напряжением, натуживанием.
При наличии «красных флажков» выполняются дополнительные лабораторные и инструментальные методы исследования, которые позволяют выявить основное заболевание, объясняющее головную боль, и установить симптоматическую форму головной боли [8, 34]. Дифференциальную диагностику ЦГБ следует проводить с первичными формами головной боли: головной болью напряжения, мигренью, тригеминальными вегетативными цефалгиями (кластерной головной болью, пароксизмальной гемикранией) [8].
В практической деятельности наиболее дискутабелен дифференциальный диагноз головной боли напряжения и ЦГБ [45, 46]. Для головной боли напряжения характерна двусторонняя локализация с самого начала приступа [38]. ЦГБ односторонняя, без смены стороны боли, и только в редких случаях по мере прогрессирования приступа головная боль становится двусторонней [36]. Высокая интенсивность боли типична для ЦГБ и не характерна для головной боли напряжения [38]. Движения в шее (сгибания, ротация), пальцевое давление на структуры шеи вызывают типичный приступ головной боли у пациентов с ЦГБ, что не наблюдается у пациентов с головной болью напряжения [35]. Диагностическая блокада с анестетиком в область межпозвонковых суставов шеи или верхних шейных спинномозговых корешков не купирует головную боль напряжения, а при ЦГБ оказывается эффективной [30, 38]. Если при пальпации перикраниальных мышц выявлены миофасциальные болевые точки и установлена их причинно-следственная связь с головной болью, то следует думать о головной боли напряжения [38]. К отличительным признакам мигрени относятся:
- дебют с детского или подросткового возраста;
- пульсирующий или распирающий характер боли;
- типичные провоцирующие факторы (недостаток или избыток сна, менструация, голод, прием алкоголя);
- сочетание головной боли с тошнотой или рвотой, фото-, фоно- и/или осмофобией;
- облегчение головной боли после сна;
- купирование или значимое уменьшение головной боли после приема триптанов;
- отсутствие приступов головной боли во время беременности (часто);
- наличие мигрени у ближайших родственников [38, 47–49].
Для тригеминальных вегетативных цефалгий характерно обязательное сочетание односторонней головной боли с ипсилатеральными вегетативными симптомами (инъецирование конъюнктивы, слезотечение, заложенность носа, ринорея, птоз, миоз, отечность века, потливость лица), кратковременная продолжительность приступа головной боли (15–180 минут для кластерной головной боли, 2–30 минут для пучковой головной боли), несколько приступов в день, эффективность триптана или индометацина в купировании головной боли [38].
Лечение
На сегодняшний день официальные руководства по лечению пациентов с ЦГБ отсутствуют, поскольку проведено недостаточное количество контролируемых исследований [34]. Современные принципы лечения пациентов с ЦГБ основываются на результатах отдельных клинических контролируемых исследований, рекомендациях экспертов и профессиональных сообществ. Например, рекомендации по лечению ЦГБ создали два канадских профессиональных сообщества: Институт экономики здоровья [50] и Федерация хиропрактики [51].
Существует несколько направлений в лечении пациентов с ЦГБ: фармакотерапия, нелекарственная терапия, инвазивные методы [34–36]. Наиболее перспективным считается комбинированное лечение. При неэффективности консервативных и малоинвазивных методов возможно хирургическое лечение [36]. Известно, что несколько факторов могут повышать вероятность благоприятного прогноза в разрешении ЦГБ: пожилой возраст, провокация или облегчение головной боли движением, хорошо оплачиваемая работа [52].
Фармакотерапия
Лекарственная терапия ЦГБ продолжает изучаться [36]. Для лечения ЦГБ могут применяться препараты нескольких фармакологических групп: антидепрессанты, антиконвульсанты, нестероидные противовоспалительные средства (НПВС), миорелаксанты [36, 50].
При хронической форме ЦГБ, сочетанных депрессивных и тревожных расстройствах возможно назначение антидепрессантов (амитриптилина, миртазапина, венлафаксина, дулоксетина), антиконвульсантов (карбамазепина, габапентина, прегабалина, топирамата) [36]. Миорелаксанты с центральным механизмом действия (тизанидин, баклофен) могут оказывать некоторое обезболивающее действие [36]. Назначение опиоидных анальгетиков при ЦГБ не рекомендуется [13]. Ботулотоксин типа А неэффективен в лечении ЦГБ [42, 50].
Нестероидные противовоспалительные средства
НПВС могут использоваться как при эпизодическом, так и хроническом течении ЦГБ [36]. При обострении/рецидиве ЦГБ рекомендуется назначать препараты НПВС кратким курсом (семь – десять дней) в средних терапевтических дозах. У пациентов с хронической ЦГБ терапия НПВС облегчает болевой синдром и повышает их приверженность к ключевым реабилитационным программам (лечебной гимнастике, постизометрической релаксации), позволяет поддерживать повседневную активность [36]. Терапия НПВС при ЦГБ патогенетически обоснована, так как первичные источники боли – межпозвонковые суставы и связки. Однако пациентам с ЦГБ следует избегать чрезмерного употребления обезболивающих препаратов, в том числе НПВС. Целесообразность данной рекомендации обусловлена тем, что у пациентов с уже имеющейся головной болью, в частности ЦГБ, при регулярном продолжительном (более трех месяцев), избыточном приеме обезболивающих препаратов может сформироваться лекарственно-индуцированная головная боль [38]. Чтобы не допустить развития этого осложнения, пациентам с ЦГБ рекомендуется принимать не более десяти терапевтических доз НПВС в месяц.
В российских аптеках представлено большое количество препаратов из группы НПВС. Только некоторые из них являются оригинальными препаратами и имеют собственную базу клинических исследований по безопасности и эффективности применения. Все препараты НВПС делятся на несколько групп: неселективные ингибиторы циклооксигеназы (ЦОГ) 1 и 2 (диклофенак, кетопрофен, напроксен, ибупрофен, индометацин), преимущественно селективные ингибиторы ЦОГ-2 (мелоксикам, нимесулид, этодолак), высокоселективные ингибиторы ЦОГ-2 (коксибы – целекоксиб, эторикоксиб).
Выбор препарата НПВС индивидуален для каждого пациента и во многом определяется профилем возможных нежелательных эффектов [36]. Неселективные ингибиторы ЦОГ-1 и ЦОГ-2 противопоказаны пациентам с заболеваниями желудочно-кишечного тракта, так как повышают риск обострения гастрита, язвенной болезни желудка и двенадцатиперстной кишки, развития желудочно-кишечных кровотечений из верхних отделов. Высокоселективные ингибиторы ЦОГ-2 не рекомендуется принимать при сердечно-сосудистой патологии, так как они повышают риск развития инфаркта миокарда, сердечной недостаточности. Преимущественно селективные ингибиторы ЦОГ-2 не оказывают выраженного влияния на желудочно-кишечную и сердечно-сосудистую системы. К преимущественно селективным ингибиторам ЦОГ-2 относится мелоксикам [51].
Мовалис – оригинальный препарат мелоксикама, имеет большую базу контролируемых исследований по безопасности и эффективности в лечении суставных и скелетно-мышечных болей. По профилю безопасности и эффективности Мовалис (мелоксикам) можно отнести к золотой середине терапии НПВС. Мелоксикам имеет такой же низкий риск желудочно-кишечных осложнений, как целекоксиб. К данному заключению пришли авторы крупного метаанализа, включавшего 1561 случай серьезных поражений верхних отделов желудочно-кишечного тракта на фоне приема коксибов и традиционных НПВС [52]. В сравнении с другими НПВС мелоксикам имеет самый низкий риск развития сердечно-сосудистых событий. На это указывают результаты метаанализа, в котором обобщены результаты лечения 92 163 пациентов, принимавших НПВС более 14 дней и госпитализированных из-за сердечной недостаточности [53]. Изучали профиль безопасности 27 препаратов НПВС. Самый низкий риск развития сердечной недостаточности отмечался у мелоксикама – 1,02 (95%-ный доверительный интервал 1,17–1,22), самый высокий – у кеторолака (1,83, 95%-ный доверительный интервал 1,66–2,02), эторикоксиба (1,51, 95%-ный доверительный интервал 1,41–1,62), индометацина (1,51, 95%-ный доверительный интервал 1,33–1,71). Авторы других крупных метаанализов по сердечно-сосудистой безопасности различных НПВС заключили, что мелоксикам имеет очень низкие риски развития инфаркта миокарда и инсульта в сравнении с коксибами и другими традиционными НПВС [54]. Следует отметить, что риск развития нежелательных явлений обычно возникает при длительном приеме НПВС.
Наряду с высокой безопасностью мелоксикам обладает выраженным обезболивающим эффектом при скелетно-мышечных, суставных болях, который сопоставим с обезболивающим эффектом неселективного ингибитора ЦОГ-1 и ЦОГ-2 диклофенака [55–57]. При этом диклофенак обладает высоким риском развития желудочно-кишечных осложнений. Высокую эффективность мелоксикама связывают с тем, что подавление синтеза простагландина Е2 происходит не только за счет ингибирования ЦОГ-2, но и за счет ингибирования микросомальной простагландин Е2 синтетазы 1 [51].
Нелекарственные методы лечения
Учитывая природу происхождения ЦГБ (патологию межпозвонковых суставов и связок шейного отдела позвоночника после повреждения или травмы), большое внимание уделяется изучению эффективности мануальной терапии [34]. Результаты систематического обзора рандомизированных контролируемых исследований подтвердили, что мануальная терапия при ЦГБ достоверно эффективнее, чем отсутствие лечения [58]. У пациентов с ЦГБ часто диагностируется напряжение перикраниальных мышц и мышц плечевого пояса, поэтому им рекомендуется выполнять упражнения по постизометрической релаксации [34]. Данные нескольких контролируемых исследований продемонстрировали эффективность упражнений лечебной гимнастики для мышц головы, шеи и плечевого пояса при ЦГБ [59]. Эксперты заключили, что в лечении ЦГБ наиболее эффективно сочетанное применение мануальной терапии, лечебной гимнастики и постизометрической релаксации [34, 36, 50, 60]. Данный подход повышает вероятность благоприятного прогноза в краткосрочной и долгосрочной перспективе.
Инвазивные и хирургические методы лечения
В лечении ЦГБ используются блокады с анестетиками, которые выполняют в область атланто-аксиальных суставов, фасеточных суставов С1–С2 или С3–С4, спинномозговых нервов С2 или С3, большого затылочного нерва или малого затылочного нерва [36]. По заключению экспертов, блокада большого затылочного нерва может приводить к временному, но выраженному обезболивающему эффекту [61]. Согласно результатам сравнительных исследований, эффективность повторных блокад большого затылочного нерва схожа с блокадами спинномозговых нервов С2 и С3 [62]. Если у пациентов с ЦГБ обнаруживаются болезненные точки в области мышц шеи, плечевого пояса, то выполнение блокады в данные точки может значимо уменьшить локальное напряжение мышц и облегчить боль [36]. Если результатом блокады межпозвонковых суставов или нервных структур стало значимое облегчение ЦГБ или полное купирование боли, то можно рассмотреть вопрос о радиочастотной денервации/аблации [63]. Данная процедура дает более длительный обезболивающий эффект – до пяти-шести месяцев [64].
После блокад и радиочастотной денервации всем пациентам рекомендуется реабилитационная программа: лечебная гимнастика, постизометрическая релаксация, мануальная терапия, пешие прогулки, повседневная активность [34, 36]. Данный подход повышает эффективность лечения и увеличивает длительность безболевого периода [36].
Хирургические методы лечения ЦГБ применяются редко, при отсутствии эффекта от консервативного инвазивного лечения [36, 65]. Проводится «высвобождение» большого затылочного нерва из-под трапециевидной мышцы и окружающей соединительной ткани, то есть декомпрессия большого затылочного нерва. Другой хирургический подход – поперечное пересечение большого затылочного нерва. Если есть нейровизуализационное подтверждение микроваскулярного конфликта, то выполняется соответствующая декомпрессия нерва или спинномозгового корешка.
Междисциплинарный подход
При хронической ЦГБ, сочетанных эмоциональных расстройствах, катастрофизации боли, формировании «болевого» («избегающего») поведения рекомендуется междисциплинарный подход: образовательные беседы с пациентом, назначение оптимальной фармакотерапии, блокады, лечебная гимнастика, постизометрическая релаксация, мануальная терапия, когнитивно-поведенческая терапия [34, 36]. Возможно добавление к терапии биологической обратной связи.
Заключение
ЦГБ – одна из самых дискутабельных вторичных форм головной боли. ЦГБ развивается вследствие повреждения/травмы костных структур или мягких тканей шеи. По данным эпидемиологических исследований, распространенность ЦГБ варьируется в широких пределах, что вызвано трудностями ее диагностики. На сегодняшний день разработаны диагностические критерии ЦГБ и рекомендации по дифференциальной диагностике. Методы визуализации (компьютерная томография, магнитно-резонансная томография, рентгенография) малоинформативны. Диагностическую ценность представляет блокада с анестетиком в область межпозвонковых суставов, периферических или спинномозговых нервов шеи, а также мануальное обследование, специальные мануальные тесты. ЦГБ – один из немногих видов головных болей, при которых эффективна мануальная терапия. Лечение ЦГБ должно быть комплексным и включать оптимальную фармакотерапию, лечебные блокады с анестетиком, лечебную гимнастику, постизометрическую релаксацию, мануальную терапию. В случае эффективности блокад с анестетиком рассматривается возможность проведения радиочастотной денервации структур шеи. В качестве фармакотерапии ЦГБ широко применяются препараты НПВС. Мовалис (мелоксикам) – преимущественно селективный ингибитор ЦОГ-2, который обладает выраженным обезболивающим действием и высоким профилем безопасности для сердечно-сосудистой и желудочно-кишечной систем. Мелоксикам может использоваться как при обострении, так и при хроническом течении ЦГБ. При ЦГБ также могут назначаться миорелаксанты, антидепрессанты, антиконвульсанты. При хронической ЦГБ рекомендуется междисциплинарный подход, включающий психотерапию. Хирургические методы при ЦГБ применяются редко.
V.A. Golovacheva
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Contact person: Veronika Aleksandrovna Golovacheva, xoxo.veronicka@gmail.com
Cervicogenic headache (CH) – the secondary form of headache that occurs due to the damage or injury of the neck bone structures or soft tissues. In practice, diagnosis of CH can be rather difficult. It is known that the frequency of incorrect diagnoses of CH can achieve up to 50%. Timely diagnosis of CH and the appointment of effective treatment are socially significant purposes, as this form of headache is common in the population (up to 13.8%), leads to significant deterioration in the quality of life and significant decrease in physical activity. The article describes the history of modern ideas formation about the CH pathophysiology, provides modern recommendations for the diagnosis of CH, considers the key aspects of differential diagnosis, presents effective methods of CH treating (pharmacotherapy, non-drug methods, invasive manipulation, surgical methods). Nonsteroidal anti-inflammatory drugs (NSAIDs) are most often used as pharmacotherapy of CH. Taking in account the current diversity of NSAIDs, the choice of a particular drug may be difficult. The original preparations of NSAIDs, which have their own evidence base of efficacy and safety, include Movalis (meloxicam). Provided the advantages of meloxicam appointment compared to other NSAIDs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.