Витрификация эмбрионов как метод повышения эффективности программ ЭКО у пациенток с высоким риском гиперстимуляции яичников
- Аннотация
- Статья
- Ссылки
В ряде исследований последних лет, касающихся программ экстракорпорального оплодотворения (ЭКО), было показано, что витрификация эмбрионов является одним из методов профилактики риска развития синдрома гиперстимуляции яичников (СГЯ) и средством предотвращения развития СГЯ тяжелой степени.
СГЯ – ятрогенное осложнение, возникающее в результате стимуляции суперовуляции в циклах вспомогательных репродуктивных технологий. Развиваться это осложнение может только после лютеинизации. Таким образом, пусковым механизмом развития и прогрессирования синдрома является эндогенная выработка или экзогенное введение хорионического гонадотропина (ХГ). При полном проявлении СГЯ наблюдается увеличение яичников в размере с формированием в них множества кист желтых тел, гемоконцентрацией, накоплением жидкости в третьих пространствах в форме асцита, гидроперикарда, гидроторакса и анасарки. В своей крайней форме синдром может осложняться почечной недостаточностью и олигурией, гиповолемическим шоком, тромбоэмболическими осложнениями.
Выделяют две основные клинические формы СГЯ: раннюю и позднюю, которые отличаются по времени их наступления. Ранний СГЯ коррелирует с ответом яичников на стимуляцию и введением экзогенного ХГ как триггера овуляции, развивается в течение первых 9 дней после трансвагинальной пункции и получения ооцитов. Ранний СГЯ протекает в виде легкой и среднетяжелой форм, практически не требует стационарного лечения. Поздний СГЯ развивается спустя 10 и более дней после пункции, практически не связан с ответом яичников и коррелирует с эндогенной выработкой ХГ при имплантации эмбриона или при применении ХГ для поддержки лютеиновой фазы. Несмотря на то что СГЯ тяжелой степени развивается всего в 1–2% случаев [4], этот синдром является основным источником заболеваемости и даже смертности у пациенток, подвергающихся процедурам вспомогательных репродуктивных технологий (ВРТ). Возникновение и продолжительность синдрома строго связаны с наступлением беременности и числом имплантированных эмбрионов [5].
Поскольку не существует способа быстро вылечить тяжелый СГЯ, основной стратегией ВРТ остается предотвращение риска его развития. В литературе описано множество способов снижения риска развития СГЯ, но ни один из методов не предотвращает развитие этого синдрома, кроме отмены цикла стимуляции суперовуляции до введения экзогенного ХГ [1, 6, 8, 9, 13, 14]. Отмена цикла является самым эффективным и безопасным методом, но вместе с тем самым разочаровывающим и дорогостоящим для бесплодной пары. Не исключено, что следующая попытка стимуляции может привести к такому же риску развития СГЯ.
Нами был выбран другой подход к сокращению случаев СГЯ – это отмена переноса и криоконсервация эмбрионов в цикле стимуляции суперовуляции. После проведения криоконсервации эмбрионов их размораживание и перенос производятся, когда уровень гормонов в плазме крови пациентки не повышен (в естественном цикле или на фоне заместительной гормональной терапии). Хотя у таких пациенток и может проявиться ранний СГЯ, связанный с введением экзогенного ХГ, уровень ХГ, обусловленный наступлением беременности, увеличиваться не будет, что и позволит избежать развития тяжелого СГЯ.
Основным недостатком этого метода является то, что достижение беременности необходимо отложить. Тактика криоконсервации эмбрионов с отменой переноса эмбрионов в свежем цикле международными экспертами оценивается неоднозначно, что связано с использованием различных методов и способов для криоконсервации эмбрионов [2, 3, 7, 10]. До недавнего времени в большинстве центров ЭКО в мире для криоконсервации эмбрионов на разных стадиях развития использовался обычный метод медленного замораживания. При использовании этого метода показатели выживания эмбрионов и частоты наступления беременности были на низком уровне. В качестве потенциальной альтернативы обычному методу медленного замораживания для ооцитов, зигот и эмбрионов в последнее время стала применяться процедура витрификации [3, 11, 12, 15], позволившая повысить выживаемость эмбрионов в частности и эффективность лечения бесплодия в целом. В случаях когда требуется отмена переноса эмбрионов, методика криоконсервации имеет решающее значение для минимизации потерь эмбрионов. В данном исследовании мы показали, что витрификация эмбрионов является оптимальной процедурой для пациенток, проходящих лечение методом ЭКО и находящихся в группе риска развития СГЯ.
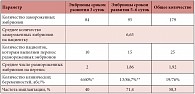
В отделении ЭКО Перинатального медицинского центра (Москва) за период с января 2010 г. по март 2011 г. 27 пациенткам была произведена витрификация всех эмбрионов и отмена проведения переноса эмбрионов в цикле стимуляции овуляции в связи с риском развития СГЯ. Характеристика полученных эмбрионов и результаты переноса размороженных витрифицированных эмбрионов пациенткам, средний возраст которых составил 34,3 ± 0,8 г, представлены в таблице 1. Всего было получено 750 ооцитов, среднее число полученных ооцитов составило 27,8. Криоконсервация эмбрионов производилась в 2 этапа: на 3-и сутки и на 5–6-е сутки развития. Витрификацию эмбрионов хорошего морфологического качества выполняли с использованием Cryotop-метода. Среднее число витрифицированных эмбрионов составило 6,6.
После размораживания оценивалось качество эмбрионов. Уровень выживаемости эмбрионов 3-х и 5–6-х суток развития был одинаково высоким (100% и 100% соответственно). Перенос размороженных эмбрионов выполнен 23 пациенткам, из них двум выполнен дважды в связи с отсутствием наступления беременности в первом цикле переноса размороженных эмбрионов. Всего перенесено 48 эмбрионов, среднее число переносимых эмбрионов составило 1,92. Из 25 циклов переноса размороженных эмбрионов клиническая беременность диагностирована в 19 случаях (частота наступления беременности 76%). Частота имплантации составила 58,3%. Ни у одной пациентки не наблюдалось развития СГЯ тяжелой степени, ни одной из них не понадобилось стационарное лечение.
За время исследования наступление беременности не достигнуто у 4 пациенток, у 3 из них остались витрифицированные эмбрионы, что позволяет, учитывая высокую частоту имплантации, надеяться на достижение беременности с эмбрионами, полученными от одной стимуляции суперовуляции. Результаты нашей работы показывают, что витрификация эмбрионов уменьшает и даже позволяет полностью исключить возможность развития СГЯ тяжелой степени и сохраняет потенциал наступления беременности. Витрификация – очень эффективный метод криоконсервации эмбрионов. Он может быть принят в качестве стандартной процедуры для пациентов с риском развития СГЯ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.