Влияние инсулинорезистентности на развитие осложнений сахарного диабета 2 типа и пути коррекции в пожилом возрасте. III Всероссийский конгресс по геронтологии и гериатрии. Сателлитный симпозиум компании «Материа Медика»
- Аннотация
- Статья
- Ссылки
Рассмотрению современных возможностей коррекции указанных нарушений, прежде всего инсулинорезистентности, был посвящен симпозиум, организованный при поддержке компании «Материа Медика» в рамках III Всероссийского конгресса по геронтологии и гериатрии (Москва, 16 мая 2019 г.).
Рассмотрению современных возможностей коррекции указанных нарушений, прежде всего инсулинорезистентности, был посвящен симпозиум, организованный при поддержке компании «Материа Медика» в рамках III Всероссийского конгресса по геронтологии и гериатрии (Москва, 16 мая 2019 г.).





Течение и исходы сахарного диабета 2 типа. Современный взгляд кардиолога и эндокринолога
Для более подробного освещения проблемы Сергей Руджерович ГИЛЯРЕВСКИЙ, д.м.н., профессор кафедры клинической фармакологии и терапии Российской медицинской академии непрерывного профессионального образования (РМАНПО) (представлял позицию кардиолога), и Наталья Альбертовна ЧЕРНИКОВА, к.м.н., доцент кафедры эндокринологии и диабетологии РМАНПО (выступала с точки зрения эндокринолога), выбрали форму интерактивной дискуссии.
Прежде всего С.Р. Гиляревский отметил, что в настоящее время распространенность сахарного диабета (СД) достигла огромных масштабов. Так, в 2017 г., по разным оценкам, в мире насчитывалось от 425 до 451 млн больных СД. В 2017 г. заболевание стало причиной 5 млн смертей. Общие расходы на лечение СД достигли 850 млрд долларов США1. К 2045 г. число больных СД может достичь 629–693 млн. Следует отметить, что у большого числа лиц СД диагностируется несвоевременно.
Н.А. Черникова пояснила, что приведенные цифры подчеркивают важность своевременной диагностики не только СД, но и предиабета. Необходим своевременный скрининг гликемии и при предположении о наличии нарушения углеводного обмена направление пациентов на дополнительное обследование.
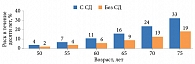
По словам С.Р. Гиляревского, последствия нарушения углеводного обмена с возрастом становятся более тяжелыми. Установлено, что риск развития сердечно-сосудистых осложнений среди лиц от 50 до 75 лет выше у страдающих СД. Так, если кумулятивный риск таковых у больных СД в возрасте 50 лет составляет 4%, в отсутствие СД – лишь 2%, у 60-летних – 11 и 6%, у 70-летних – 24 и 13% соответственно2. В более пожилом возрасте различие между пациентами с СД и без СД в отношении риска развития указанных осложнений увеличивается еще больше (рис. 1).
Поэтому врачи должны прикладывать максимум усилий для того, чтобы предотвратить развитие СД.
Н.А. Черникова обратила внимание аудитории на то, что СД 2 типа – сложнейшее гетерогенное заболевание. На сегодняшний день известно 11 патогенетических механизмов, к важнейшим из которых относят снижение функции и массы β-клеток поджелудочной железы, а также инсулинорезистентность3. Уменьшение функции и массы β-клеток поджелудочной железы приводит к снижению секреции инсулина. На фоне аутоиммунных форм диабета данный процесс может быть еще более выраженным4.
К факторам риска развития СД 2 типа относятся избыточная масса тела или ожирение и низкая физическая активность. Данные факторы чаще всего связаны с развитием инсулинорезистентности.
В продолжение темы С.Р. Гиляревский отметил, что инсулин представляет собой мощный анаболический гормон, который влияет на разные клетки организма. Он стимулирует захват глюкозы скелетными мышцами, способствует синтезу в них гликогена, подавляет образование глюкозы в печени и липолиз в адипоцитах5. При инсулинорезистентности в организме происходят сильные, а иногда и необратимые изменения, поскольку биологические эффекты инсулина снижаются.
Феномен инсулинорезистентности обусловлен выраженным дефектом захвата глюкозы, который стимулирует инсулин, в большей степени в отношении синтеза гликогена, в меньшей – в отношении окисления глюкозы. При этом в разных тканях инсулинорезистентность проявляется по-разному – в зависимости от их физиологических и метаболических функций6.
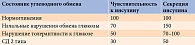
На начальных этапах нарушения углеводного обмена чувствительность тканей к инсулину снижается до 70%. Компенсаторно увеличивается секреция инсулина β-клетками. На стадии нарушения толерантности к глюкозе чувствительность тканей составляет уже 50% и остается низкой при СД 2 типа (таблица)7.
Снижение секреции инсулина, нарастание инсулинорезистентности, повышение продукции глюкозы печенью обусловливают повышение как глюкозы плазмы натощак, так и постпрандиальной глюкозы. Хроническая гипергликемия и ее последствия приводят к развитию сосудистых осложнений СД 2 типа8.
Установлена также связь между инсулинорезистентностью и развитием артериальной гипертонии, абдоминального ожирения, дислипидемии, заболеваний крови. Все это в сочетании с нарушением метаболизма глюкозы приводит к дисфункции эндотелия и атеросклерозу9.
По словам Н.А. Черниковой, при наличии у пациентов абдоминального ожирения следует рассчитать индекс инсулинорезистентности (Homeostasis Model Assessment – Insulin Resistance – HOMA-IR). Это можно сделать в лабораторных условиях либо с помощью калькуляторов, умножив значения гликемии натощак (ммоль/л) на концентрацию инсулина натощак (мкЕД/л) и разделив получившееся число на 22,510.
Далее С.Р. Гиляревский затронул тему внутриклеточных механизмов передачи сигнала и влияние на них инсулинорезистентности. Установлено, что нарушение передачи сигналов может быть вызвано дефектом транспорта глюкозы или проблемой с инсулиновыми рецепторами.
«Чтобы решить данную проблему, требуется не только изменение образа жизни, но и фармакотерапия», – подчеркнула Н.А. Черникова.
Со своей стороны С.Р. Гиляревский добавил, что если функция транспортеров глюкозы нарушается, в том числе вследствие приема каких-либо препаратов, то мышцы не захватывают глюкозу. Как следствие, переизбыток глюкозы, гипергликемия и даже развитие СД8.
«Несмотря на гетерогенность механизмов развития, в случае резистентности к инсулину требуется предпринимать попытки повысить эту чувствительность, повлиять и на инсулиновые рецепторы, и на белки-переносчики, в частности на глюкозный транспортер 4», – подчеркнула Н.А. Черникова.
Далее выступающие перешли к более подробному рассмотрению значения инсулинорезистентности для организма в целом, то есть системных эффектов инсулинорезистентности.
Почему же кардиологи и терапевты придают такое важное значение инсулинорезистентности? «В том числе и потому, что при данном состоянии происходит накопление триглицеридов», – пояснил С.Р. Гиляревский.
При нарушении углеводного обмена отмечается патологическое изменение состава липидов крови. Помимо повышения уровня триглицеридов увеличивается концентрация мелких плотных частиц холестерина липопротеинов низкой плотности, которые отличаются высокой атерогенностью, и уменьшение концентрации холестерина липопротеинов высокой плотности.
Инсулинорезистентность приводит к липотоксичности и другим метаболическим нарушениям, в частности изменению утилизации инсулина, что существенно увеличивает риск развития сердечно-сосудистых заболеваний.
В настоящее время установлена связь между инсулинорезистентностью и риском развития коронарной болезни сердца11 и сердечной недостаточности12: у любого больного с сердечной недостаточностью развивается инсулинорезистентность, потому что клетки сердца плохо воспринимают сигналы инсулина.
Чем опасна неалкогольная жировая болезнь печени (НАЖБП) у пациентов с СД? Доказано, что существует связь между очаговым вариантом НАЖБП и риском развития фиброза печени, а также онкологических заболеваний. Кроме того, НАЖБП – это дополнительный фактор, усиливающий печеночную инсулинорезистентность. НАЖБП также обусловливает развитие сердечно-сосудистых заболеваний. В качестве возможных механизмов рассматривают резистентность клеток печени к инсулину, накопление в ней свободных жирных кислот, повышенное образование глюкозы и снижение передачи сигналов инсулина.
В связи со сказанным выступающие еще раз подчеркнули важность своевременной диагностики и лечения нарушений углеводного обмена.
При подборе медикаментозной терапии лицам с инсулинорезистентностью необходимо учитывать не только риск развития сердечно-сосудистых заболеваний, но и СД, кроме того, не все препараты эффективны в такой ситуации. Так, в исследовании NAVIGATOR установлено, что прием валсартана в дозе 160 мг/сут в течение пяти лет у пациентов с нарушением толерантности к глюкозе снижал риск развития СД на 14%, однако не предотвращал развитие осложнений сердечно-сосудистых заболеваний13.
В 2016 г. был выполнен метаанализ трех крупных клинических исследований, в которых применяли ингибиторы натрий-глюкозного котранспортера 2 (НГЛТ-2) у больных СД 2 типа с целью снижения сердечно-сосудистого и почечного риска. Результаты анализа свидетельствуют о том, что применение ингибиторов НГЛТ-2 оказывало умеренное влияние на риск развития тяжелых осложнений сердечно-сосудистых заболеваний, обусловленных атеросклерозом14. В наибольшей степени преимущества препаратов, относящихся к этому классу, отмечались в отношении частоты госпитализаций по поводу сердечной недостаточности и прогрессирования болезни почек. Согласно результатам исследования LEADER, применение лираглутида у пациентов с СД 2 типа снижало риск развития осложнений сердечно-сосудистых заболеваний15.
Для коррекции нарушений углеводного обмена у больных СД применяют тиазолидиндионы, которые повышают чувствительность клеток к инсулину за счет повышения экспрессии многих генов16. Однако их использование было ограниченно после получения результатов исследования RECORD, в ходе которого выявлена связь между применением розиглитазона и риском переломов, задержки жидкости и развитием неблагоприятных исходов, обусловленных осложнениями сердечно-сосудистых заболеваний.
Эксперты также представили данные об эффективности и безопасности применения нового российского препарата Субетта, механизм действия которого заключается в стимулировании транспорта глюкозы за счет влияния на глюкозный транспортер 417.
По словам Н.А. Черниковой, Субетта относится к препаратам-сенситайзерам, увеличивающим чувствительность клеток к инсулину. Добавление этого препарата к инсулину (10 нмоль) увеличивало стимулированный инсулином захват глюкозы на 43%.
С.Р. Гиляревский привел данные рандомизированного исследования, в котором в дополнение к стандартной противодиабетической терапии пациенты получали одну таблетку Субетты четыре раза в день или плацебо по такой же схеме. Установлено, что добавление Субетты к терапии СД 2 типа приводило к снижению уровня гликированного гемоглобина (HbA1c) на 0,54% (рис. 2)18.
При добавлении препарата к метформину частота нежелательных явлений была сопоставима с таковой при применении плацебо и метформина.
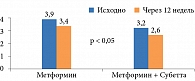
В другом исследовании в группе комбинированной терапии Субеттой и метформином отмечали более выраженное снижение индекса HOMA-IR, чем в группе монотерапии метформином (рис. 3)19.
Сочетанное применение препарата Субетта и метформина сопровождалось синергизмом антигипергликемических эффектов, что обеспечивало статистически значимое снижение уровня глюкозы в крови20.
В заключение С.Р. Гиляревский отметил, что и кардиологи, и терапевты, и эндокринологи проявляют интерес к препарату Субетта, механизм действия которого связан с сохранением функции транспортера глюкозы 4. Применение такого препарата в составе комбинированной терапии с метформином характеризовалось высокой эффективностью и безопасностью у больных СД 2 типа. В свою очередь Н.А. Черникова подчеркнула, что основная задача эндокринологов, терапевтов и кардиологов, которые лечат больных СД 2 типа, состоит в назначении такой схемы лечения, которая способствовала бы поддержанию метаболического здоровья пациентов.
Роль инсулинорезистентности в патогенезе сахарного диабета у лиц пожилого возраста: особенности клиники, диагностики и лечения
В структуре заболеваемости СД на пожилых пациентов приходится примерно четверть случаев, и со временем их число будет только увеличиваться21. В частности, если в 2017 г. насчитывалось 98 млн больных в возрасте 65–79 лет, то в 2045 г. их количество может возрасти до 191 млн. Именно поэтому вопросы особенностей клинических проявлений патологии, ее диагностики и лечения в данной популяции являются столь актуальными для врачей-эндокринологов и гериатров.
В своем выступлении Екатерина Наильевна ДУДИНСКАЯ, к.м.н., заведующая лабораторией возрастных метаболических эндокринных нарушений Российского геронтологического научно-клинического центра Российского национального исследовательского медицинского университета им. Н.И. Пирогова, сделала акцент на особенностях углеводного обмена у лиц пожилого возраста. Известно, что после 50 лет через каждые десять лет гликемия натощак повышается на 0,055 ммоль/л (1 мг%), постпрандиальная – на 0,5 ммоль/л (10 мг%). Поэтому большая часть пожилых пациентов имеет глюкозу натощак в границах нормы, а постпрандиальную – на уровне показателей, характерных для СД. Поскольку врачи ориентируются, как правило, на первый критерий, выявить патологию в данной популяции бывает сложно.
Причиной данного феномена является снижение чувствительности тканей к инсулину.
Существует множество причин повышения инсулинорезистентности в пожилом возрасте: уменьшение мышечной массы тела, снижение физической активности, высококалорийное питание вследствие его дешевизны, саркопеническое ожирение, повышение уровня свободных жирных кислот, снижение активности транспортеров глюкозы. С возрастом также снижается инкретиновый эффект, что связано с заболеваниями и возрастными атрофическими изменениями желудочно-кишечного тракта.
«Не случайно возраст признан одним из важнейших факторов нарушения углеводного обмена, а также развития сахарного диабета, поэтому после 45 лет даже в отсутствие факторов риска каждые три года рекомендуется проводить скрининг на наличие данной патологии», – подчеркнула Е.Н. Дудинская.
К ассоциированным с возрастом состояниям относится и метаболический синдром21. Однако стоит учитывать, что метаболический синдром у пожилых имеет отличительные особенности. Его диагностика затруднена из-за отсутствия параметров (индекс массы тела, окружность талии, процентное содержание висцеральной жировой массы) и референсных значений, с помощью которых можно было бы оценить риск развития и прогноз ожирения в данной популяции.
Насколько опасна избыточная масса тела для данной категории пациентов?
Известно, что повышение индекса массы тела до 25,0–29,9 кг/м2 в старшей возрастной группе связано с понижением риска смерти по сравнению с лицами молодого и среднего возраста. Однако, несмотря на то что относительный риск смерти при повышении индекса массы тела у лиц 60 лет и старше уменьшается, абсолютный риск у лиц старше 75 лет увеличивается. Кроме того, увеличение индекса массы тела у пожилых ассоциируется с более высокой минеральной плотностью кости, как следствие, с меньшим риском развития остеопороза и перелома бедренной кости22, 23. Именно поэтому гериатры рекомендуют снижать индекс массы тела не более 22–35 кг/м2. Это позволит не только уменьшить риск смерти24, но и увеличить скелетную и мышечную массу, снизить риск переломов при падении, повысить выживаемость при гипотермии и голоде, обеспечит преимущества при проведении хирургических вмешательств.
В то же время ожирение является основной причиной развития старческой астении, выживаемость таких пациентов гораздо ниже, чем пациентов без метаболического синдрома. Прогноз у этих больных зависит от времени дебюта ожирения: чем позже, тем выше вероятность того, что смерть наступит раньше возникновения его осложнений. По словам Е.Н. Дудинской, более опасным является вариабельность массы тела, а не ее стойкое повышение22.
Далее выступающая подробно рассмотрела влияние инсулинорезистентности на состояние организма. В настоящее время установлена прямая связь между старческой астенией, инсулинорезистентностью и сахарным диабетом. Повышение резистентности к инсулину также приводит к развитию саркопении из-за ухудшения функции сосудов25, в частности по причине быстрого старения.
В основе сосудистого старения лежит снижение длины теломер, обусловленное инсулинорезистентностью26. У пациентов с инсулинорезистентностью и СД активность теломеразы гораздо ниже, чем у пациентов без резистентности к инсулину, то есть любое внешнее повреждение клетки не может быть полноценно восстановлено27. Немаловажно и то, что при усугублении инсулинорезистентности ухудшается морфофункциональное состояние магистральных артерий, усиливаются процессы атеро- и артериосклероза28.
Обращаясь к вопросу коррекции инсулинорезистентности, Е.Н. Дудинская подчеркнула, что самое главное – изменение образа жизни. Прежде всего следует снизить калорийность пищи. Минимальное количество потребляемых килокалорий для женщин должно составлять 1600, для мужчин – 1800. С учетом продуктов питания корректируется прием воды. Однако пожилые пациенты в день должны выпивать не менее 2 л жидкости, в том числе не менее 800 мл воды. Следует минимизировать потребление простых углеводов, а также удовлетворять высокую потребность в белке. Так, доля белка должна составлять 1,0–1,2 г/кг/сут, соотношение растительного и животного белка – 1:1. Лицам пожилого возраста рекомендуется употреблять препараты кальция (1000–1200 мг/сут) и витамин D (800–1000 мг/сут). Нецелесообразно рекомендовать им низкожировые продукты, ограничивать потребление животных жиров и сильно сокращать количество потребляемой соли, если на это нет прямых указаний кардиолога. Кроме того, в этом возрасте очень важно поддерживать физическую активность.
Первой линией терапии СД в данной популяции является метформин. Однако для управления заболеванием одного препарата может быть недостаточно, поскольку с возрастом снижается количество рецепторов к инсулину на поверхности клеток и их чувствительность. В качестве дополнительной терапевтической опции к метформину у лиц пожилого возраста можно рассматривать препарат Субетта.
Субетта содержит в релиз-активной форме антитела к С-концевому фрагменту β-субъединицы рецептора инсулина29. Препарат повышает активность рецепторов инсулина, усиливая их чувствительность к инсулину, и стимулирует метаболизм инсулинзависимой глюкозы, что позволяет достичь антигипергликемического эффекта без риска гипогликемии.
Кроме того, Субетта содержит в релиз-активной форме антитела к эндотелиальной NO-синтазе. За счет этого обеспечивается протективное воздействие на эндотелий, уменьшается реактивность и спазм сосудов, улучшается периферическая микроциркуляция30.
Как было отмечено ранее, Субетта увеличивает количество активированных рецепторов инсулина (рис. 4)29.
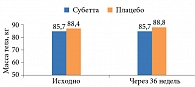
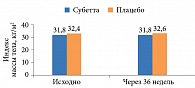
Препарат также способствует поддержанию стабильного веса у пациентов с СД 2 типа, не оказывая значимого влияния на индекс массы тела (рис. 5 и 6)31.
В исследованиях отмечалась высокая степень совместимости препарата Субетта с другими лекарственными средствами. Большинство (86,3%) пациентов принимали препараты для лечения сердечно-сосудистых осложнений СД. Нежелательных лекарственных взаимодействий выявлено не было31.
Завершая выступление, Е.Н. Дудинская подчеркнула, что самое важное – это не просто повлиять на какую-то патогенетическую точку, в данном случае на инсулинорезистентность, но сохранить функциональный статус пожилого человека.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.