Влияние нарушений реологических свойств крови матери на внутриутробное развитие плода
- Аннотация
- Статья
- Ссылки
- English
Важнейшей задачей современного акушерства являются профилактика и лечение серьезных осложнений беременности, оказывающих прямое влияние на перинатальные исходы для матери и плода. В ряду таких осложнений значимое место занимают плацентарная недостаточность и синдром задержки развития плода (СЗРП).
Частота СЗРП колеблется от 3–10% в развитых странах до 15–20% – в развивающихся. Известно, что именно СЗРП чаще всего обусловливает низкий вес ребенка при рождении. Связь между СЗРП/низким весом и мертворождаемостью/смертностью новорожденных может быть установлена в 66–69% случаев [1, 2].
Причины СЗРП многочисленны. Среди них возраст матери, паритет, избыточная и низкая масса тела во время беременности, гестационная гипертензия, экстрагенитальная патология и др. При всем разнообразии факторов, ассоциированных с задержкой развития плода, патогенетические механизмы этого осложнения во многом универсальны. Большое значение в их реализации играют структурные особенности плаценты и гемодинамические характеристики женской крови, являющейся для плода единственным поставщиком энергетических и пластических ресурсов [3–5].
Известно, что физические свойства крови играют главную роль в реализации ее реологических возможностей. Для поддержания плацентарного кровотока необходима высокая текучесть в микроциркуляторном звене. Напомним, что кровь – это неньютоновская жидкость, поэтому ее вязкость – это переменная величина, которая зависит от диаметра сосуда и колеблется в пределах 1,7–22,9 мПа•с [6]. Чем меньше диаметр сосуда, тем выше вязкость протекающей в нем крови. Эта пропорция описывается моделью Кессона, и показатель вязкости в наибольшей степени определяется концентрацией форменных элементов, то есть гематокритом и опосредованно уровнем гемоглобина. Оптимизировать скорость движения крови в межворсинчатом пространстве можно только за счет снижения концентрации эритроцитов. На это и направлен процесс физиологической гемодилюции, в основе которого лежит увеличение объема циркулирующей плазмы. Он наиболее заметен во втором триместре беременности. Именно в этот срок завершается вторая волна инвазии трофобласта и в значительной степени программируется дальнейшее течение беременности [3, 7–9].
Физиологические рамки концентрационных характеристик крови у беременных до сих пор остаются предметом дискуссий. Нижняя граница нормы гемоглобина во втором триместре оценивается как 105–110 г/л [1–10]. Верхний предел не обозначен как для беременности в целом, так и для отдельных ее этапов. В то же время очевидно, что отсутствие гемодилюции, ведущей к повышенной вязкости и нарушенной микроциркуляции крови, может быть маркером грядущего неблагополучия [11–13]. Имеются данные о том, что при высоком уровне гемоглобина у женщины во время беременности риск перинатальной смертности повышается в 2,6 раза. По результатам анализа исходов 295 651 родов высокий гемоглобин назван независимым фактором риска неблагоприятных перинатальных исходов [14, 15].
Для того чтобы определить верхнюю границу концентрационных показателей крови у женщин в средние сроки гестации, нами был оценен средний уровень показателя гемоглобина в выборке из 280 беременных, не страдающих анемией и находящихся на сроках 16–24 недели. Установлен средний показатель гемоглобина – 118,4 г/л (95% ДИ 116,7–120,0), а первое стандартное отклонение зафиксировано на отметке 126,6 г/л. Уровень гемоглобина превысил это значение у неожиданно значимого числа женщин (n = 52, 18,5%). Мы наблюдали течение беременностей этих женщин (основная группа) в сравнении с 50 случайно отобранными беременными, имеющими уровень гемоглобина 110–126,5 г/л (группа сравнения).
При сопоставлении основных анамнестических характеристик оказалось, что при одинаковом среднем возрасте женщин число первородящих в основной группе было выше (63%). В то время как в группе сравнения на долю пациенток с первыми и повторными родами пришлось 48 и 52% соответственно (p = 0,04).
Была проанализирована динамика гемоглобина на различных сроках текущей беременности. Для женщин основной группы было характерно незначительное снижение гемоглобина от первого ко второму триместру с дальнейшей стабилизацией на среднем уровне 129,3 г/л (95% ДИ 126,7–131,9). При этом у 20% пациенток были зафиксированы очень высокие показатели – 140–149 г/л. В группе сравнения наблюдалась иная динамика. Если в начале беременности значения гемоглобина были сходными с таковыми в основной группе, то к 20–21-й неделе они существенно снизились до 113,2 г/л (95% ДИ 120,2–116,1). У 22% женщин в этот период появлялись признаки анемии. Однако к родам гемоглобин вновь повысился до 118,5 г/л (95% ДИ 117,2–119,7).
Ультразвуковые маркеры начинающейся фетоплацентарной недостаточности у женщин основной группы были обнаружены уже во втором триместре, на 18–22-й неделе. На этом сроке такие симптомы, как изменение толщины и степени зрелости плаценты, имели место у 27% пациенток, а к 32–36-й неделе – уже у 37%. Признаки внутриутробного страдания плода в третьем триместре фиксировались в 27% случаев. В группе сравнения отклонения ультразвуковых характеристик плаценты обнаруживались только в третьем триместре, они редко сопровождались симптомами хронической гипоксии плода (около 4%, различия с основной группой значимы, критерий χ2 = 10,13, р = 0,0015).
Реализация плацентарной недостаточности в СЗРП (по данным ультразвукового исследования) у женщин основной группы происходила, как правило, в последнем триместре беременности, иногда до 30 недель. Задержка развития плода зафиксирована у 42% женщин с повышенным уровнем гемоглобина. В группе сравнения СЗРП наблюдался только в 4% случаев (критерий χ2 = 19,32, р = 0,00). Наличие гемоконцентрации повышало шансы развития СЗРП более чем в 16 раз (отношение шансов = 16,25 ± 0,77, 95% ДИ 3,55–74,2).
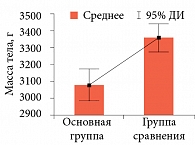
В большинстве случаев антенатальный диагноз нашел свое подтверждение после рождения ребенка. Родоразрешение в обеих группах произошло на симметричных сроках. При этом масса тела детей, рожденных от женщин с гемоконцентрацией, в среднем составила 3057 г (95% ДИ 2927,9–3186,2), а в группе сравнения – 3480 г (95% ДИ 3362,1–3614,6, t = 4,79, p = 0,001) (рис. 1). Число детей с подтвержденным диагнозом СЗРП в основной группе составило 43%, что соответствовало результатам антенатальной диагностики. Гипоксия при рождении была отмечена в 52% случаев, в каждом третьем случае она была среднетяжелой или тяжелой. В 17% наблюдений возникла необходимость перевода на второй этап лечения. В группе сравнения на долю детей с низкой массой тела приходилось только 6%. Течение раннего неонатального периода, как правило, носило физиологический характер.
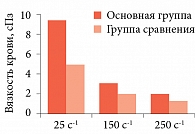
Предполагая, что основной причиной худших перинатальных исходов было нарушение реологических свойств крови, связанное с повышенной ее концентрацией, мы провели исследование вязкости крови в диапазоне высоких и низких скоростей сдвига. Это имитировало ситуацию в крупных и самых мелких сосудах. Использовался ротационный микровискозиметр МВР-1 «Росинка» со скоростями сдвига от 25 до 250 с-1. В основной группе вязкость цельной крови при скорости сдвига 25 с-1 равнялась 10,46 ± 4,55 сПз, при скорости сдвига 150 с-1 – 3,08 ± 0,78 сПз, а при 250 с-1 – 1,85 ± 0,21 сПз. В группе сравнения показатель вязкости составил 5,21 ± 4,75, 2,16 ± 0,27 и 1,54 ± 0,09 сПз соответственно (рис. 2). Наибольшая разница параметров была достигнута при низких скоростях сдвига – у женщин основной группы вязкость крови была в 2 раза выше (t = 4,80, p = 0,005). Значит, в мелких сосудах и межворсинчатом пространстве ее текучесть была значительно нарушена. Таким образом, первоначальная гипотеза получила подтверждение.
Визуализировать нарушения текучих свойств крови позволяет биомикроскопия сосудов конъюнктивы глазного яблока. Возможность экстраполяции локальных данных на системный кровоток доказана в экспериментальных и клинических исследованиях [16].
В нашем исследовании биомикроскопия выполнялась при помощи щелевой лампы ЩЛ-2Б. Количественная оценка состояния конъюнктивальной микроциркуляции проводилась по системе критериев Л.Т. Малой и соавт. (1977) с вычислением парциальных и общего конъюнктивального индекса в баллах. Учитывались сосудистые нарушения (изменения соотношений диаметров артериол и венул, количества функционирующих капилляров, степень мобилизации артериоло-венулярных шунтов), а также вне- и внутрисосудистая патология (кровоизлияния, периваскулярный отек, сладж-феномен и микротромбоз).
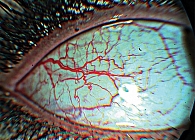
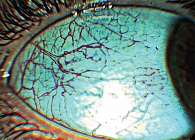
В основной группе сосудистый конъюнктивальный индекс составил 8,71 балла (95% ДИ 7,55–9,88), а в группе сравнения – 0,75 балла (95% ДИ 0,46–1,04, t = 10,64, p = 0,001). Разница в показателях микроциркуляции была обусловлена выраженными сосудистыми изменениями у беременных с гемоконцентрацией. На фоне дегенеративных повреждений сосудистой стенки, заключающихся в неравномерности калибра и извилистости, манифестировала артериальная вазоконстрикция. Увеличивалось количество артериоло-венулярных анастомозов. Это приводило к запустеванию капиллярной сети – уменьшению числа функционирующих капилляров, вследствие чего замедлялся кровоток в сосудистом конъюнктивальном бассейне (рис. 3 и 4). В основной группе также был широко представлен внутрисосудистый патологический компонент, преимущественно за счет сладж-феномена, в венулах и капиллярах. Парциальный конъюнктивальный индекс составил 1,29 балла (95% ДИ 1,08–1,5). В группе сравнения внутрисосудистых изменений не отмечалось.
Различий во внесосудистом индексе между группами обнаружено не было. В итоге общий конъюнктивальный индекс в основной группе составил 10,14 балла (95% ДИ 8,91–11,37), а в группе сравнения – только 0,75 балла (95% ДИ 0,46–1,04, t = 11,85, p = 0,00).
Данные биомикроскопии продемонстрировали, что повышенная вязкость крови у беременных с гемоконцентрацией прямо реализуется в виде выраженного системного нарушения микроциркуляции. Вероятно, именно это приводит к падению маточно-плацентарного кровотока и создает предпосылки к формированию СЗРП.
Полученные результаты подтверждают, что умеренная гемоконцентрация во втором триместре беременности является серьезной проблемой. Несмотря на достаточную распространенность ситуации, специалисты, как правило, не уделяют ей должного внимания. Между тем отсутствие врачебной настороженности и непонимание негативных последствий гемоконцентрации в период второй волны инвазии трофобласта могут привести к неблагоприятным перинатальным исходам.
В настоящее время не существует способов снизить концентрационные показатели крови у беременной. Однако можно улучшить реологические характеристики крови, повысить текучие свойства и тем самым обеспечить эффективную микрогемодинамику. С этой точки зрения следует обратить внимание на дипиридамол – хорошо изученный препарат, который давно известен врачам и широко используется в акушерской практике.
Основа фармакологического действия дипиридамола заключается в ингибировании захвата аденозина тромбоцитами, эритроцитами и клетками эндотелия. Это соотносится с увеличением локальных концентраций аденозина. Последний, влияя на А2-рецепторы тромбоцитов, способствует стимуляции аденилатциклазы и увеличению концентрации циклического 3,5-аденозинмонофосфата. Данный механизм определяет ингибирование агрегации тромбоцитов и поддерживает локальное вазодилатирующее влияние дипиридамола. Кроме того, сосудорасширяющий эффект связан и со способностью препарата потенцировать синтез эндотелиоцитами оксида азота. Ангиогенная активность определяется стимуляцией образования капилляров и коллатеральных артерий. Способность дипиридамола ингибировать активность ренина в плазме крови и снижать концентрацию альдостерона, подавляя тем самым функциональность ренин-ангиотензин-альдостероновой системы, оказывает положительное действие на пациентов с артериальной гипертензией [17]. Сегодня доказаны эффекты дипиридамола в отношении профилактики развития сосудистых осложнений, в частности преэклампсии во время беременности [18]. Прием дипиридамола или ацетилсалициловой кислоты с целью профилактики преэклампсии рекомендует Всемирная организация здравоохранения [19]. При этом ацетилсалициловая кислота в России противопоказана в первом и третьем триместрах беременности, тогда как дипиридамол разрешен к использованию в течение всего гестационного периода. Известно, что в комбинации с низкомолекулярным гепарином дипиридамол способствует снижению частоты антенатальных потерь, преждевременных родов и низкого веса плода при высоком риске плацентарной недостаточности [20]. Дипиридамол имеет минимальную трансплацентарную перфузию, что делает его применение во время всего периода беременности полностью безопасным для плода [21].
Зарегистрированные в России препараты Курантил® (Курантил® 25, Курантил® N 25, Курантил® N 75) – это пероральные формы дипиридамола. Наиболее удобной для беременных оказалась форма выпуска в виде таблеток, покрытых оболочкой, – Курантил® N 25 (дипиридамол 25 мг). В соответствии с инструкцией по применению препарат показан для профилактики плацентарной недостаточности при осложненной беременности. В акушерской практике препарат используется для улучшения плацентарного кровотока и предупреждения дистрофических изменений в плаценте, устранения гипоксии тканей плода и накопления в них гликогена. Может использоваться у беременных с высоким риском плацентарной недостаточности: внутриутробной инфекцией, гестозом, аутоиммунной патологией, экстрагенитальными заболеваниями (сахарным диабетом, метаболическим синдромом), а также заболеваниями, для которых характерно тромбообразование. Режим терапии выбирается индивидуально.
Опыт, накопленный в отечественной акушерской практике, подтверждает, что препараты Курантил® N 25 и Курантил® N 75 оказывают положительное действие на плацентарный кровоток при маточно-плацентарной и плодово-плацентарной формах дисфункции плаценты [22, 23]. Характерно, что эффекты препарата носят универсальный характер и реализуются вне зависимости от причин, вызвавших нарушение плацентарного кровотока. Это способствует снижению числа осложнений беременности и улучшению перинатальных исходов при инфекционно-воспалительных процессах, аутоиммунных заболеваниях, патологии вен малого таза и других заболеваниях [24–27].
С учетом полученных нами данных не вызывает сомнения целесообразность назначения препаратов Курантил® N 25 и Курантил® N 75 пациенткам, у которых уровень гемоглобина во втором триместре беременности превышает 126–130 г/л. Следует придерживаться терапевтической дозы препарата (75–150 мг в сутки) и продолжительности лечения сроком четыре – шесть недель с возможным повтором курса через месяц. Улучшение маточно-плацентарного кровотока за счет фармакологических эффектов препарата обеспечивает надежную профилактику СЗРП и осуществляет действенную защиту плода в условиях гемоконцентрации у матери.
T.P. Zefirova, I.Kh. Sabirov, M.Ye. Zhelezova
Kazan State Medical Academy
Health Department Kazan (Volga Region) Federal University
Contact person: Tatyana Petrovna Zefirova, tzefirova@gmail.com
Here, current understanding regarding blood rheological properties in pregnant women and their impact on placental blood flow, fetal growth and development are presented. A role for physiological hemodilution in the second trimester was noted. In addition, personal data regarding course of gestation and perinatal outcomes in women with elevated blood concentrating parameters were presented. It was found that during such situation, fetal growth retardation was the most typical complication (40% cases). It was demonstrated that pathophysiological mechanism underlying development of such condition was based on increased blood viscosity within low-range vessels and disturbed microcirculatory blood flow. Feasibility of therapy aimed at improving blood rheological properties was justified. In particular, pregnant women in the second trimester with elevated hemoglobin level were recommended to receive Curantyl N.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.