Вопросы ведения пациентов в восстановительном периоде ишемического инсульта
- Аннотация
- Статья
- Ссылки
- English



Введение
Острые нарушения мозгового кровообращения (ОНМК) – одна из самых актуальных медико-социальных проблем. Заболеваемость инсультом составляет 2,5–3 случая на 1000 населения в год. Ежегодно в России регистрируется более 400 тыс. инсультов, при этом 70–80% приходится на ишемический тип. Смертность в остром периоде инсульта достигает 35%, увеличиваясь на 12–15% к концу первого года после перенесенного инсульта. Риск повторного ОНМК после первого инсульта составляет 26% в течение последующих пяти лет и 39% в течение десяти лет. Инсульт занимает первое место среди всех причин инвалидности – 3,2 на 10 000 населения. По данным Национального регистра, 31% пациентов, перенесших инсульт, нуждаются в постоянном уходе, а к труду возвращается только 20%. Таким образом, ведение больных после перенесенного ишемического инсульта по-прежнему является важнейшей задачей клинической неврологии и во многом определяется особенностями неврологических нарушений [1–3]. Для оценки состояния пациентов, перенесших ишемический инсульт, в клинической практике используются шкала тяжести инсульта Национального института здоровья США (National Institutes of Health Stroke Scale – NIHSS), шкала оценки мышечной силы Комитета медицинских исследований, модифицированная шкала Рэнкина (табл. 1), индекс мобильности Ривермид, шкала баланса Берга, индекс ходьбы Хаузера, шкала функциональной независимости, тест для оценки функции руки Френчай [3, 4]. Состояние больных оценивают как при первичном осмотре, так и в динамике для отслеживания эффективности проводимых реабилитационных мероприятий. К ведущим задачам при ведении пациентов в восстановительном периоде ишемического инсульта относятся профилактика повторного инсульта, максимальное восстановление утраченных функций и улучшение качества жизни больных и ухаживающих за ними лиц.
Основные принципы реабилитации
Согласно приказу Минздрава России от 15.11.2012 № 928н, реабилитационные мероприятия, направленные на восстановление нарушенных или компенсацию утраченных функций, а также на ресоциализацию пациентов, начинают реализовываться с первого дня в неврологическом отделении для больных с ОНМК и обязательно продолжаются на амбулаторном этапе силами медицинских организаций, работающих в сфере медицинской реабилитации [4, 5].
В основе механизмов компенсации нарушенной функции лежит феномен нейропластичности (способность клеток нервной системы регенерировать, анатомически и функционально изменяться). Кроме того, имеют значение качественные и количественные изменения нейрональных связей и глиальных элементов, а также формирование новых функциональных систем [6, 7].
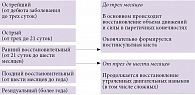
Реабилитационные мероприятия необходимо начинать в остром и раннем восстановительном периодах инсульта (рис. 1). В соответствии с последними рекомендациями Союза реабилитологов России (2015) разработана концепция реабилитации в интенсивной терапии (РеабИТ), направленная на сохранение физиологического и социального статуса пациентов после перенесенного критического состояния на преморбидном уровне, а также на предупреждение и лечение иммобилизационного синдрома и синдрома «после интенсивной терапии». Иммобилизационный синдром – комплекс полиорганных нарушений, вызванных нефизиологическим ограничением двигательной и когнитивной активности (феномен learned non-used – «разучился использовать») и деафферентацией. Синдром «после интенсивной терапии» – совокупность ограничивающих повседневную жизнь соматических, неврологических и социально-психологических последствий пребывания в условиях отделения реанимации и интенсивной терапии [8].
Эффективность реабилитационных мероприятий повышается, если их проводит мультидисциплинарная бригада в составе невролога, врача физической реабилитационной медицины, врача и инструктора лечебной физической культуры, логопеда, психолога/психотерапевта, эрготерапевта, физиотерапевта, медицинской сестры, а также социального работника. Специалисты мультидисциплинарной бригады объективно оценивают реабилитационный потенциал пациента и после совместного обсуждения с ним определяют цели реабилитации (краткосрочные и долгосрочные). В соответствии с намеченными целями составляется план мероприятий.
В ходе реабилитационных мероприятий используется большое число методов физической реабилитации: лечебная гимнастика, правильное позиционирование, вертикализация, сенсорное выравнивание, проприоцептивное нейромышечное облегчение и др. По показаниям применяются биологическая обратная связь, массаж, рефлексотерапия, физиотерапия, мануальная терапия, психотерапия, музыкотерапия и эрготерапия, физические упражнения в водной среде (лечебном бассейне). Активно используется современное специализированное оборудование: различные тренажеры (тредмил, вело- и гребные тренажеры), стабилоплатформы, роботизированные устройства (стол-вертикализатор Erigo, автоматизированное устройство для восстановления походки Lokomat, комплекс для раннего восстановления функции верхней конечности Armeo, аппарат Rejoint для отработки функций поврежденной руки), аппарат Ормед Flex 01 для разработки суставов и нормализации мышечного тонуса, Нейропорт для улучшения процессов нейропластичности, Motomed для профилактики контрактур и снижения спастичности, экзоскелет нижних конечностей (Ekso, Indego, Rewalk), многофункциональный «петлевой» комплекс для проведения пулитотерапии (блокотерапии) [5, 9, 10].
Среди основных задач реабилитационных мероприятий после инсульта следует выделить [10]:
- раннюю мобилизацию;
- профилактику развития контрактур, артропатий и пролежней;
- профилактику тромбоза глубоких вен;
- диагностику и коррекцию дисфагии;
- нутритивную поддержку;
- формирование циркадианных ритмов;
- диагностику и лечение постинсультных когнитивных нарушений;
- диагностику и лечение аффективных (постинсультная депрессия, генерализованное тревожное расстройство) и поведенческих расстройств;
- диагностику и лечение боли в плече, постинсультной центральной боли;
- профилактику падений вследствие постинсультной атаксии;
- профилактику постинсультного остеопороза;
- раннюю бытовую адаптацию пациента.
Коррекция двигательных нарушений
Двигательные нарушения в виде центральных парезов и параличей различной степени выраженности считаются одними из наиболее частых инвалидизирующих последствий инсульта. В раннем восстановительном периоде выделяют такие цели двигательной реабилитации, как скорейшая активизация больных, уменьшение спастичности, улучшение функции ходьбы, вертикализация, тренировка устойчивости, повышение толерантности к физическим нагрузкам, овладение различными бытовыми навыками. Ранняя активизация позволяет избежать многих осложнений обездвиженности: тромбофлебитов, пролежней, гипостатической пневмонии и др. [9–12].
Спастичность в паретичных конечностях обычно нарастает в течение нескольких недель и месяцев с момента развития инсульта, приводит к ухудшению двигательных функций, способствует развитию контрактур и деформации конечности и может сопровождаться болезненными мышечными спазмами. Нужно помнить, что коррекция спастичности необходима только в тех случаях, когда она ухудшает двигательные функции пациентов, приносит им дискомфорт и затрудняет уход за ними. Для коррекции спастичности используют немедикаментозные методы, нервно-мышечную электростимуляцию, физиотерапевтические методы, направленные на профилактику образования контрактур, и лекарственные препараты. При локальной спастичности приоритет имеет введение в пораженные мышцы препаратов ботулинического токсина типа А [9–12].
К осложнениям инсульта относятся и артропатии суставов паретичных конечностей, которые могут привести к образованию контрактур, существенному ограничению объема активных и пассивных движений из-за болезненности в области суставов. При артропатиях назначаются теплолечение, вакуумный или турбулентный массаж, обезболивающие электрофизиопроцедуры (синусоидальные модулированные токи, диадинамические токи, чрескожная электронейростимуляция, электро- или фонофорез лекарственных веществ), лечебная гимнастика.
Контрактуры возникают в паретичных конечностях в течение первого года после инсульта в 60% случаев. Самая частая локализация контрактур – локтевые и лучезапястные суставы. Для лечения и профилактики развития контрактур особое значение имеют правильное позиционирование пациентов, частая смена положения в постели, выполнение медленных пассивных движений в суставах пораженных конечностей посредством здоровой руки или при помощи родственников [9–12].
Профилактика развития пролежней
Для профилактики развития пролежней необходимо менять положение больного: при высоком риске развития пролежней – каждые два часа днем и 3,5 часа ночью, очень высоком риске – каждые 1–1,5 часа днем и 2,5–3 часа ночью. Можно составить расписание с указанием точного времени поворота или изменения положения тела больного в постели [9, 11]. Важно ежедневно осматривать участки тела, потерявшие чувствительность, выявлять синяки, трещины, побелевшие или покрасневшие участки кожи. Особого внимания требуют места костных выступов: области ягодиц, крестец, грудной отдел позвоночника, лодыжки, колени, большой вертел бедренной кости, пятки, лопатки, локти, затылок, ушные раковины. Нужно ежедневно проводить туалет всей поверхности кожи («купание в постели»), использовать противопролежневые матрацы, массировать участки кожи, подверженные наибольшему давлению [10, 11].
Профилактика постинсультных падений
К частым осложнениям раннего восстановительного периода инсульта относятся падения, которые могут сопровождаться переломами (чаще всего шейки бедра и костей таза). После падения у пациентов формируется страх самостоятельного передвижения, что может приводить к снижению уровня физической активности и усугублению дезадаптации. Медперсонал и родственники должны тщательно наблюдать за больными, входящими в группу высокого риска падений. Не следует назначать таким пациентам препараты, вызывающие сонливость, негативно влияющие на концентрацию внимания или усиливающие слабость в паретичной ноге. Можно применять специальные технические средства (кресла-каталки, скобы, поручни, которые устанавливаются в палате, ванной комнате, коридоре) [9, 10].
Нутритивная поддержка и диагностика дисфагии
Нутритивная поддержка представляет собой комплекс мероприятий, направленных на обеспечение полноценного питания пациентов. По рекомендациям экспертов Национальной ассоциации по борьбе с инсультом, для оценки нутритивного статуса следует использовать шкалу скрининга питательного статуса (Nutritional Risk Screening – NRS) 2002 (табл. 2 и 3) [13–15]. Если сумма баллов по шкале NRS-2002 3 и более, то необходимо оценить состояние пациентов по критериям питательной недостаточности на основании величины следующих показателей: общий белок, альбумин сыворотки крови, лимфоциты периферической крови, индекс массы тела.
Нарушение глотания (дисфагия) входит в число наиболее опасных осложнений инсульта. Развитие дисфагии ассоциируется с высоким риском аспирационной пневмонии, выступает в качестве предиктора плохого функционального восстановления и увеличивает риск внезапной смерти. У пациентов с ОНМК дисфагия развивается при поражении бульбарного отдела ствола. Кроме того, она наблюдается приблизительно у 50% больных с полушарным ишемическим инсультом. При обследовании пациентов с нарушением глотания нужно определить этиологию и механизм дисфагии, выработать индивидуальную стратегию питания и провести профилактику возможных осложнений [13–15].
При подозрении на дисфагию необходима консультация специалиста по глотанию, который проводит детальный расспрос и осмотр пациентов, оценивает риск возникновения аспирации, решает вопрос о целесообразности выполнения фиброэндоскопического исследования или видеофлюороскопического исследования с барием, определяет способ питания пациентов [13–15]. Выбор конкретной методики кормления зависит от степени выраженности дисфагии и выраженности нутритивной недостаточности. Оценка адекватности кормления проводится лечащим врачом один раз в пять – семь суток по динамике массы тела, уровней общего белка сыворотки крови, альбумина сыворотки крови и лимфоцитов в периферической крови. Повторная оценка глотания выполняется планово раз в пять – семь суток или немедленно при появлении или прогрессировании клинических симптомов аспирации [13–15].
Коррекция постинсультных когнитивных нарушений
У 40–70% пациентов, перенесших инсульт, наблюдаются когнитивные нарушения, которые в 6–32% случаев достигают степени деменции. Постинсультными когнитивные нарушения признаются, если они развиваются в первые три – шесть месяцев после сосудистой катастрофы. По данным В.А. Парфенова и соавт., через шесть месяцев после инсульта когнитивные нарушения отмечаются у 62% больных [16].
Необходимо своевременно диагностировать постинсультные когнитивные нарушения, поскольку они значительно затрудняют ведение пациентов в восстановительном периоде инсульта, снижают приверженность к терапии и влияют на эффективность реабилитационных мероприятий.
Когнитивные нарушения могут быть вызваны не только перенесенным ишемическим инсультом, но и предшествующим сосудистым заболеванием головного мозга и/или параллельно протекающим нейродегенеративным процессом (чаще всего болезнью Альцгеймера). Для объективной оценки когнитивных функций проводится нейропсихологическое исследование. Желательно уточнить наличие и степень выраженности когнитивных нарушений до инсульта. Среди наиболее характерных симптомов сосудистых когнитивных нарушений следует выделить снижение темпа познавательной деятельности, колебания концентрации внимания, умеренные расстройства памяти по неспецифическому типу и недостаточность управляющих («лобных») функций головного мозга. Пациентам с легкими и умеренными когнитивными нарушениями рекомендуется регулярно тренировать память и внимание, а также получать медикаментозную терапию [15–18].
При речевых расстройствах первостепенное значение имеют занятия с логопедом-афазиологом или нейропсихологом. Положительный эффект от логопедических занятий наиболее выражен в ранние сроки после ишемического инсульта, поэтому занятия по восстановлению речи необходимо начинать в первые три недели. На амбулаторном этапе реабилитации занятия проводятся два-три раза в неделю по 45–60 минут. Помимо индивидуальных занятий с логопедом-афазиологом не менее эффективны групповые занятия (пациенты в группе должны быть с однотипными формами речевых расстройств и относительно одинаковой степенью их выраженности) и тренировки с помощью компьютерных программ [9, 19, 20].
Коррекция постинсультной депрессии
Примерно в 30–40% случаев у пациентов в постинсультном периоде развивается депрессия, которая признана фактором риска повторных инсультов, инфаркта миокарда и летального исхода. В первые шесть месяцев после инсульта депрессия также может приводить к возникновению когнитивных нарушений и деменции. Кроме того, постинсультная депрессия негативно влияет на эффективность проводимых реабилитационных мероприятий.
Для диагностики депрессии у больных, перенесших ишемический инсульт, можно использовать шкалу депрессии Бека, шкалу депрессии Гамильтона, шкалу депрессии при афазии. Медикаментозная терапия подразумевает прием антидепрессантов. Препарат должен быть подобран индивидуально с учетом возраста, соматического статуса, сопутствующих заболеваний и возможных побочных эффектов. Пациентам пожилого возраста с когнитивными нарушениями предпочтительно назначать антидепрессанты без выраженного холинолитического эффекта. Помимо медикаментозной коррекции пациентам рекомендуется когнитивная психотерапия [21, 22].
Коррекция тазовых расстройств
Нарушения мочеиспускания отмечаются у 25% пациентов через три – шесть месяцев после развития инсульта и у 10–15% – через год. Довольно часто больные страдают от гиперактивного мочевого пузыря, который проявляется учащением мочеиспускания, недержанием мочи, императивными позывами, ноктурией. К препаратам выбора при лечении гиперактивного мочевого пузыря относятся антихолинергические средства (оксибутинин, толтеродин, троспиум, солифенацин), которые снижают повышенную активность детрузора. Кроме того, возможно внутрипузырное введение препаратов ботулинического токсина типа А под контролем цистоскопии. Немедикаментозные методы включают в себя обучение пациента опорожнению мочевого пузыря до появления позыва на мочеиспускание, ведению дневника с указанием объема введенной и выделенной жидкости, выполнению упражнений для укрепления мышц тазового дна. При недержании мочи рекомендуется использовать прокладки и впитывающие трусы для взрослых [13].
Коррекция постинсультного болевого синдрома
Серьезное последствие инсульта – хронический болевой синдром, который только в небольшой части случаев непосредственно связан с поражением центральной нервной системы. Центральный постинсультный болевой синдром у большинства пациентов развивается в среднем через три-четыре месяца после перенесенного инсульта. Медикаментозная терапия в таком случае подразумевает назначение антиконвульсантов (габапентина, прегабалина), трициклических антидепрессантов (амитриптилина) или опиоидных анальгетиков (трамадола). При недостаточной эффективности медикаментозной терапии используют физиотерапевтические методы (транскраниальную магнитную стимуляцию, транскраниальную электростимуляцию). Однако, как правило, постинсультная боль вызвана скелетно-мышечной дисфункцией вследствие недостаточной физической активности и изменения двигательного стереотипа. Один из частых постинсультных болевых синдромов – боль в плечевом суставе, вызываемая подвывихом плеча и мышечной слабостью. Для профилактики данного осложнения важно придать правильное положение конечности и поддерживать объем движений в плечевом суставе [9, 10].
Нейрометаболическая поддержка реабилитационных мероприятий
Восстановление неврологических функций после ОНМК обеспечивается процессами нейропластичности. Для их стимулирования в восстановительном периоде ишемического инсульта целесообразно применять лекарственные препараты, которые оптимизируют интранейрональные метаболические процессы, способствуют образованию новых синаптических связей и усилению нейро- и ангиогенеза.
Имеется большой клинический опыт использования в восстановительном периоде ишемического инсульта цитиколина [23]. Его положительный эффект отмечен в том числе в Европейских рекомендациях по ведению пациентов с ишемическим инсультом [24]. Цитиколин (в частности, Цересил® Канон) – эндогенный мононуклеотид, который состоит из цитидина и холина, связанных дифосфатным мостиком, проявляет нейропротективный и репаративный эффект при повреждении нервных клеток. Цитидиндифосфатхолин участвует в синтезе структур фосфолипидов клеточных мембран, уменьшает накопление свободных жирных кислот, усиливает активность антиоксидантных систем и метаболических процессов в головном мозге, улучшает церебральный кровоток и передачу нервных импульсов в холинергических нейронах, стимулирует синтез ацетилхолина и дофамина. Он препятствует развитию эксайтотоксичности за счет блокирования, вызванного ишемией выброса глутамата, ингибируя таким образом глутамат-индуцированный апоптоз. Цитиколин (Цересил® Канон) увеличивает обратный захват глутамата, снижая его синаптическую концентрацию при острой ишемии, а в фазе восстановления, наоборот, увеличивает его концентрацию, способствуя улучшению когнитивных функций [23, 25, 26].
Клиническая эффективность и переносимость цитиколина в остром и восстановительном периодах ишемического инсульта, а также при сосудистых когнитивных нарушениях изучались в ряде клинических исследований.
В 2000 г. в США было проведено крупномасштабное исследование цитиколина (ECCO) [27, 28]. В нем приняли участие 899 пациентов с умеренным и тяжелым ишемическим инсультом (> 8 баллов по NIHSS). Терапия начиналась в первые сутки инсульта и продолжалась в течение шести недель с дальнейшим наблюдением в течение еще шести недель. За конечную точку исследования было принято значительное восстановление неврологических функций (на 7 баллов и более по NIHSS) через 12 недель с момента развития инсульта. В конце лечения значительная степень восстановления определялась у 52% больных в группе цитиколина и 51% больных в группе плацебо (различия недостоверны). Однако достоверно большее число пациентов в группе цитиколина имело оценку по модифицированной шкале Рэнкина не более 1 балла (26 против 20%, р = 0,025). Кроме того, на фоне приема цитиколина отмечено существенное снижение частоты случаев нарастания симптомов инсульта по сравнению с плацебо (3 против 6%). Как показал последующий анализ, полное восстановление функций (0–1 балл по NIHSS, 0–1 балл по модифицированной шкале Рэнкина, а также индекс Бартел ≥ 95 баллов) наблюдалось у 19% пациентов, принимавших цитиколин, и только у 14% пациентов, получавших плацебо (p = 0,03). Параллельно было установлено, что применение цитиколина уменьшает объем инфаркта мозга, по данным диффузионно-взвешенной магнитно-резонансной томографии [29].
Группа ученых из Испании проанализировала эффективность перорального приема цитиколина при ишемическом инсульте на основе результатов нескольких плацебоконтролируемых исследований, в которых использовались различные дозы препарата (500, 1000 и 2000 мг/сут) [30]. В анализ было включено 789 больных, принимавших цитиколин, и 583 больных, получавших плацебо, у которых исходно был диагностирован инсульт средней или тяжелой степени (8 баллов и более по NIHSS). Значительное восстановление (регресс неврологических расстройств и снижение степени инвалидизации – 0–1 балл по шкале Рэнкина, индекс Бартел ≥ 95 баллов, уменьшение суммы баллов по NIHSS ≥ 8) в группе цитиколина отмечалось достоверно чаще, чем в группе плацебо, – 25,2 и 20,2% соответственно (р = 0,003). В большинстве случаев (27,9%) значительное восстановление наблюдалось у пациентов, принимавших препарат в дозе 2000 мг/сут. Безопасность цитиколина при пероральном употреблении не отличалась от таковой плацебо [31].
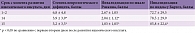
В исследовании под руководством В.А. Парфенова оценивались эффективность и безопасность применения цитиколина (внутривенное введение в течение десяти суток с дальнейшим пероральным приемом в течение 35 суток) у 24 пациентов в возрасте от 50 до 83 лет (средний возраст 68 лет), госпитализированных в первые 48 часов с момента развития ишемического инсульта. По результатам исследования у большинства (18 из 24) пациентов отмечены постепенный регресс неврологических нарушений и уменьшение степени инвалидизации (табл. 4). Исследование когнитивных функций на 14-й и 45-й день ишемического инсульта показало постепенное улучшение когнитивной сферы [31].
С целью оценки протективного действия цитиколина в отношении когнитивных нарушений был проведен ряд исследований. В плацебоконтролируемом исследовании, выполненном L. Alvarez-Sabin и соавт. в 2013 г., приняли участие 347 пожилых пациентов (средний возраст 67,2 ± 11,3 года), перенесших инсульт и имевших когнитивные нарушения. В группе активного лечения (n = 172) цитиколин назначался в дозе 2000 мг/сут внутрь в течение шести месяцев, далее по 1000 мг/сут еще в течение шести месяцев. Состояние пациентов оценивалось с помощью нейропсихологического исследования и модифицированной шкалы Рэнкина через шесть и 12 месяцев после начала лечения. На фоне длительной терапии цитиколином замедлялось прогрессирование когнитивных расстройств, прежде всего за счет улучшения внимания, управляющих функций и ориентации во времени, а также отмечалось более выраженное функциональное восстановление по сравнению с плацебо [32].
Особо следует рассмотреть результаты исследования IDEALE, посвященного оценке эффективности цитиколина в длительной терапии сосудистых умеренных когнитивных нарушений у пожилых пациентов. Пациенты с умеренными когнитивными нарушениями преимущественно сосудистого генеза в течение девяти месяцев принимали либо цитиколин в дозе 1000 мг/сут (n = 265), либо плацебо (n = 84). После этого их состояние оценивалось по краткой шкале оценки психических функций, которая показала положительную динамику на фоне лечения цитиколином (улучшение в среднем на 0,5 балла) и прогрессирование когнитивных нарушений в группе плацебо (ухудшение в среднем на 1,9 балла) (р = 0,0001). Таким образом, длительная терапия цитиколином способствовала снижению темпов прогрессирования заболевания у пациентов с сосудистыми умеренными когнитивными нарушениями [33].
В исследовании B. Chandra (1992) изучалась эффективность цитиколина у пациентов с сосудистой деменцией. Введение цитиколина в дозе 750 мг/сут внутривенно в течение двух месяцев приводило к достоверному улучшению показателей когнитивных функций по краткой шкале оценки психических функций по сравнению с плацебо. Более того, эффект от терапии сохранялся в течение десяти месяцев после окончания курса лечения [34].
В остром периоде ишемического инсульта и черепно-мозговой травмы Цересил® Канон назначается по 1000 мг каждые 12 часов с первых суток после постановки диагноза в виде внутривенной инфузии. Через три – пять дней после начала лечения, если не нарушена функция глотания, возможен переход на питьевой раствор. В восстановительном периоде ишемического и геморрагического инсультов или черепно-мозговой травмы, а также при хронических дегенеративных и сосудистых заболеваниях головного мозга препарат используется в дозе 500–2000 мг в день в виде питьевого раствора. Рекомендуемая длительность терапии составляет не менее 6–12 недель. В пожилом возрасте коррекции дозы не требуется.
Длительный опыт практического применения и данные исследований свидетельствуют о целесообразности применения в восстановительном периоде инсульта комбинации винпоцетина и пирацетама. В настоящее время на российском фармацевтическом рынке имеется готовая фиксированная комбинация указанных действующих веществ (Винпотропил®). Препарат представлен в виде двух лекарственных форм: капсулы (5 мг винпоцетина и 400 мг пирацетама) и таблетки (10 мг винпоцетина и 800 мг пирацетама). Больным в восстановительном периоде инсульта лучше назначать таблетки, в то время как капсулы подойдут для пациентов с легкими и умеренными стадиями хронического цереброваскулярного заболевания.
За счет синергического действия компонентов Винпотропил® снижает тонус микрососудов головного мозга, улучшает реологические свойства крови и кровоснабжение ишемизированных участков, усиливает метаболизм нейронов, стимулирует активность митохондрий, регулирует апоптоз, оказывает антиоксидантное и нейропротективное действие и положительно влияет на когнитивные функции. Синергическое действие винпоцетина и пирацетама может быть связано с воздействием на три сигнальных и метаболических пути: кальциевый сигнальный путь, путь регуляции дофаминергических синапсов и сигнальный путь циклического аденозинмонофосфата.
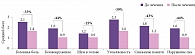
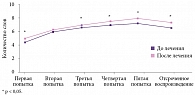
А.Н. Кузнецов и В.Д. Даминов изучили эффективность применения Винпотропила в комплексном восстановительном лечении больных, перенесших ишемический инсульт [35]. В исследование были включены 90 человек (42 женщины и 48 мужчин) в возрасте от 42 до 70 лет (средний возраст 56,2 ± 2,3 года) в раннем восстановительном периоде ишемического инсульта (с четвертой недели до полугода). Пациенты основной группы (n = 30) получали Винпотропил® 5/400 по две капсулы три раза в день на протяжении трех недель. Были сформированы три группы сравнения: в первой группе применялся винпоцетин 30 мг/сут перорально, во второй – только пирацетам 1600 мг/сут перорально, в третьей – винпоцетин 30 мг/сут и пирацетам 1600 мг/сут перорально. Одновременно всем больным проводился полномасштабный комплекс реабилитационных и восстановительных мероприятий. На фоне терапии Винпотропилом отмечался значительный регресс субъективных жалоб, в группах сравнения динамика была существенно менее выражена, и только в группе Винпотропила результаты были достоверными (рис. 2). По итогам выполнения теста «Заучивание 10 слов» у пациентов, получавших Винпотропил®, наблюдалось достоверное улучшение немедленного и отсроченного (через 60 минут) воспроизведения по сравнению с исходным уровнем (рис. 3), причем оно носило более выраженный характер по сравнению с таковым у больных, которые принимали винпоцетин или пирацетам по отдельности. Кроме того, в группе Винпотропила отмечалось существенное улучшение эмоционального состояния (снижение уровня тревоги по тесту Спилберга). Наблюдалось также статистически значимое и более выраженное улучшение показателей церебрального кровотока.
С учетом вышесказанного можно рекомендовать пациентам в восстановительном периоде ишемического инсульта принимать Винпотропил® 10/800 по одной-две таблетки два-три раза в сутки курсом от двух до шести месяцев.
Заключение
Пациентам, перенесшим ишемический инсульт, необходимо строго следовать рекомендациям по профилактике повторного ОНМК. Лечащие врачи должны грамотно и своевременно оценивать обнаруживаемые неврологические нарушения и максимально привлекать специалистов мультидисциплинарной бригады для осуществления персонализированного подхода в составлении программы реабилитационных мероприятий. Важную роль играет просветительская работа с родственниками и ухаживающими лицами. Отдельным стратегическим направлением является постоянный контроль за соблюдением медицинских назначений.
D.O. Gromova, V.V. Zakharov, MD, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Contact person: Vladimir V. Zakharov, zakharovenator@gmail.com
The article discusses the basic principles of rehabilitation of patients after ischemic stroke. Special attention is paid to the rehabilitation measures neurometabolic support, in particular the use of citicoline (Ceresil® Canon) for the stimulation neuroplasticity processes and the combination of vinpocetine and piracetam (Vinpotropil®) to improve brain blood flow and correct cognitive disorders.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.