Восемь инфузий к свободе. 4-й Конгресс Российского комитета исследователей рассеянного склероза с международным участием «Рассеянный склероз и другие демиелинизирующие заболевания». Сателлитный симпозиум компании «Санофи»
- Аннотация
- Статья
- Ссылки
23 сентября 2021 г. состоялся симпозиум «Восемь инфузий к свободе» по вопросам применения моноклональных антител в лечении рассеянного склероза. Алемтузумаб (Лемтрада®) – рекомбинантное гуманизированное моноклональное антитело, разрешенное к применению в Российской Федерации для лечения рассеянного склероза с высокоактивным течением. В рамках симпозиума ведущие эксперты из разных регионов России проанализировали эффективность алемтузумаба при рассеянном склерозе, преимущества и особенности профиля безопасности, а также поделились опытом его применения в условиях реальной клинической практики.
23 сентября 2021 г. состоялся симпозиум «Восемь инфузий к свободе» по вопросам применения моноклональных антител в лечении рассеянного склероза. Алемтузумаб (Лемтрада®) – рекомбинантное гуманизированное моноклональное антитело, разрешенное к применению в Российской Федерации для лечения рассеянного склероза с высокоактивным течением. В рамках симпозиума ведущие эксперты из разных регионов России проанализировали эффективность алемтузумаба при рассеянном склерозе, преимущества и особенности профиля безопасности, а также поделились опытом его применения в условиях реальной клинической практики.



На рубеже десятилетия: долгосрочные результаты терапии иммунной реконституции
Заведующая межокружным отделением рассеянного склероза Городской клинической больницы № 24, ассистент кафедры неврологии, нейрохирургии и медицинской генетики Российского национального исследовательского медицинского университета им. Н.И. Пирогова, д.м.н. Екатерина Валериевна ПОПОВА отметила, что сегодня для лечения рассеянного склероза применяют ряд терапевтических опций, позволяющих снизить активность заболевания и замедлить прогрессирование инвалидизации больных. В первой и второй линиях лечения рассеянного склероза применяют интерфероны (ИФН), глатирамера ацетат (ГА), терифлуномид, финголимод, диметилфумарат, натализумаб, окрелизумаб. Индукционная терапия при активном течении рассеянного склероза подразумевает использование митоксантрона с последующим переходом на поддерживающую терапию иммуномодуляторами первой линии ИФН/ГА. К терапии, направленной на иммунную реконституцию рассеянного склероза, относят препараты алемтузумаб и кладрибин.
Алемтузумаб – гуманизированное моноклональное антитело, которое селективно связывается с CD-52, белком, экспрессируемым на В- и Т-лимфоцитах. Препарат одобрен более чем в 70 странах мира, включая страны Европейского союза, США, Российскую Федерацию, для лечения пациентов с высокоактивным течением ремиттирующего рассеянного склероза (РРС)1. В июне 2016 г. он был зарегистрирован в России. Рекомендованная доза алемтузумаба – 12 мг в день в виде внутривенной капельной инфузии. Лечебный курс включает два цикла: первый – 12 мг в день в течение пяти последовательных дней, второй – 12 мг в день в течение трех последовательных дней через 12 месяцев после первого курса.
В соответствии с инструкцией и рекомендациями российских экспертов, алемтузумаб показан:
- пациентам с высокоактивным течением заболевания, несмотря на проведение полного и адекватного курса лечения как минимум одним препаратом, изменяющим течение рассеянного склероза (ПИТРС);
- наивным пациентам с быстропрогрессирующим тяжелым РРС, то есть перенесшим два инвалидизирующих обострения или более в течение года и имеющих один очаг или более по данным магнитно-резонансной томографии (МРТ) головного мозга;
- пациентам с высокоактивным РРС и высоким риском развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) после завершения двух полных лет терапии натализумабом2.
Основанием для регистрации алемтузумаба послужили завершенные клинические исследования III фазы (CARE-MS I и CARE-MS II), в которых он продемонстрировал эффективность в отношении высокоактивного рассеянного склероза с преобладающим воспалительным компонентом. Были также проведены постмаркетинговые наблюдения пациентов с рассеянным склерозом, позволившие проанализировать контингент больных, которым требуются повторные инфузии алемтузумаба. Так, в расширенном исследовании TOPAZ выполнен ретроспективный анализ данных пациентов из исследований CARE-MS I и CARE-MS II для оценки эффективности и безопасности алемтузумаба на фоне высокоактивного течения рассеянного склероза за девять лет наблюдения.
Высокоактивный рассеянный склероз характеризуется наличием двух или более обострений в течение одного года перед началом исследования и выявлением одного или более контрастируемого очага или увеличением количества очагов по данным МРТ головного и/или спинного мозга. Кроме того, рассеянный склероз высокой активности определяется в зависимости от частоты обострений, очагов по данным МРТ и результатов эффективности предшествующей терапии ПИТРС (новые и/или увеличенные в размере очаги, отсутствие эффекта от проводимой терапии).
Итак, в исследованиях CARE-MS I и CARE-MS II сравнивали эффективность и безопасность алемтузумаба и подкожного интерферона-бета-1a у пациентов с рассеянным склерозом высокой активности. В проведенном ретроспективном исследовании проанализированы данные пациентов, которые в течение двух лет получали алемтузумаб, и пациентов, получавших ИФН-бета-1a, с дополнительным семилетним наблюдением за пациентами из группы алемтузумаба.
Результаты исследования субпопуляции пациентов с высокоактивным течением рассеянного склероза показали, что на фоне алемтузумаба снижается средняя частота обострений и достоверно уменьшается риск прогрессирования инвалидизации по расширенной шкале оценки степени инвалидизации (Expanded Disаbility Status Scale, EDSS) по сравнению с ИФН-бета-1а3.
По словам эксперта, положительная динамика по EDSS в группе больных, получавших алемтузумаб, свидетельствует об уменьшении степени выраженности неврологического дефицита. Важно, что уменьшение EDSS даже на один балл означает улучшение состояния или стабилизацию процесса. При своевременном начале терапии большинство пациентов с рассеянным склерозом способны передвигаться самостоятельно и могут иметь минимальный неврологический дефицит.
В настоящее время используется один из новых критериев эффективности терапии – подтвержденное уменьшение инвалидизации (confirmed disability improvement, CDI) – показатель, оценивающий способность ПИТРС обратить исходную инвалидизацию. Определение CDI требует повторных подтверждений балла EDSS, поэтому данный показатель устойчив к временным колебаниям, влияющим на точность однократной оценки, и фиксирует уменьшение инвалидизации достаточной величины и стойкости, которое может расцениваться как значимое изменение. При этом оцениваются исходные значения балла EDSS – два и более.
В исследованиях CARE-MS I и CARE-MS II в группе алемтузумаба к концу девятого года наблюдения у 50% пациентов с высокоактивным течением рассеянного склероза отмечались подтвержденное уменьшение инвалидизации и регресс неврологического дефицита. На фоне и после лечения алемтузумабом пациенты сохраняли стабильное состояние. Это очень важно для больных рассеянным склерозом, поскольку существенно повышаются их качество жизни и социальная активность.
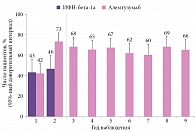
Кроме того, данные МРТ с контрастным усилением показали достоверное снижение активности заболевания на фоне терапии алемтузумабом у пациентов с высокоактивным течением рассеянного склероза (рис. 1).
Положительный эффект от терапии алемтузумабом (снижение средней частоты обострений, отсутствие активности по данным МРТ) сохранялся не только во время проведения основных исследований, но и на протяжении последующего девятилетнего периода наблюдения. В клинических исследованиях используют показатель NEDA-3 – критерий отсутствия активности рассеянного склероза, оцененный по трем показателям (отсутствие прогрессирования по EDSS, МРТ-активности и обострений). Зафиксировано увеличение годичной оценки NEDA-3 в группе пациентов, получавших алемтузумаб, что подтверждает высокую эффективность препарата при агрессивном течении рассеянного склероза.
На фоне терапии алемтузумабом снижение скорости атрофии мозга более значимое, чем при использовании высокодозного ИФН-бета-1а.
В рамках ретроспективного анализа оценивали долгосрочные результаты, в частности частоту проведения дополнительных курсов терапии алемтузумабом. В конце девятого года наблюдения доля пациентов, не получавших дополнительных введений алемтузумаба и других ПИТРС, в расширенных исследованиях составила 50%. Определенным группам пациентов потребовались дополнительные курсы лечения алемтузумабом. По мнению исследователей, к назначению последующих курсов терапии нужно подходить индивидуально, оценивать все за и против. В отсутствие противопоказаний допустимо назначение алемтузумаба в дальнейшем в целях достижения устойчивого снижения признаков активности рассеянного склероза.
В заключение Е.В. Попова представила клинический случай пациентки с рассеянным склерозом.
Пациентка С. 1968 года рождения, с дебютом оптического неврита в 1984 г. В течение длительного периода состояние оставалось стабильным. В 2006 г. случилось второе обострение, отмечались вестибулярные нарушения, скованность в ногах. На МРТ головного мозга – многоочаговые изменения. Установлен диагноз РРС, EDSS – 1,5 балла. Пациентке назначили терапию ГА. На фоне терапии наблюдались частые обострения, в связи с чем проводилась гормональная пульс-терапия. В 2009 г. по EDSS – 3 балла. В результате остаточного неврологического дефицита в ходе обострения больную перевели на высокодозный ИФН-бета-1а в дозе 44 мкг. Частота обострений снизилась. Проводилась гормональная пульс-терапия. В декабре 2011 г. EDSS составил 4,5 балла. После проведения МРТ было принято решение о смене терапии. Пациентке назначили натализумаб. Терапия натализумабом продолжалась в течение года. После этого пациентка вернулась на терапию ГА. После двух обострений на фоне лечения, купированных гормональной пульс-терапией, больную перевели на терапию финголимодом. На фоне такой терапии сохранялась стабильность состояния, клиническая и МРТ-активность отсутствовали в течение полутора лет. С 2015 по 2017 г. отмечалась реактивация заболевания на фоне применения финголимода, случались обострения. Поскольку тогда в России уже был зарегистрирован алемтузумаб, было принято решение о его назначении.
Перед назначением алемтузумаба следует соблюдать клинические рекомендации по подготовке к терапии и наблюдению за пациентами с рассеянным склерозом. Прежде всего необходим мониторинг клинического состояния пациента, включающий полный неврологический осмотр, клинический и биохимический анализы крови, коагулограмму, определение антител к ВИЧ, гепатитам B и C, исследования функции щитовидной железы, рентгенографию органов грудной клетки, диаскинтест, МРТ головного мозга с контрастированием. Кроме того, пациентам проводят профилактику герпетической инфекции, листериоза. Пациенты должны обладать иммунитетом к вирусу ветряной оспы. В первый день каждого курса алемтузумаба проводят тест на беременность пациенткам детородного возраста.
В процессе терапии препаратом алемтузумаб также осуществляют ежемесячный мониторинг (общий анализ крови с тромбоцитами, уровень креатинина сыворотки, общий анализ мочи с микроскопией, функция печени) с предоставлением результатов непосредственно лечащему врачу. Первый осмотр в центре рассеянного склероза проводят через четыре недели после инфузии. Далее обследуют пациентов каждые три месяца.
В июне 2017 г. пациентке после предварительного периода вымывания предыдущего ПИТРС был проведен первый курс терапии алемтузумабом. Отмечалась положительная динамика лабораторных показателей в течение года после первого курса терапии. По данным МРТ, через год после первого курса алемтузумаба наступила стабилизация очагового процесса, активности рассеянного склероза не зафиксировано. Балл по EDSS снизился с 3,5 до 2.
В 2018 г. пациентка прошла второй курс терапии алемтузумабом. Положительная тенденция к нормализации биохимических показателей крови на фоне приема препарата сохранялась. При мониторинге уровня гормонов щитовидной железы каких-либо отклонений от нормы не выявлено.
Пациентка по настоящее время находится под наблюдением. В течение четырех лет отсутствуют признаки обострения, прогрессирования и активности заболевания по данным МРТ. Сохраняется высокий уровень качества жизни, что подтверждает устойчивое длительное позитивное влияние короткого курса терапии алемтузумабом на течение рассеянного склероза.
Таким образом, при соблюдении четких показаний к применению и осуществлении мониторинга состояния пациента терапия алемтузумабом является эффективным инструментом контроля над активностью и прогрессированием рассеянного склероза.
Экспертные подходы к выбору моноклональных антител при рассеянном склерозе
Как отметила руководитель Республиканского центра рассеянного склероза (г. Уфа), профессор кафедры неврологии с курсами нейрохирургии и медицинской генетики Башкирского государственного медицинского университета, д.м.н. Клара Закиевна БАХТИЯРОВА, на сегодняшний день в России, в соответствии с федеральной программой, для терапии высокоактивного и быстропрогрессирующего рассеянного склероза доступны препараты моноклональных антител натализумаб, алемтузумаб и окрелизумаб.
Как известно, на основании критериев высокой активности рассеянного склероза выделяют пациентов, получающих ПИТРС, резистентных к ним, а также с ранее не леченным быстропрогрессирующим рассеянным склерозом. Быстропрогрессирующий рассеянный склероз характеризуется двумя обострениями и более, приведшими к нарастанию неврологического дефицита на один балл и более по EDSS, и выявлением одного или более контрастируемого гипоинтенсивного очага (режим Т1) или значительным увеличением объема поражения в режиме Т2 по сравнению с предыдущими данными МРТ головного мозга2.
В настоящее время в терапии рассеянного склероза активно используются моноклональные антитела, направленные на специфические антигены. Алемтузумаб селективно разрушает циркулирующие Т- и В-лимфоциты, при этом число клеток системы врожденного иммунитета (первая линия защиты от инфекций) практически не изменяется. Процесс репопуляции Т- и В-клеток начинается в течение нескольких недель после введения алемтузумаба, что ведет к восстановлению равновесия в иммунной системе.
Изучение механизма действия алемтузумаба продолжается. Исследователи полагают, что фармакодинамические изменения после введения алемтузумаба могут объяснить эффекты препарата у пациентов с рассеянным склерозом4, 5.
Согласно результатам исследования CARE-MS I, в течение месяца после первой инфузии алемтузумаба среднее число циркулирующих В- и Т-лимфоцитов снижается, минимальные значения отмечаются через месяц после курса лечения, затем их количество восстанавливается в течение года. После каждого курса терапии алемтузумабом начинается процесс репопуляции лимфоцитов. Эти данные подтверждаются наблюдениями в реальной практике при ведении пациентов с рассеянным склерозом после терапии алемтузумабом6.
Среднее количество В-клеток достигает исходного и нормальных значений через три месяца после введения алемтузумаба. CD4 и CD8 Т-клетки восстанавливаются после каждого цикла терапии, но медленнее, чем В-клеточная репопуляция. Значение CD4-клеток достигает нижней границы нормы через 12 месяцев после лечения. Восстановление CD8-клеток до нижней границы нормы происходит примерно через девять месяцев после введения алемтузумаба.
Многоцентровое исследование рутинной практики PROGRAM позволило оценить эффективность и безопасность переключения пациентов на алемтузумаб после предыдущей терапии ПИТРС. В проспективном исследовании проанализированы данные 170 пациентов. Среди них были наивные пациенты и получавшие ранее терапию ПИТРС в течение шести и более месяцев (ИФН, диметилфумарат, натализумаб, финголимод). Из них 108 пациентов с высокоактивным рассеянным склерозом и неэффективным лечением ПИТРС и 21 пациент, стабильный на натализумабе, но с повышенным риском развития ПМЛ. Инфузии алемтузумаба проводились в третичных центрах исследования в Германии7.
В исследовании изучили исходные характеристики пациентов, а также безопасность и эффективность терапии, в том числе период до первого рецидива, время до подтвержденного ухудшения инвалидности и развития вторичных аутоиммунных нежелательных явлений.
Анализ исходных характеристик пациентов и анатомической локализации обострений показал, что, по данным МРТ головного и спинного мозга, в 55% случаев у пациентов присутствовали спинальные очаги, обусловливающие более неблагоприятное течение обострений. Кроме того, у большинства больных выявлялись поражения, локализованные в полушариях головного мозга или зрительных нервах.
В группах пациентов, применявших алемтузумаб, достоверного увеличения степени инвалидизации не зарегистрировано. Подтвержденное усиление инвалидизации было менее характерно для пациентов из групп, переведенных на алемтузумаб. Речь идет о больных, не получивших терапию ПИТРС (наивные пациенты), находившихся на первой линии ПИТРС, стабильных пациентах на натализумабе с повышенным риском развития ПМЛ. Более благоприятные результаты в отношении развития вторичных аутоиммунных нежелательных явлений демонстрировали пациенты из тех же групп, которые были переведены на алемтузумаб.
Результаты исследования продемонстрировали, что применение алемтузумаба на ранних стадиях рассеянного склероза в первой и второй линии терапии ассоциируется с лучшими результатами лечения в отношении снижения риска обострений и прогрессирования инвалидизации. На фоне алемтузумаба риск развития вторичных аутоиммунных осложнений меньше, чем при использовании других ПИТРС.
Авторы другого многоцентрового проспективного исследования попытались ответить на вопрос, может ли лимфоцитарный профиль крови до начала лечения алемтузумабом помочь выявить больных с повышенным риском развития аутоиммунных нежелательных явлений. Исследователи установили, что пациенты с высоким процентом CD19+ В-клеток или плазмобластов до лечения алемтузумабом имеют более высокий риск развития аутоиммунных нежелательных явлений8.
Профессор К.З. Бахтиярова акцентировала внимание на проблеме заболеваемости и лечения COVID-19 у пациентов с рассеянным склерозом.
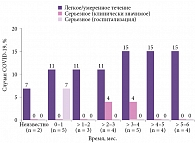
В исследовании проанализированы данные 273 пациентов, которые на фоне терапии алемтузумабом заболели коронавирусной инфекцией. Подтвержденный диагноз COVID-19 зарегистрирован у 117 (43%) пациентов, подозрение на COVID-19 – у 156 (57%). Среди подтвержденных случаев заболевания коронавирусной инфекцией умеренное/легкое течение отмечалось у 77 (28%) больных, более тяжелое – у 40 (15%). Из них госпитализация потребовалась 10% пациентов.
Анализ исходов COVID-19 у пациентов, получавших инфузии алемтузумаба, показал выздоровление в большинстве случаев (56%). При этом в старших возрастных группах пациентов с рассеянным склерозом и коморбидной патологией риск тяжелого течения COVID-19 и летального исхода значительно выше. Тяжесть течения коронавирусной инфекции была более выражена у пациентов, получавших инфузии алемтузумаба менее двух месяцев назад. У больных, применявших инфузии алемтузумаба свыше трех-четырех месяцев назад, течение коронавирусной инфекции было легким и умеренным (рис. 2).
По словам лектора, в Республиканском центре рассеянного склероза в данный момент 24 пациента с рассеянным склерозом получают терапию алемтузумабом. Средний возраст пациентов на начало терапии – 31,42 года. Медиана длительности заболевания составила 5,8 года, продолжительности лечения предыдущими ПИТРС – шесть лет. Средняя продолжительность наблюдения составила 8,4 месяца. Шесть человек получили два курса алемтузумаба. Показатели среднегодовой частоты обострений до назначения препарата алемтузумаб у пациентов, получавших ПИТРС, составили 2,1. У ранее не леченных пациентов в среднем было три обострения. На фоне терапии алемтузумабом не зарегистрировано ни одного обострения.
По данным МРТ, из шести больных только у одного к второму курсу терапии выявлен гипоинтенсивный очаг, накапливающий контрастный препарат в режиме Т1. Исходно пациент имел более 30 активных патологических очагов различной локализации. Нормального уровня лимфоциты достигли примерно к десятому месяцу после введения алемтузумаба у 90% пациентов. К 12-му месяцу лечения уровень лимфоцитов достиг нижней границы нормы у 10% пациентов.
В рамках наблюдения оценивали профиль безопасности алемтузумаба. Так, нарушения функции щитовидной железы отмечались в одном случае. Зафиксировано снижение уровня тиреотропного гормона (ТТГ) через год после первого курса приема алемтузумаба, пациент получил консультацию эндокринолога. Показатели уровня ТТГ после второго курса в норме.
Среди пациентов, получавших алемтузумаб, также были случаи заражения COVID-19.
Мужчина 1999 года рождения, страдает РРС с 2009 г., EDSS – 2,5 балла. Заболел COVID-19 через десять месяцев после первой инфузии алемтузумаба. Течение коронавирусной инфекции было средней степени тяжести. По данным компьютерной томографии, поражение легких – 12%. Получал лечение в условиях стационара. Исход: выздоровление. Второй курс алемтузумаба проведен через 12 месяцев.
Мужчина 1989 года рождения, диагноз РРС с 2016 г. Заболел коронавирусной инфекцией через три месяца после второй инфузии алемтузумаба. Течение инфекционного заболевания было легким, получал лечение на дому. Исход: выздоровление.
Итак, в сложный период пандемии особенно важен взвешенный и безопасный подход к назначению эффективной терапии высокоактивного и быстропрогрессирующего рассеянного склероза. Влияние различных ПИТРС на тяжесть течения COVID-19 у пациентов с рассеянным склерозом требует дальнейшего изучения.
Подводя итог, профессор К.З. Бахтиярова подчеркнула, что имеющиеся на сегодняшний день результаты клинических испытаний алемтузумаба и данные реальной практики свидетельствуют о том, что препарат снижает частоту обострений и замедляет прогрессирование инвалидизации у пациентов с РРС.
Лучшие практики ведения пациентов с рассеянным склерозом: мировой и российский опыт
Руководитель центра рассеянного склероза МСЧ «Нефтяник» (г. Тюмень), д.м.н., профессор Стелла Анатольевна СИВЕРЦЕВА подчеркнула, что ключевой задачей при выборе терапии, модулирующей течение рассеянного склероза, в настоящее время считается эффективное управление рисками. Назначение терапии с использованием новых иммуномодулирующих препаратов, относящихся к моноклональным антителам, прежде всего подразумевает правильный отбор пациентов. Необходимо выбрать тот препарат, который будет наиболее эффективен у конкретного больного, и своевременно менять терапию при ее неэффективности. Кроме того, перед началом терапии следует обучать и информировать пациентов о целях лечения и потенциальных нежелательных явлениях. Следует помнить, что повышение мотивации и приверженности пациента лечению – одна из основных составляющих эффективной терапии. В настоящее время разработаны памятки и руководства для пациентов и специалистов, в которых четко определена вероятность возникновения нежелательных явлений на фоне терапии.
Алемтузумаб рекомендован для монотерапии пациентов с высокоактивным течением РРС. При раннем выявлении и соблюдении мониторинга безопасности риск развития нежелательных реакций на фоне терапии алемтузумабом хорошо изучен и управляем. Согласно плану управления риском, подготовка и проведение инфузии алемтузумаба должны осуществляться в специализированном неврологическом отделении стационара под контролем и наблюдением специально обученного медицинского персонала. Важным аспектом ведения пациента, получающего терапию алемтузумабом, является профилактика и симптоматическое лечение оппортунистических заболеваний, а также постоянный мониторинг безопасности. Неблагоприятные исходы лечения можно предотвратить за счет раннего выявления и последующего своевременного купирования побочных эффектов.
Еще одно не менее важное условие – тестирование пациентов на антитела к вирусу ветряной оспы до начала курса лечения алемтузумабом. В отсутствие антител к вирусу ветряной оспы пациентам проводят вакцинацию против инфекции, вызванной вирусом Varicella zoster. Чтобы эффект вакцинации проявился полностью, лечение препаратом алемтузумаб назначают не ранее чем через шесть недель после вакцинации.
К решению вопроса о вакцинации пациентов с рассеянным склерозом от COVID-19 необходимо подходить строго индивидуально, с учетом коморбидных заболеваний, риска развития осложнений. Терапию алемтузумабом можно начинать не ранее чем через четыре недели после введения последней дозы вакцины от коронавирусной инфекции. Вакцинацию следует проводить спустя шесть и более месяцев после лечебного курса алемтузумаба. При этом необходимо учитывать, что иммунный ответ на вакцину может быть снижен. Начало следующего курса алемтузумаба возможно не ранее чем через четыре недели после введения последней дозы вакцины9.
В связи с высокой частотой развития герпетической инфекции в период после инфузии алемтузумаба рекомендуется профилактический прием ацикловира в дни инфузии и в течение 28 дней после нее. Как показывают данные исследований, частота герпетической инфекции в первый месяц после каждого курса алемтузумаба ниже у пациентов, получавших профилактику ацикловиром6.
На фоне терапии моноклональными антителами повышается риск развития оппортунистических инфекций. Необходимо предупредить пациента, что в случае сохранения у него температуры тела выше субфебрильных цифр (выше 37,1 ºС) в течение 24 часов после последней инфузии, увеличения лимфатических узлов, появления симптомов тошноты, рвоты, непроходящей головной боли или какого-либо другого изменения состояния он должен незамедлительно сообщить об этом лечащему врачу. Сохранение указанных симптомов свыше 24 часов после последней инфузии может быть признаком развития оппортунистической инфекции, протекающей атипично.
В данном аспекте крайне важна профилактика листериоза, который может привести к тяжелым осложнениям или летальному исходу больных рассеянным склерозом. Необходимо информировать пациентов и их родственников, что для снижения риска развития листериоза больные, получающие алемтузумаб, должны избегать употребления в пищу недостаточно термически обработанного мяса, морепродуктов, паштетов, мясных, рыбных деликатесов, сыров мягких сортов и непастеризованной молочной продукции две недели до, во время и в течение месяца после лечения.
Данные клинических исследований свидетельствуют о вероятности развития аллергических и неаллергических реакций у пациентов, получающих инфузии алемтузумаба. Механизм гиперчувствительности связан с особенностью взаимодействия моноклональных антител с иммунной системой и развитием иммуноопосредованных реакций. Моноклональные антитела – специфические иммуноглобулин Е-антитела, которые генерируются уже при первом введении алемтузумаба, распознаются во время последующих курсов и вызывают провоспалительный ответ10.
К клиническим симптомам реакции гиперчувствительности относят кожные проявления (90% случаев), ангионевротический отек, гиперемию. Важными признаками являются респираторные симптомы и гипотензия. Чаще эти симптомы развиваются в течение 24 часов после инфузии или в первые часы ее проведения. Однако описана реакция гиперчувствительности замедленного типа и в течение 7–10 дней после инфузии. Поэтому необходимо наблюдать за пациентом в течение десяти дней после начала терапии алемтузумабом.
Кроме того, не исключены неиммуноопосредованные реакции, возникающие во время или вскоре после введения моноклональных антител. Наиболее распространенные из них головная боль, тошнота, головокружение, усталость, покраснение лица, потливость, сыпь, гипотония и зуд. В исследованиях большинство реакций на введение алемтузумаба ассоциировалось с синдромом высвобождения цитокинов.
В рамках проведенных клинических исследований и реальной практике на фоне терапии алемтузумабом встречаются определенные риски в виде инфузионных реакций, в частности любое нежелательное явление, возникающее во время или в течение 24 часов после инфузии алемтузумаба. Инфузионные реакции наблюдаются у 45–90% пациентов, как правило легкой или средней степени тяжести: головная боль, тошнота, лихорадка, озноб, приливы, крапивница, зуд, сыпь. Для предупреждения инфузионных реакций разработан план управления инфузиями, включающий обучение пациента, осмотр пациента и премедикацию (антигистаминные препараты, антипиретики, метилпреднизолон) до начала инфузии. Длительность инфузии должна составлять четыре часа. При необходимости корректируют скорость инфузии и/или проводят симптоматическое лечение. По окончании инфузии алемтузумаба в течение двух часов наблюдают за пациентом, при необходимости назначают симптоматическую терапию.
Опубликованы данные многоцентрового исследования IV фазы EMERALD по оценке алгоритма профилактики и лечения инфузионных реакций у пациентов с РРС, получавших алемтузумаб. В ходе исследования пациентам назначали комплексную схему, направленную на предотвращение и/или коррекцию инфузионных реакций, обусловленных алемтузумабом: антигистаминные препараты, ингибиторы протонной помпы за день, час до и после инфузии алемтузумаба. Метилпреднизолон назначали за день, час до (внутривенно) и после инфузии при необходимости. Противорвотные средства и физиологический раствор вводили по мере необходимости во время и после инфузии11.
Согласно результатам исследования, для двух периодов (первый и второй курсы) большинство инфузионных реакций отмечалось на протяжении шести часов после начала инфузии алемтузумаба с пиком в течение первых двух часов. Типы инфузионных реакций и их частота в целом были сопоставимы с таковыми в клинических исследованиях CARE-MS I/II. Единственными нежелательными явлениями, отличавшимися по частоте в исследовании EMERALD, были бессонница и сыпь. Бессонница в исследовании EMERALD наблюдалась почти в два раза реже, чем в клинических исследованиях CARE-MS I/II. Cыпь и аллергические реакции в исследовании CARE-MS II отмечались чаще, чем в исследовании EMERALD. Частота практически всех инфузионных реакций уменьшалась при введении второго курса алемтузумаба.
Докладчик еще раз подчеркнула важность обучения и информирования пациентов с рассеянным склерозом для профилактики развития серьезных нежелательных явлений на фоне терапии моноклональными антителами, таких как иммунная тромбоцитопеническая пурпура, нефропатии, аутоиммунный гепатит, заболевания щитовидной железы. Пациент должен сохранять бдительность в отношении симптомов возможных аутоиммунных заболеваний и при любом подозрении на них немедленно обращаться за медицинской помощью.
Рекомендовано наблюдение за пациентами, получающими лечение алемтузумабом, в течение 48 месяцев после последнего курса препарата. Обязателен также мониторинг содержания лимфоцитов, уровня ферментов печени, гормонов щитовидной железы.
Завершая выступление, профессор С.А. Сиверцева рассказала об интересном открытом многоцентровом исследовании с участием 60 пациентов с рассеянным склерозом из Москвы, Уфы и Тюмени. Из них 49 пациентов получили инфузии алемтузумаба без музыкальной терапии, а 11 – лечение алемтузумабом на фоне музыкальной терапии.
Первый курс терапии алемтузумабом был проведен в мае 2019 г. Длительность музыкальной терапии во время инфузий составила 30 часов. В группе больных, получавших лечение на фоне классической музыки, инфузионных реакций не наблюдалось. Кроме того, в группе музыкальной терапии частота развития аллергических реакций на инфузии алемтузумаба была меньше, чем в группе сравнения.
Таким образом, безопасность лечения в каждом конкретном случае становится важным фактором при выборе ПИТРС. Современные подходы к терапии РРС предусматривают реализацию программы мониторинга безопасности алемтузумаба, включающую обучение пациентов и управление рисками.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.