Восстановление либидо у пациентов со стриктурами уретры
- Аннотация
- Статья
- Ссылки
Надо полагать, что главной причиной нарушения либидо у данного контингента больных является андрогенная недостаточность, связанная со сниженной концентрацией тестостерона в крови и обусловленная уменьшением интенсивности синтеза этого гормона клетками Лейдига или снижением общего количества данных клеток в тестикулах (3, 4, 5).
Снижение объема функционирующей тестикулярной ткани у пациентов со стриктурами уретры может быть связано с различными причинами токсического действия на клетки Лейдига. В частности, многократно проводимая медикаментозная терапия после травмы и в период реконструктивных оперативных вмешательств на уретре антигистаминными, антибактериальными препаратами, в том числе сульфаниламидами, а также нестероидными противовоспалительными средствами и др., может угнетать синтез тестостерона (1, 3, 5). Наличие инфекционно-воспалительного процесса в яичках может негативно воздействовать на секрецию тестостерона (2, 3, 6). К снижению синтеза тестостерона могут приводить ятрогенные воздействия, рентгенологическое облучение, получаемое пациентами при проведении диагностических микционной и восходящей уретрографий (3, 5).
Кроме того, утрата либидо может иметь психогенный характер, обусловленный травмой и реконструктивными оперативными вмешательствами (7).
Материалы и методы
Нами были обследованы 82 пациента со стриктурами уретры и нарушенным либидо в возрасте от 17 до 50 лет. Для оценки нарушения либидо и уровня тестостерона проведено тщательное обследование этих пациентов, включающее жалобы, сбор анамнеза, физикальное обследование, лабораторную диагностику, сонографические исследования, функциональные тесты, заполнение специальных адаптированных опросников оценки андрогенодефицита. Установление правильного диагноза с учетом жалоб больного, объективных данных и клинико-биохимических исследований (определение тестостерона) может оказаться затруднительным, поскольку иногда уровень тестостерона близок к норме. При определении причины снижения или отсутствия либидо, связанной с дефицитом тестостерона, достоверным и доступным биохимическим критерием является уровень общего тестостерона. Поэтому с целью уточнения генеза нарушения либидо всем пациентам были проведены исследования общего тестостерона.
Согласно европейским стандартам диапазон сывороточного уровня общего тестостерона в норме составляет 12 нмоль/л и выше. В зависимости от используемых в лабораториях методик имеются незначительные отклонения от этого диапазона. Однако уровень гормона ниже 12 нмоль/л расценивается как андрогенная недостаточность, диапазон от 8-12 нмоль/л является серой зоной. Кроме того, исследовался уровень свободного тестостерона, но достоверных различий при сравнительном анализе с уровнем общего тестостерона не выявлено, поэтому данные концентрации свободного тестостерона в работе не приведены.
Результаты
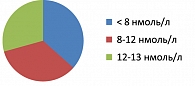
Анализ полученных результатов выявил, что среди пациентов с нарушенным либидо, имевших лабораторные признаки гипогонадизма, у 36,6% пациентов уровень плазменного тестостерона определялся до 8 нмоль/л, у 34,1% – от 8 до 12 нмоль/л, у 29,3% – на уровне нижней границы нормы (рисунок 1).
Для более тщательного уточнения генеза снижения или отсутствия либидо у пациентов со стриктурами уретры изучали анамнез заболевания: длительность болезни, количество ранее перенесенных операций и наличие в анамнезе воспалительных заболеваний репродуктивных органов. 31,7% пациентов в анамнезе отмечали эпидидимоорхиты, в том числе у 4,8% были проведены односторонние орхэктомии. У 25,6% обследованных выявлена односторонняя или двусторонняя гипотрофия яичек различной степени выраженности на фоне склероза паренхимы яичек, что существенно снижало синтез тестостерона клетками Лейдига. Так, у пациентов, ранее перенесших воспалительные заболевания органов мошонки, в 25,6% случаев уровень тестостерона был ниже 8 нмоль/л, от 8 до 12 нмоль/л регистрировали у 6,1% больных.
У пациентов без воспалительных заболеваний органов мошонки в анамнезе уровень тестостерона < 8нмоль/л выявляли достоверно реже (p < 0,05) – лишь в 11,0% случаев. Серую зону регистрировали у 28,0% пациентов, а > 12 нмоль/л – у 29,3% больных.
Нами установлена зависимость снижения тестостерона от количества реконструктивных оперативных вмешательств на уретре, а также длительности заболевания.
При сравнении уровня тестостерона в зависимости от длительности заболевания показатели ниже нормы, в основном регистрировали у больных с травмами и стриктурами уретры, страдающих данной патологией от 4 лет и более. Нормативные показатели (> 12 нмоль/л) чаще выявляли у пациентов с продолжительностью заболевания до двух лет.
Уровень тестостерона также зависел от количества перенесенных операций. У больных без оперативных вмешательств нормативные показатели определяли достоверно чаще (p < 0,05), чем в других группах обследуемых. Показатели ниже 8 ммоль/л практически, как правило, регистрировали у пациентов, перенесших три и более операций.
Как показали наши исследования, на уровень тестостерона не влияет сама травма или оперативное вмешательство, а влияет длительность заболевания, количество оперативных вмешательств на уретре, различные инфекционно-воспалительные заболевания мочевых путей и репродуктивных органов, нарушающие гемодинамику яичек и снижающие активность тестикулярной ткани.
Воспалительные процессы в ткани яичек или воздействие на тестикулярную ткань токсических факторов приводят к снижению функциональной активности клеток Лейдига, следовательно, уменьшается уровень тестостерона в крови, что приводит к развитию вторичного гипогонадизма и нарушению либидо.
Кроме того, у пациентов со сниженным либидо, обусловленным низким уровнем тестостерона крови, выявлена зависимость между количественным и качественным снижением клеток Лейдига в тестикулярной ткани. Эти изменения находятся в прямой зависимости от уровня тестостерона. Это подтверждено морфологическим изучением биоптатов яичек пациентов с признаками андрогенной недостаточности, обследованных по поводу нарушения фертильности.
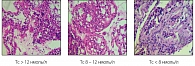
В биоптатах тестикулярной ткани пациентов с нормальным уровнем тестостерона или с уровнем тестостерона, соответствующим нижней границе нормы, эти проявления были незначительными. При исследовании биоптатов ткани яичек пациентов, у которых показатели тестостерона соответствовали серой зоне или были ниже 8 нмоль/л, обнаружены более выраженные морфологические изменения в ткани яичек, что, без сомнения, усугубляло тестикулярную недостаточность. Морфологическое исследование биоптатов тестикулярной ткани у пациентов со стриктурами уретры и признаками андрогенной недостаточности с нормальным уровнем тестостерона, но соответствующим нижней границе нормы, выявило заполнение семенных канальцев белковыми массами и слущенными клетками. Кроме того, отмечено снижение зрелых клеток Лейдига, уменьшение в интерстициальной ткани макрофагов и лимфоцитов, имеется тенденция к замещению их фибропластами. В ткани выявлено утолщение базальных мембран клеток, незначительное нарушение сосудистой сети, отмечен очаговый фиброз. При морфологическом исследовании биоптатов (показатели тестостерона соответствовали серой зоне) выявлено снижение количества клеток Лейдига (зрелые и незрелые), умеренное снижение количества макрофагов и лимфоцитов и обнаружен очаговый умеренный фиброз ткани. При сонографическом исследовании тестикул данной группы больных отмечались очаговые фиброзные изменения в паренхиме яичек.
При исследовании биоптатов яичек пациентов со стриктурами уретры и признаками андрогенной недостаточности (уровень тестостерона ниже 8 нмоль/л) отмечены диффузные склеротические изменения в паренхиме ткани или признаки гипотрофии яичек. Выявлено резкое снижение клеток Лейдига, рубцовая деформация интерстициальной ткани, воспалительная инфильтрация. Отмечалась деформация канальцев с нарушением типичного дольчатого строения яичка (рисунок 2).
Снижение или отсутствие у данного контингента больных в биоптатах яичек клеток Лейдига, выраженные признаки андрогенной недостаточности, снижение уровня тестостерона диктуют необходимость назначения этим больным патогенетической терапии. Существует два подхода к патогенетической терапии андрогенной недостаточности: проведение стимулирующей терапии, направленной на усиление синтеза эндогенного тестостерона, при сохраненной гормональной функции яичек, и проведение заместительной терапии экзогенными андрогенами у пациентов с отсутствием резервной функции тестикул.
Важным вопросом является выбор терапии, цель которой – стимуляция сперматогенеза и синтеза эндогенного тестостерона, в случае сохранения такой способности тестикулами, с поддержанием его уровня близким к нормальным показателям, что клинически проявляется уменьшением симптомов андрогенной недостаточности.
Исходя из этого, нами был сделан вывод, что пациентам с нарушениями либидо, обусловленными андрогенной недостаточностью на фоне травм и стриктур уретры, при сохранении резервных репродуктивных и гормональных возможностей тестикул, с уровнем тестостерона, соответствующим нижней границе нормативных показателей, необходимо проводить стимулирующую терапию, направленную на синтез эндогенного тестостерона. С этой целью были использованы сверхмалые дозы антител к эндотелиальной NO-синтетазе (Импаза).
28 пациентов с нормальным уровнем общего тестостерона или его уровнем, соответствующим нижней границе нормы, и сниженным либидо получали сверхмалые дозы антител к эндотелиальной NO-синтетазе сублингвально по 1 таблетке, частота приема – через день, длительность приема – 6 месяцев.
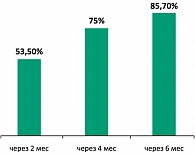
При терапии Импазой наступало прогрессирующее увеличение сексуального желания. Через 2 месяца после начала терапии у 15 (53,5%) пациентов отмечено увеличение либидо, через 4 месяца – повышение сексуального желания у 21 (75%) пациента, через 6 месяцев – улучшение либидо регистрировали у 24 (85,7 %) обследуемых.
Кроме того, у большинства обследуемых пациентов наблюдалось улучшение настроения – в 89,2% случаев, работоспособности – в 75,0% случаев.
Преимуществами сверхмалых доз антител к эндотелиальной NO-синтетазе (импазы) являются: достаточная эффективность, возрастающая при длительном курсовом применении, отсутствие побочных эффектов, возможность сочетания с другими препаратами (8).
Кроме улучшения либидо у пациентов с травмой и стриктурой уретры, получавших Импазу, отмечено повышение концентрации тестостерона по сравнению с исходным уровнем.
Через 6 месяцев после перорального приема Импазы уровень сывороточного тестостерона увеличился на 3-4 единицы у 50,0% больных и практически у всех соответствовал > 12 нмоль/л.
Выводы
У пациентов с травмами и стриктурами уретры отмечается андрогенная недостаточность, наиболее выраженная у больных с длительным анамнезом стриктурной болезни, с хронической инфекцией мочевых путей и репродуктивных органов, которые имели неоднократные рецидивы после реконструктивных операций на уретре.
У большинства пациентов с андрогенной недостаточностью на фоне стриктурной болезни курсовая патогенетическая терапия сверхмалыми дозами антител к эндотелиальной NO-синтетазе (Импазой) приводит к повышению либидо и нормализации уровня сывороточного тестостерона.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.