Возможности дифференциальной диагностики и лечения болезни Альцгеймера на стадии умеренного когнитивного расстройства
- Аннотация
- Статья
- Ссылки
- English

Введение
Среди всего спектра когнитивных расстройств (КР) недементные нарушения играют особую роль. В отличие от деменции, которая характеризуется яркими клиническими проявлениями, приводит к грубым нарушениям функций и влияет на жизнь не только самого пациента, но и ухаживающих за ним лиц, недементные КР малозаметны и не имеют выраженной симптоматики. Считается, что именно на данной стадии наиболее оправданны различные терапевтические вмешательства, поскольку человек еще сохраняет автономность, а патологические изменения головного мозга пока недостаточно выражены.
Под недементными КР подразумевают спектр изменений когнитивной сферы, предшествующих развитию деменции на протяжении многих месяцев и даже лет. В настоящее время, согласно как отечественным [1], так и зарубежным [2] представлениям, к недементным КР относят субъективные, легкие и умеренные КР (табл. 1) [1].
Предполагается, что число пациентов с недементными КР достаточно велико, но определение показателей заболеваемости и распространенности в популяции пожилых людей сопряжено с методологическими сложностями ввиду различных подходов к диагностике в разных странах. По данным литературы, частота умеренного когнитивного расстройства (УКР), наиболее изученного типа додементных состояний, среди лиц в возрасте 60 лет и старше составляет от 5,0 до 36,7% [3].
Первоначально концепция недементных КР подразумевала их доброкачественный характер и зависимость от возрастных изменений головного мозга («доброкачественная старческая забывчивость», «возрастное нарушение памяти»). Однако позже было показано, что в большинстве случаев недементные КР – продромальная стадия заболеваний, со временем прогрессирующих до синдрома деменции. К наиболее частым причинам нарушений когнитивных функций относятся болезнь Альцгеймера и цереброваскулярные заболевания [4]. При этом если на стадии деменции у большей части пациентов КР обусловлены болезнью Альцгеймера, то свыше чем в 60% случаев недементные формы КР имеют сосудистую природу [4].
Впервые концепцию УКР предложили R.C. Petersen и соавт. в 1999 г. [5]. Вскоре стало понятно, что УКР не только клинически, но и нозологически гетерогенны. Развивая концепцию УКР, R.C. Petersen в 2004 г. выделил четыре основных типа: амнестический монофункциональный, амнестический полифункциональный, неамнестический полифункциональный и неамнестический монофункциональный [6]. В дальнейшем были предложены и другие классификации УКР, подчеркивающие нозологическую неоднородность данного состояния и базирующиеся на клинических особенностях дисмнестического синдрома.
Между тем клиническое определение на додементном этапе нозологической принадлежности заболевания, лежащего в основе УКР у конкретного пациента, и его рациональная терапия зачастую представляют сложную задачу для лечащего врача. Разработка параклинических методов диагностики (биомаркеров) болезни Альцгеймера позволила прижизненно достоверно диагностировать это заболевание на додементном этапе. В 2011 г. использование биомаркеров в дифференциальной диагностике болезни Альцгеймера было одобрено рабочей группой Национального института по проблемам старения и Ассоциации по борьбе с болезнью Альцгеймера США [7]. Возможности современной диагностики и лечения УКР в рамках додементной стадии болезни Альцгеймера хорошо иллюстрирует следующий клинический случай.
Клинический случай
Анамнез и жалобы
Пациентка Б., 70 лет (на момент первичного обращения). Имеет высшее экономическое образование, в настоящее время не работает (на пенсии с 68 лет).
На специализированный прием в кабинет нарушений памяти пришла в сопровождении дочери, хотя жила от нее отдельно и самостоятельно вела хозяйство. Причиной консультации стали настойчивые жалобы женщины на прогрессирующее снижение памяти на текущие события в течение последних двух лет, что, однако, не приводило к выраженным затруднениям при выполнении повседневных дел, женщина не нуждалась в посторонней помощи. В связи с ухудшением памяти она неоднократно обращалась в поликлинику по месту жительства к терапевту и неврологу. Состояние пациентки врачи расценивали как цереброваскулярное заболевание (без проведения дообследования) и два раза в год назначали ей курсы ноотропной терапии. Сопутствующие заболевания пациентка отрицала, сосудистых факторов риска не отмечалось.
Результаты обследования
Объективная оценка соматического статуса не выявила отклонений от возрастной нормы. Рутинный неврологический осмотр тоже не продемонстрировал очаговой неврологической симптоматики.
Нейропсихологическое обследование показало, что пациентка была правильно ориентирована в месте и времени. Наиболее выраженными были нарушения памяти в виде дефекта отсроченного припоминания слов при проведении тестирования по краткой шкале оценки психического статуса (mini-mental state examination – MMSE) – пациентка вспомнила одно слово из трех. Схожие результаты получены при выполнении теста «12 слов». При непосредственном воспроизведении пациентка вспомнила восемь слов из 12 (из них три по подсказке), а при отсроченном (после выполнения интерферирующего задания – теста рисования часов) – только три (эффективность подсказок была крайне низкой). Помимо того, отмечались специфические нарушения в виде недостаточной семантической активности речи в пробе с литеральными и категориальными ассоциациями, когда испытуемого просят назвать за минуту сначала как можно больше слов на определенную букву (литеральные ассоциации), а потом как можно больше слов из одной семантической категории, например животных или растений (категориальные ассоциации). В норме число категориальных ассоциаций за фиксированный промежуток времени всегда превышает число литеральных. Пациентка Б. за минуту назвала 14 слов на букву «С» (для пожилых норма составляет 12 и более) и только семь животных (в норме 15 и более).
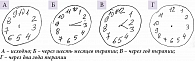
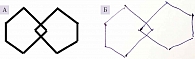
Со стороны зрительного гнозиса и номинативной функции речи при первичном нейропсихологическом обследовании нарушений выявлено не было. Присутствовала легкая дискалькулия в пробе с отниманием от 100 по 7, в основном при переходе через десятки. Кроме того, отмечались нарушения в тесте рисования часов (рис. 1А), но копирование фигур оставалось сохранным (рис. 2), что свидетельствовало о преимущественно вторичных нарушениях конструктивного праксиса.
Общий балл по MMSE составил 26 из 30, что соответствовало УКР. У пациентки не было нарушений повседневной и бытовой активности, следовательно, речь о деменции не шла. По характеру нейропсихологических нарушений можно было судить о поражении в большей степени гиппокампа и в меньшей – конвекситальных отделов височных долей головного мозга. Таким образом, пациентке был установлен предварительный диагноз УКР амнестического типа.
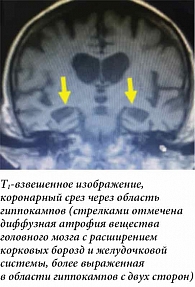
Параклиническое обследование включало стандартные анализы крови и мочи, нейрохимическое исследование ликворных маркеров болезни Альцгеймера, нейровизуализационное обследование с выполнением структурной магнитно-резонансной томографии головного мозга. В общем и биохимическом анализе крови (включая оценку профиля гормонов щитовидной железы, уровней фолиевой кислоты и витамина В12) изменений не обнаружено. Анализ ликворных маркеров болезни Альцгеймера подразумевал оценку концентрации двух фракций бета-амилоида (40 и 42), уровней общего (О-тау) и гиперфосфорилированного по серину тау-белка 181 (Ф-тау). Далее выполнялся расчет коэффициентов нейродегенерации в виде отношения Ф-тау/бета-амилоид 42 (0,236 при норме < 0,086) [8] и О-тау/бета-амилоид 42 (9,9 при норме < 2,4) [9], что свидетельствовало о нейрохимических изменениях цереброспинальной жидкости, характерных для болезни Альцгеймера. По данным магнитно-резонансной томографии головного мозга, на коронарных срезах Т1-взвешенных изображений отмечались грубые атрофические изменения, наиболее выраженные в области височных долей и гиппокампов (до 4 баллов по шкале Шелтенса [10], рис. 3), что коррелировало с профилем нейрокогнитивной дисфункции пациентки Б.
Таким образом, сочетание клинических, нейропсихологических, нейровизуализационных и нейрохимических изменений позволило диагностировать болезнь Альцгеймера с поздним началом на стадии УКР.
Лечение
Пациентку Б. наблюдали в течение двух лет с повторным обследованием раз в полгода. Помимо нелекарственных мер (рекомендации по двигательной активности и когнитивному тренингу) ей был назначен препарат Акатинол Мемантин на протяжении всего периода. Она начала принимать препарат с 5 мг/сут, используя стартовый набор, в состав которого входят таблетки 5, 10, 15, 20 мг, что позволило постепенно нарастить дозу, увеличивая ее на 5 мг/сут каждую неделю до достижения целевой 20 мг/сут.
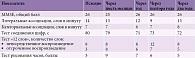
Оценка нейропсихологического статуса в динамике указывала на относительную стабильность состояния пациентки (табл. 2). В частности, общий балл по MMSE колебался от 26 до 25, то есть выраженность изменений так и не достигла уровня, соответствующего деменции.
В тесте рисования часов с самого начала проводимой терапии отмечалась существенная положительная динамика. Несмотря на дальнейшую тенденцию к некоторому усилению выраженности нарушений, через два года результаты при выполнении данного теста были выше исходных (см. рис. 1).
При выполнении теста соединения цифр тоже фиксировалась положительная динамика, которая сохранялась на протяжении всего периода наблюдения (см. табл. 2).
Интенсивность дисмнестических нарушений, согласно тесту «12 слов», в течение двух лет колебалась при общей относительной стационарности мнестического дефекта. По результатам объективной оценки функционального статуса также не регистрировались значимое прогрессирование заболевания и ухудшение состояния/существенное нарастание нарушений в повседневной жизни. Пациентка Б. сохраняла бытовую независимость.
Обсуждение
Можно выделить несколько особенностей приведенного клинического случая.
Прежде всего продемонстрированы современные возможности верификации нозологической принадлежности УКР путем всестороннего обследования, включая лабораторные и инструментальные методы. Среди всех предложенных биомаркеров болезни Альцгеймера наибольшей диагностической ценностью обладает концентрация различных фракций бета-амилоида и тау-белка в цереброспинальной жидкости, а их комбинирование значительно повышает точность диагностики. Метаанализ исследований ликворных биомаркеров болезни Альцгеймера показал, что их оценка, особенно в комплексе, дает возможность заподозрить болезнь Альцгеймера уже на стадии УКР, причем наибольшей точностью обладают коэффициенты дегенерации в виде отношения концентрации различных фракций бета-амилоида или отношения тау-белков к бета-амилоиду 42 [11]. Расчет коэффициентов позволяет до определенной степени нивелировать различия в абсолютных значениях концентрации биомаркеров, связанные с применением различных тест-систем, поскольку разработка единой референсной системы до сих пор не завершена [12]. Кроме того, в пользу диагноза болезни Альцгеймера свидетельствуют выраженные нейровизуализационные изменения по результатам структурной магнитно-резонансной томографии головного мозга в виде преобладающей атрофии медиальных отделов височных долей и гиппокампов, что является патогномоничным признаком болезни Альцгеймера [13].
Другая особенность представленного случая – соответствие между клиническими и параклиническими данными. УКР в обсуждаемом случае можно отнести к полифункциональному амнестическому типу. Более того, анализ амнестического синдрома, проведенный в ходе нейропсихологического обследования, показал безусловные признаки первично гиппокампальной природы дисмнестичеcких нарушений. Известно, что нарушения памяти при различных КР гетерогенны и в целом подразделяются на два основных типа.
Первый – нарушения, связанные с дефектом запоминания, консолидации и хранения следов памяти. Такой тип дисмнезии наблюдается при поражении структур гиппокампового круга и считается характерным признаком болезни Альцгеймера, хотя может встречаться и при других заболеваниях, в частности корсаковском синдроме или инфаркте в вертебробазилярной системе. Клинически данный тип отличает прогрессирующий дефект эпизодической памяти – утрата способности формировать новые воспоминания (забывчивость в основном связана с событиями, которые происходили недавно). При нейропсихологическом тестировании отмечается тенденция к дефициту отсроченного воспроизведения заучиваемых слов или изображений, причем на дефект формирования следа памяти указывает отсутствие эффекта при использовании стратегии запоминания или подсказок. Кроме того, пациент может давать конфабуляторные ответы («припоминать» слова, которые отсутствовали в задании).
Второй тип нарушений памяти при КР – нарушения, связанные с дефектом извлечения информации в условиях адекватной работы механизма формирования и хранения следов памяти. Они обусловлены изменением функциональной активности лобно-подкорковых кругов и входят в структуру дисрегуляторных и нейродинамических нарушений, сопутствующих КР различного генеза, например при дисциркуляторной энцефалопатии, нейродегенеративных заболеваниях (деменции с тельцами Леви и др.). Кроме того, они могут наблюдаться в рамках функциональных изменений при эмоционально-аффективных расстройствах, дисметаболических и токсических поражениях центральной нервной системы. Клинически подобный тип нарушений памяти проявляется забывчивостью разных эпизодов жизни, спонтанным припоминанием ранее «забытой» информации, относительно высокой эффективностью стратегий запоминания и подсказок.
Как видно из табл. 2, у пациентки Б. нарушения памяти имели несомненный гиппокампальный характер (тип дисмнезии оставался неизменным на протяжении двух лет, хотя в первый год терапии отмечалась некоторая положительная динамика). Кроме того, обращала на себя внимание недостаточная семантическая речевая активность при нормальных результатах пробы с называнием литеральных ассоциаций. Известно, что для пациентов с УКР подобный паттерн изменения речевой активности свидетельствует о высоком риске трансформации в болезнь Альцгеймера [14]. Таким образом, еще до параклинического обследования профиль когнитивных нарушений пациентки Б. указывал на возможный нейродегенеративный процесс альцгеймеровского типа, лежащий в основе синдрома УКР.
Наиболее важная и интересная особенность представленного случая – отсутствие значимого прогрессирования УКР на фоне проводимой терапии в течение двух лет наблюдения. В целом УКР часто переходит в деменцию: с частотой от 5 до 15% случаев в течение года и до 80% случаев в течение шести лет [15]. Это и позволяет утверждать, что УКР предваряет деменцию. В то же время известно, что состояние некоторых пациентов с когнитивными нарушениями на протяжении длительного времени может оставаться стабильным или даже в отдельных случаях возвращаться к возрастной норме. Однако подобная динамика в большей степени типична для УКР сосудистого генеза или когнитивных нарушений, сопутствующих эмоционально-аффективным расстройствам (например, депрессии). УКР нейродегенеративной этиологии неуклонно прогрессируют, что отражает продолжающуюся гибель нервных клеток.
Таким образом, можно предположить, что именно медикаментозная терапия препаратом Акатинол Мемантин лежала в основе наблюдаемой стабилизации состояния пациентки Б. В настоящее время достоверных медикаментозных методов терапии, предотвращающих трансформацию недементных КР в деменцию, не существует. По мировому опыту, наибольшим уровнем доказательности обладают немедикаментозные вмешательства: физические упражнения и устранение гиподинамии, здоровое питание (следование принципам средиземноморской диеты), а также высокая умственная нагрузка и когнитивная стимуляция (когнитивный тренинг) [16]. Кроме того, при факторах риска развития деменции, например артериальной гипертензии, сахарном диабете, болезнях сердца, требуется их лечение в соответствии с общепринятой практикой. Показано, что для предупреждения прогрессирования недементных КР наиболее оправдан мультимодальный подход [17, 18], а коррекция большинства сосудистых факторов риска эффективнее всего в среднем возрасте.
Мемантин в лечении болезни Альцгеймера
Для лечения болезни Альцгеймера на стадии деменции используют базисные противодементные препараты двух групп: ингибиторы ацетилхолинэстеразы и антагонисты NMDA-рецепторов глутамата. Для оценки эффективности ингибиторов ацетилхолинэстеразы у пациентов с болезнью Альцгеймера на стадии УКР были проведены клинические исследования. Однако их результаты не показали замедления прогрессирования УКР в деменцию, более того, активная терапия была сопряжена с повышенным риском нежелательных явлений [19].
Акатинол Мемантин, будучи селективным антагонистом NMDA-глутаматергических рецепторов, относится к базисным противодементным препаратам. В основе действия Акатинола Мемантина лежит модулирование глутаматергической передачи с опосредованным этим снижением эксайтотоксических реакций, что в свою очередь может оказывать нейропротективный эффект.
В доклинических исследованиях на возможные точки приложения Акатинола Мемантина при болезни Альцгеймера указывали следующие находки [20]:
- выявление скопления нейрофибриллярных клубков или сенильных бляшек (основных патоморфологических признаков болезни Альцгеймера) в местах расположения глутаматергических нейронов у пациентов с прижизненно диагностированной болезнью Альцгеймера;
- снижение астроглиального транспортера глутамата EAA2 в лобной коре, а также корреляция между сниженной иммунореактивностью транспортера глутамата и патологическими изменениями нейронов у пациентов с болезнью Альцгеймера;
- уменьшение высокоаффинного захвата глутамата тромбоцитами при болезни Альцгеймера на 40% по сравнению с возрастной нормой;
- обнаружение высокого скопления глутаматергических нейронов в зонах мозга, наиболее часто поражаемых при болезни Альцгеймера (в области гиппокампа и зубчатой извилины);
- способность бета-амилоида in vitro снижать величину обратного захвата глутамата и потенцировать его эксайтотоксичность. Формирование сенильных бляшек стимулировало продукцию микроглией агонистов NMDA-рецепторов, отличных от глутамата, и повышало уязвимость нейронов к эксайтотоксическим эффектам глутамата;
- повышенная фоновая эксайтотоксичность, чувствительность к повреждению, индуцируемому ишемией, и чувствительность к глутаматергическим агонистам, в том числе к NMDA, у мышей с изменениями головного мозга, аналогичными болезни Альцгеймера.
С учетом всего перечисленного были проведены многочисленные неклинические исследования мемантина (Акатинола Мемантина) на животных моделях с поражением головного мозга различного генеза (острой и хронической ишемией, травмой, инфекционным воспалением), которые показали обнадеживающие результаты [21, 22]:
- мемантин препятствовал активации в гиппокампе крыс циклинзависимой киназы 5, опосредуемой введением в головной мозг окадаиковой кислоты, которая индуцировала формирование фенотипических изменений, характерных для болезни Альцгеймера;
- мемантин оказывал противовоспалительное действие на клетки микроглии путем ингибирования калиевых каналов внутреннего выпрямления (Kir);
- мемантин продемонстрировал нейропротективный эффект в виде замедления потери синапсов в опыте на клеточной культуре нейронов гиппокампа, обрабатываемых олигомерами бета-амилоида с опосредуемым активацией NMDA-рецепторов повышением образования свободных радикалов;
- мемантин увеличивал высвобождение глиального нейротрофического фактора астроглией, что может дополнительно влиять на улучшение выживаемости нейронов в первичной культуре нейронов и глиальных клеток.
С учетом имевшейся доказательной базы до недавнего времени Акатинол Мемантин был рекомендован к использованию только на стадии деменции умеренной или тяжелой степени. В то же время все больше данных позволяют предположить, что препарат также может быть эффективен и на более ранних стадиях болезни Альцгеймера, например у пациентов с легкой деменцией [23, 24]. Было установлено, что терапия Акатинолом Мемантином при болезни Альцгеймера способствовала уменьшению выраженности и когнитивных, и некогнитивных нервно-психических нарушений [24]. Кроме того, Акатинол Мемантин по сравнению с ингибиторами ацетилхолинэстеразы вызывал менее выраженные побочные эффекты и лучше переносился [25].
Было высказано предположение, что причина ограниченной эффективности Акатинола Мемантина при болезни Альцгеймера на стадии умеренной и тяжелой деменции заключается в слишком позднем для реализации нейропротективных эффектов начале терапии, когда масштаб нейродегенеративных изменений делает состояние необратимым [21]. Это подчеркивает важность проведения клинических исследований Акатинола Мемантина при недементных КР с длительностью лечения, достаточной для оценки нейропротективных эффектов.
Несмотря на сложности, связанные с подтверждением и оценкой нейропротективных свойств препарата в клинической практике, в отдельных открытых исследованиях были продемонстрированы положительные эффекты использования Акатинола Мемантина при УКР [26–28]. В работе О.В. Успенской и соавт. применение мемантина контролировалось с помощью оценки ликворных маркеров болезни Альцгеймера. С положительным клиническим эффектом лечения коррелировало изменение концентрации бета-амилоида в цереброспинальной жидкости, что косвенно свидетельствует в пользу влияния Акатинола Мемантина на ключевые патогенетические изменения при болезни Альцгеймера [26]. В других открытых исследованиях Акатинола Мемантина при УКР продемонстрирована его эффективность относительно референсной терапии с уменьшением выраженности мнестических расстройств, нарушений конструктивного праксиса, счетных операций [27, 28]. Более того, терапия Акатинолом Мемантином способствовала стабилизации состояния пациентов с УКР (в том числе пациентов с амнестическим типом УКР), в группе сравнения, наоборот, отмечалось нарастание когнитивной дисфункции у значительного числа пациентов [28].
С одной стороны, положительные изменения нейропсихологических показателей под действием Акатинола Мемантина могут объясняться устранением «фонового шума», связанного с гиперактивностью глутаматергической системы и повышенной активизацией постсинаптичеcких рецепторов. С другой стороны, Акатинол Мемантин обладает дофаминомиметическим эффектом, который способствует уменьшению выраженности регуляторных нарушений [28–30]. Так, в представленном клиническом случае пациентка Б. с началом терапии стала выполнять тест соединения цифр быстрее, причем тенденция сохранялась в течение двух лет (см. табл. 2). Это отражало положительное влияние проводимой терапии на регуляторные функции и сопровождалось уменьшением выраженности нарушений памяти и праксиса (в тесте «12 слов» и тесте рисования часов соответственно).
Заключение
Терапия препаратом Акатинол Мемантин представляет собой перспективный способ модификации нейродегенеративного процесса при болезни Альцгеймера. Требуется дальнейшая разработка подходов к дифференциальной диагностике и лечению недементных КР с учетом их нозологической гетерогенности. Выявляемые нейропротективные свойства Акатинола Мемантина и его роль в терапии пациентов с недементными КР различного генеза необходимо уточнить в длительных должным образом организованных клинических исследованиях с анализом не только клинических, но и параклинических показателей, отражающих изменения ключевых патогенетических процессов при болезни Альцгеймера.
E.А. Mkhitaryan, PhD, M.A. Cherdak, PhD
N.I. Pirogov Russian National Research Medical University, Moscow
Contact person: Elen A. Mkhitaryan, melen99@mail.ru
Pre-dementia cognitive impairment is clinically and nosologic heterogeneous medical entity. Nonetheless, thorough analysis of clinic, laboratory and instrumental data allows the diagnosis of Alzheimer's disease even before the arrival of dementia. Nowadays there are no evidence-based medication methods for early stages of Alzheimer’s disease that could prevent dementia. At the same time, results of clinical and nonclinical trials suggest of memantine neuroprotective properties. The presented clinical case illustrates early diagnostic methods and possible new options for treatment of mild cognitive impairment due to Alzheimer’s disease with the use of Akatinol Memantine. Avenues for future clinical investigations of pre-dementia cognitive impairments and pre-dementia stage of Alzheimer’s disease are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.