Возможности фитотерапии при рецидивирующей инфекции мочевых путей
- Аннотация
- Статья
- Ссылки
При осложненной инфекции мочевых путей (ИМП) спектр возбудителей значительно расширяется, на долю кишечной палочки – ведущего возбудителя ОИМП – остается от 30% до 40%, возрастает роль других представителей семейства Enterobacteriaceae.
ИМП представляют серьезную проблему для здоровья миллионов людей: ежегодно в Западной Европе регистрируется свыше 10 млн случаев ИМП (15). При ИМП отмечается высокий уровень рецидивов инфекции, которая принимает характер хронической с частыми обострениями. При неосложненной инфекции нижних мочевых путей в воспалительный процесс вовлекается слизистая оболочка уретры и мочевого пузыря, однако в дальнейшем может вовлекаться и лоханка почки при восходящем пути инфицирования. Поражение почечной паренхимы инфекционно-воспалительным процессом может привести к развитию пиелонефрита, хронической почечной недостаточности и бактериемии.
Различают неосложненные и осложненные инфекции верхних или нижних мочевых путей. К НИМП относят острые циститы, пиелонефриты и уретриты у больных, чаще женщин, при отсутствии каких-либо нарушений оттока мочи из почек или из мочевого пузыря и структурных изменений в почках или мочевыводящих путях, а также у пациентов без серьезных сопутствующих заболеваний. Это обычный острый восходящий цистит или пиелонефрит без нарушения оттока мочи у здоровых (в других отношениях) женщин с нарушениями мочеиспускания, наличием примесей, гноя в моче, иногда сопровождающийся примесью крови в моче, субфебрильной температурой тела и болями в боку (10). Острый неосложненный бактериальный цистит в 80% случаев вызывается E. coli и в 15% другими возбудителями: S. saprophyticus, Enterococcus faecalis, Klebsiella spp, Proteus spp. (29). В большинстве случаев острый цистит представляет поверхностную инфекцию слизистой мочевого пузыря, легко поддающуюся терапии антимикробными препаратами. В то же время, несмотря на легкость купирования острого цистита у пациентов с анатомически нормальными мочевыми путями, цистит очень часто рецидивирует.
Осложненные ИМП возникают на фоне анатомических нарушений и обструкции мочевыводящих путей (камни, стриктуры, опухоли, кисты, фистулы, доброкачественная гиперплазия предстательной железы), а также на фоне функциональных нарушений, таких как нейрогенный мочевой пузырь и везикоуретеральный рефлюкс. На инородных телах в мочевых путях (катетерах, стентах, дренажах, камнях) микроорганизмы формируют биопленки (biofilms), т.е. скопления микроорганизмов из различных семейств с особыми механизмами самозащиты, что приводит к развитию катетер-ассоциированной ИМП, биофильм-инфекции. Таким образом, инородное тело становится очагом инфекции для организма, и бактериурия в таких случаях становится неизбежной (5).
Колонизация мочи микроорганизмами при отсутствии клинических симптомов называется асимптоматической бактериурией (АСБ). АСБ встречается у 6% здоровых и у 20% пожилых люди. При АСБ понимают выделение микроорганизмов в 105 КОЕ/мл в 2 анализах средней порции утренней мочи, взятых через 24 часа (35). Большинство пациентов с АСБ не требует лечения, т.к. у них нет клинических проявлений инфекции. Лечению подлежат только пациенты перед трансуретральными операциями, а также беременные.
Escherichia coli ответственна за развитие более 80% всех ИМП и вызывает как АСБ, так и симптоматическую ИМП (7, 22). Эти виды инфекций вызываются одним бактериальным клоном: способность уропатогенной E. сoli (UPEC) вызывать симптоматическую инфекцию связывают с экспрессией различных факторов вирулентности, таких как адгезины (например, 1 типа и Р-фимбрий) и токсины (например, гемолизин) (9, 12).
Бактериальная адгезия является основным моментом в колонизации тканевых поверхностей организма-хозяина. Мочевые пути человека подчиняются силам гидродинамики, адгезия микроорганизмов к уротелию дает им возможность противостоять удалению потоком мочи. Бактериальная адгезия не только способствует колонизации, но также благоприятствует инвазии микроорганизмов, формированию биопленок и повреждению клеток хозяина.
Оба типа фимбрий (1 и Р) запускают воспалительный ответ организма-хозяина, который включает продукцию цитокинов, воспалительную реакцию и отшелушивание инфицированных клеток уротелия (11, 16, 25).
В ситуациях частой возвратной инфекции нижних мочевых путей, рецидива заболевания, когда вновь выделяется первоначальный патогенный возбудитель, необходимо урологическое обследование на предмет аномалий развития или сопутствующих заболеваний с соответствующей их коррекцией и обязательным подбором адекватного антибиотика.
Эффективное лечение ОИМП возможно только лишь при условии восстановления нормальной уродинамики и коррекции осложняющих факторов и сопутствующих заболеваний. ОИМП характеризуется частыми обострениями заболевания, где необходимо дифференцировать реактивацию существующего очага инфекции от реинфекции (новый возбудитель).
Целью лечения ОИМП является профилактика уросепсиса, рецидива заболевания, предупреждение осложнений и повреждения паренхимы почек.
Из антибактериальных препаратов для лечения ОИМП рекомендуются фторхинолоны, защищенные β-лактамы, цефалоспорины, аминогликозиды, комбинации антибиотиков. Однако длительная непрерывная антибактериальная терапия приводит к дисбиозу кишечника, влагалища, аллергизации организма и селекции резистентных штаммов микроорганизмов. Ведущей причиной развития резистентности к β-лактамным антибиотикам среди грамотрицательных микроорганизмов являются β-лактамазы. Различают β-лактамазы широкого и расширенного спектра действия (ESBLs). До последнего времени считалось, что инфекции, вызванные кишечной палочкой, продуцирующей ESBLs – β-лактамазы расширенного спектра действия, относятся к госпитальной инфекции. Тем не менее было доказано, что ИМП, вызванная ESBLs-продуцирующими E. сoli, может быть проблемой и для амбулаторных пациентов в разных частях земли (24).
Возможно, впервые о негоспитальной ESBLs-продуцирующей E. coli было сообщено в 1998 году, когда кишечная палочка, резистентная к налидиксовой кислоте, была изолирована из мочи пожилого пациента (из Ирландии), у которого не было госпитализации в анамнезе (3). С тех пор количество ESBLs-продуцирующей E. coli значительно увеличилось в негоспитальной среде. Более того, штаммы негоспитальной ESBLs-продуцирующей E. coli часто показывают ко-резистентность к триметоприму/сульфаметоксазолу, тетрациклину, гентамицину, ципрофлоксацину. В исследовании J. Vranes (2008) и соавт. (24) показано клональное распространение высоковирулентных ESBLs-продуцирующих штаммов E. coli, изолированных из мочи у амбулаторных пациентов в большом регионе Хорватии. Появление ESBLs-продуцирующей E. coli зеркально эпидемиологии метициллин-резистентного S. aureus (MRSA). Аналогично MRSA, ESBLs-продуцирующая E. coli становится широко представленной в обществе и может иметь детерминанты вирулентности, которые дают ей конкурентные преимущества. В исследовании вышеупомянутых авторов было показано, что клонально распространяющиеся ESBLs-продуцирующиеся штаммы E. coli, выделенные из мочи у негоспитализированных пациентов в Загребе, были высоко вирулентны (ко-экспрессия 1 тип и Р-фимбрий и продукция гемолизина). Эти факторы вирулентности давали возможность им вызывать НИМП у негоспитализированных пациентов. Хотя НИМП не ассоциируется со вспышкой инфекции, мультирезистентные, уропатогенные линии кишечной палочки имеют эпидемиологическое значение (13).
Так, например, штамм E. coli 015:K52:H1 вызвал вспышку амбулаторного цистита, пиелонефрита и септицемии в северной части Лондона в 1986-1987 гг. Штаммы этого серотипа экспрессировали Р-фимбрии, вырабатывали аэробактин и показали необычный множественный антимикробный фенотип резистентности (13). Этот серотип можно считать широко распространенным вирулентным клоном. Штамм E. coli 015:K52:H1 стал эндемической причиной ИМП в Барселоне (14).
Недавно обнаруженные штаммы кишечной палочки с резистентностью к ТМП/СМХ, явившиеся причиной половины амбулаторной ИМП у женщин в 3 географических областях в США, были названы «клональной группой А» (CGA), которая имела сильный профиль вирулентности, предполагающий увеличенную экстраинтестинальную вирулентность. Johnson (6) заявил, что комбинация вирулентности и резистентности дает основание считать CGA широко диссеминированным эпидемичным клоном. Факторы риска, связанные с приобретением амбулаторной ИМП, включают выявление ESBLs-положительных изолятов. Предшествующая госпитализация, антибактериальная терапия в предшествующие 3 месяца, пожилой возраст (старше 60 лет), мужской пол, постельный режим и катетеризация мочевых путей определены как факторы риска (2).
При выборе пероральных антимикробных препаратов для лечения мочевой инфекции необходимо помнить о том, что они могут вызывать экологические нарушения в нормальной микрофлоре кишечника. Плохо всасывающиеся антибиотики могут в активной форме поступать в кишечник, угнетая чувствительные микроорганизмы и вызывая дисбиоз кишечника. Угнетение нормальной микрофлоры может привести к уменьшению колонизационной резистентности с последующим усиленным ростом предсуществующих природно-резистентных микроорганизмов, таких как грибы и Сlostridium difficile. Возможна новая колонизация резистентными потенциальными патогенами, которая может стать источником возбудителей инфекции для организма или для других пациентов и вызывать инфекционные процессы. Поэтому очень важно думать об экологических аспектах действия антимикробных агентов на микрофлору человека. Влияние пероральных антибиотиков, используемых для лечения НИМП, на кишечную микрофлору отличается в зависимости от групп препаратов. Так, например, ампициллин, амоксициллин и ко-амоксиклав угнетают как аэробную, так и анаэробную микрофлору кишечника с последующим усиленным ростом ампициллин-резистентных энтеробактерий. Пероральные цефалоспорины, такие как цефиксим, цефподоксим и цефтибутен, уменьшают количество Enterobacteriaceae и увеличивают число энтерококков, у которых имеется природная устойчивость к цефалоспоринам. Также наблюдается колонизация Clostridium difficile. Фторхинолоны сильно угнетают или элиминируют микроорганизмы семейства Enterobacteriaceae, но слабо действуют на энтерококки и анаэробные бактерии. При выборе антибиотика для лечения ИМП необходимо ориентироваться не только на микробный спектр, но и на потенциальные экологические последствия, включая риск появления резистентных штаммов возбудителей (4).
Персистенция бактерий в мочевых путях представляет одну из наиболее трудных задач успешного лечения ИМП. При катетер-ассоциированной ИМП, биофильм-инфекции, инфекции инородного тела быстрая (в течение 24-72 часов) колонизация поверхностей инородных тел микроорганизмами приводит к формированию биопленок. Чаще всего после удаления инородных тел из мочевых путей бактериурия исчезает.
Однако наибольшие трудности представляет персистенция микроорганизмов в слизистой оболочке мочевых путей без наличия или после удаления катетеров, инородных тел. Так называемый рецидивирующий или персистирующий бактериальный цистит (свыше 3 обострений в год) наблюдается у 25%-40% женщин после однократного эпизода острого цистита.
Многие виды бактерий способны паразитировать внутриклеточно, проявляя тропность к различным клеткам хозяина – факультативный паразитизм. Кишечная палочка, например, может паразитировать в клетках эпителия и макрофагов, создавая внутриклеточные бактериальные сообщества (ВБС). Наличие фимбрий и ферментативная активность микроорганизмов обеспечивает им проникновение в клетку или межклеточное пространство. Необходимым условием персистенции являются определенные биологические свойства микроорганизма и дефектность защитных механизмов хозяина, что обусловливает бактерионосительство (персистенция возбудителей) и хронизацию воспалительного процесса (частые рецидивы заболевания).
Снижая вирулентность или изолируясь в очагах локального иммунодефицита, бактерии могут уклоняться от факторов защиты человека. Подавление же факторов защиты хозяина идет за счет повышения вирулентных свойств бактерий или в результате диссеминации бактерий в иммунокомпрометированном организме. Высокая приспособляемость микроорганизмов к постоянно меняющимся условиям существования особенно проявляется при антибиотикотерапии – за счет селекции резистентных штаммов микроорганизмов обесцениваются целые классы антибиотиков (1, 37).
Лечение персистирующей или хронической ИМП и эффективная санация от бактерионосительства представляют большую проблему. Во внутриклеточных бактериальных сообществах резистентность к антибиотикам обусловлена:
- ограниченным проникновением антимикробных веществ в биопленки;
- различием в метаболической активности и скорости роста отдельных бактерий, т.к. многие антибиотики не действуют на клетки, находящиеся в покое;
- уменьшением диффузии АБ внутрь;
- инактивацией АБ внутри матрикса.
Однако выяснено, что малые концентрации антибиотиков вызывают существенные изменения в морфологии и биохимии бактерий. Суббактериостатические концентрации (¼ МПК) пенициллина, гентамицина, ванкомицина и др. вызывают резкое подавление адгезии стрептококков разных видов к слизистой оболочке (31). В то же время длительное антибактериальное лечение в суббактериостатических дозах чревато селекцией резистентных штаммов микроорганизмов.
Известно подавляющее действие фитотерапевтических препаратов на персистенцию уропатогенов (38). Одна из задач растительных диуретиков заключается в стимуляции диуреза и улучшении механизма самоочищения мочевых путей. Сам акт мочеиспускания является естественным механизмом защиты от внедрения возбудителей мочевой инфекции, поэтому увеличение диуреза на фоне увеличенного количества выпиваемой жидкости (соответственно, при хорошей переносимости и при отсутствии противопоказаний) являются обязательными мерами при лечении мочевой инфекции. Растительные диуретики больше влияют на водный диурез (акварез), чем на диурез как таковой, за счет увеличения почечного кровотока или участия в осмотических процессах (20). Действующими веществами, ответственными за акваретический эффект растительных препаратов, обычно выступают эфирные масла, флавоноиды, сапонины, производные ксантины и гликозиды (8, 17, 18, 19). Прием растительных препаратов, обеспечивающих как диуретический, так и комбинацию антисептического, противовоспалительного и спазмолитического эффектов, наилучшим образом подходит для лечения и профилактики ИМП.
В состав лекарственного препарата растительного происхождения Канефрон® Н входят: трава золототысячника (Herba Centaurii), обладающая диуретическим и антибактериальным действиями, корень любистока (Radix Levistici) с диуретическим (акваретическим), спазмолитическим, а также антибактериальными эффектами, а также листья розмарина (Folia Rosmarini), которые помимо прочего обладают также противовоспалительным эффектом. Компоненты препарата сообща оказывают выраженное антисептическое, спазмолитическое, противовоспалительное действие на мочеполовой тракт, улучшают кровоток и уменьшают проницаемость капилляров почек, обладают диуретическим (акваретическим) эффектом, улучшают функцию почек, потенцируют эффект антибактериальной терапии. В траве золототысячника присутствуют алкалоиды, флавоноидные соединения, горькие гликозиды, феноловые кислоты. В составе любистока имеются эфирные масла, фенолкарбоновые кислоты, фталиды. Розмарин содержит розмариновую кислоту, эфирные масла и флавоноиды (8, 21).
Водный диурез (акварез) – важный эффект препарата. Значительное мочеотделение, вызванное эфирным маслом (терпеном) любистока, происходит за счет расширения почечных сосудов, благодаря чему улучшается кровоток. Было также показано, что и секоиридоидные горечи (золототысячника малого) обладают сосудорасширяющими свойствами, наряду с положительным инотропным эффектом. Рассматривается также действие эфирных масел на реабсорбционную способность эпителиальных клеток канальцев. Диуретический эффект фенолкарбоновых кислот связывают с тем, что нерасщепляющиеся кислоты попадают в кровь, снижая щелочной резерв и смещая реакцию крови в кислую сторону. Смещение кислотно-щелочного баланса в крови и тканях приводит к тканевому эксикозу, и освобождающаяся из тканей жидкость выводится с мочой (8). Спазмолитический (антихолинергический) эффект помимо фенолкарбоновых кислот оказывают и фталиды любистока: бутилиденфталид и лигустилид (23). Розмариновая кислота ответственна за противовоспалительный эффект: она ингибирует неспецифическую активацию комплемента и липоксигеназу, в результате чего тормозит синтез лейкотриенов.
Все компоненты препарата Канефрон® Н содержат активные вещества с антимикробным действием (фенолкарбоновые кислоты, секоиридоиды и др.). Экскреция нерасщепляемых органических фенолкарбоновых кислот и их метилированных, глюкуронидированных и сульфатированных продуктов элиминации может провоцировать ацидификацию мочи, препятствуя росту бактерий.
Клинические исследования Канефрона Н охватывают период с 1973 года по настоящее время. За последние годы проведено несколько отечественных исследований по оценке эффективности Канефрона Н у больных с ИМП или профилактике ИМП.
Исследования эффективности Канефрона Н (проведенные при участии профессора О.Л. Тиктинского и профессора С.Н. Калининой) при лечении хронической ИМП и пиелонефрита на фоне мочекаменной болезни у 371 пациента в течение 2 месяцев показали его антимикробное действие, спазмолитический эффект, уменьшение процессов кристаллизации в моче, усиление отхождения кристаллов с мочой и увеличение диуреза (28). Эти данные согласуются с исследованиями Ю.Г. Аляева и соавторов (26). В данной работе наблюдались 55 женщин с хроническим циститом и 79 пациентов с мочекаменной болезнью. Больным с циститом назначали фосфомицин (2 дозы) вместе с Канефроном Н (30 дней), в контрольной группе пациентки получали только фосфомицин (2 дозы). Авторы отмечают отсутствие рецидивов цистита в течение месяца приема фитопрепарата, в то время как в контрольной группе у 30% пациентов отмечены рецидивы. В течение следующего месяца наблюдения рецидив заболеваний отмечался у 21% больных контрольной группы, в то время как в основной группе – только у 7,2% пациентов. Камнеизгоняющее действие фитопрепарата подтверждено в этом исследовании у 73% пациентов в течение первых 5 суток после дистанционной ударно-волновой литотрипсии, в то время как в контрольной группе, получавшей стандартную спазмолитическую терапию, – лишь у 33% пациентов. Ни у одного больного не отмечены осложнения и нежелательные побочные реакции после приема Канефрона Н.
Осложненные госпитальные ИМП у больных с цистостомическими дренажами (катетер-ассоциированная бактериурия) обычно бывают вызванными несколькими возбудителями, характеризующимися множественной устойчивостью к противомикробным препаратам. Частота бактериурии у таких больных приближается к 100%, что требует длительного проведения антимикробной терапии. В исследовании в урологической клинике РГМУ (Е.Б. Мазо, С.В. Попов, 2006 г.) было отмечено, что препарат Канефрон® Н повышает эффективность лечения таких больных, способствуя уменьшению выраженности кристаллурии, а также лейкоцитурии и бактериурии (30). На основании полученных результатов авторы рекомендуют применение данного препарата в интервалах между повторными курсами антибактериальной терапии или вслед за назначением антибиотиков при долгосрочном лечении больных с постоянным цистостомическим дренажом.
Известно, что сахарный диабет (СД) существенно усугубляет патологические процессы в мочевыводящих путях и способствует их прогрессированию: частота пиелонефрита у больных СД достигает 35%, что в 7-8 раз выше, чем в популяции. Причиной этому является не только глюкозурия, создающая благоприятные условия для размножения микрофлоры в мочевом тракте, но и нарушение уродинамики вследствие диабетической нейропатии, ухудшение кровоснабжения почек (интерстициальной ткани и чашечно-лоханочной системы) и даже иммунологические нарушения. С целью оценки эффективности препарата Канефрон® Н в терапии ИМП у больных с метаболическим синдромом или СД 2 типа Д.Д. Иванов и соавт. (2005 г.) создали дизайн и провели многоцентровое открытое контролируемое рандомизированное исследование с участием 302 пациентов в возрасте от 15 до 58 лет (27). Отдельно анализировались группы пациентов с инфекцией нижних и верхних мочевых путей в сравнении с соответствующими контрольными группами. Из исследования были исключены больные с заболеваниями, передающимися половым путем (ИППП).
Критериями оценки эффективности применения препарата Канефрон® Н были: отсутствие бактериурии, лейкоцитурии, а также клинических проявлений ИМП после проведенного курса лечения антибиотиками через 3 месяца при инфекции нижних мочевых путей и 6 месяцев – при инфекции верхних мочевых путей. Оценка результатов лечения осуществлялась по первичной конечной точке – частоте реинфекции органов мочевой системы.
Полученные результаты свидетельствуют о достоверном (р < 0,05) снижении частоты реинфекции нижних мочевых путей у пациентов с МС/СД 2 типа, получавших фитопрепарат в виде профилактического лечения, по сравнению с пациентами, не получавшими данный препарат. Аналогичная закономерность прослеживается в отношении результатов сохранения ремиссии после проведенного курса лечения: процентное соотношение лучше в группе, участники которой принимали Канефрон® Н (94,1%), по сравнению с группой, которой фитопрепарат не назначался (78,2%). Отличий в результатах терапии инфекции нижних мочевыводящих путей Канефроном Н и профилактического лечения уроантисептиками выявлено не было. По мнению авторов, это свидетельствует в пользу сравнимой эффективности фитопрепарата и химиопрепаратов в профилактическом лечении инфекций нижних мочевых путей.
Для оптимизации результатов лечения и уменьшения риска рецидивирования пиелонефрита в этом же исследовании пациенты на этапе реабилитации с профилактической целью получали Канефрон® Н или ⅓-¼ терапевтической дозы уроантисептика. При этом в процессе 6-месячного наблюдения количество больных с наличием реинфекции пиелонефрита не увеличилось при назначении профилактического лечения уроантисептиком или Канефроном Н. Это свидетельствует о сходной эффективности фитопрепарата и химиопрепаратов, назначаемых для профилактического лечения после перенесенного пиелонефрита у пациентов с МС/СД 2 типа. При этом частота рецидивов пиелонефрита у пациентов, не получавших профилактического лечения уроантисептиком, в 5 раз превышала таковую у пациентов, которым назначался Канефрон® Н. В ходе исследования не было выявлено ни одного случая нежелательной побочной реакции при использовании Канефрона Н (27).
В клинике кафедры урологии РМАПО было проведено исследование по изучению эффективности растительных препаратов в качестве метода профилактики рецидивов ИМП и на этапе амбулаторного долечивания при поражении верхних мочевых путей (36). Препарат Канефрон® Н применяли для лечения 2 групп больных: у пациентов с острым необструктивным пиелонефритом (n = 30) на этапе амбулаторного долечивания и у пациентов с хроническим рецидивирующим циститом на фоне ИППП (n = 60). Отмечено, что бактериурия у пациентов обеих групп выявлена только в 55,8% случаев (n = 62), а E. coli выявлена в 58% (n = 36). Отсутствие бактериурии (в основном в группе больных хроническим циститом) исследователи объяснили бесконтрольным применением антибактериальных препаратов и постоянным приемом уроантисептиков. В качестве эмпирической терапии больным острым необструктивным пиелонефритом назначались фторхинолоны, а пациентам с выявленными атипичными возбудителями проводился курс специфической терапии. Далее на амбулаторном этапе все пациенты получали Канефрон® Н в течение 1 месяца. При контрольном обследовании через 1 месяц после окончания терапии лейкоцитурии, бактериурии не было выявлено ни у одной пациентки.
Больным хроническим циститом и наличием ИППП (длительность заболевания от 1 до 8 лет) после проведения курса специфической терапии выполнялась цистоскопия. Тем пациентам, у которых была выявлена плоскоклеточная метаплазия (лейкоплакия) слизистой шейки мочевого пузыря и мочепузырного треугольника (83,3%; n = 50), проводилась терапия, направленная на восстановление слоя гликозаминогликанов: 3 курса внутрипузырных инстилляций гепарина – на все время внутрипузырной терапии и до следующего курса больным назначался Канефрон® Н (1 месяц). За время лечения ни у одной пациентки не было обострения цистита, больные хорошо перенесли курс внутрипузырной терапии, при контрольном обследовании через 30 дней у 90% пациентов посев мочи был стерильным.
Таким образом, Канефрон® Н обеспечил надежную антибактериальную защиту при выполнении таких инвазивных манипуляций, как внутрипузырные инстилляции. Длительный прием Канефрона Н оказал устойчивое противорецидивное действие. Авторы отметили, что ни в одном случае не было отмечено побочных реакций или непереносимости препарата (36).
В клинической практике врачи НИИ Урологии М3 СР РФ назначают Канефрон® Н пациентам с рецидивирующими циститами и уретритами, простатитами, а также при хронической инфекции мочевых путей, почек и мочеполовых органов на фоне и без катетеров и дренажей в мочевых путях.
Предварительно проведенные исследования в клинике НИИ Урологии М3 СР РФ в 2004 году показали эффективность и безопасность использования Канефрона Н у пациентов с хронической персистирующей инфекцией нижних мочевых путей и с бактериальным простатитом (32).
Контрольную группу составили пациентки с хроническим циститом, не получавшие лечение Канефроном Н. Им проводилась стандартная антибактериальная терапия при обострениях (фторхинолоны по 3-5 дней или фосфомицин трометамол 3 г однократно), клюквенный морс.
Клинические, клинико-лабораторные, биохимические исследования включали: осмотр урологом с обязательным влагалищным или ректальным исследованием. Общеклинический анализ крови и мочи, микроскопическое исследование мазков из уретры, влагалища и шейки матки, бактериологическое исследование мочи и кала (по показаниям), ПЦР на заболевания передаваемые половым путем (микоплазмы, вирус простого герпеса, хламидии). Проводилось уродинамическое исследование; больные вели дневник мочеиспусканий в течение 3 месяцев.
Пациенты (n = 27) получали Канефрон® Н в течение 3 месяцев: 16 пациентам было назначено лечение Канефроном Н в виде монотерапии, а 11 пациентам в сочетании с антибиотиками (фосфомицин трометамол по З г 1 раз в сутки). Ни один из пациентов не был исключен из исследования.
Средний объем диуреза в группе наблюдения составил 1,6 л до лечения Канефроном Н и 1,9 л после лечения; в контрольной группе 1,6 и 1,6 л соответственно (p < 0,05): в группе больных, получавших лечение Канефроном Н, диурез после лечения увеличился на 0,27 л против 0,04 л в контрольной группе.
Бактериурия была выявлена у 46% пациентов из группы наблюдения до лечения и лишь у 14% после лечения. У пациентов из контрольной группы (n = 70) бактериурия имелась у 41% пациентов до лечения и у 38% через 3 месяца после лечения – различия были статистически достоверны (p < 0,05). В группе пациентов, получавших лечение Канефроном Н, статистически достоверно снизился процент бактериурии после лечения: разница составила 32%, а в контрольной группе лишь 3% (рисунок 1).
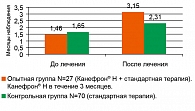
Безрецидивный период в группе пациентов, которым было назначено лечение Канефроном Н, до лечения составлял 1,5 месяца, а после лечения 3,2 месяца. В контрольной группе исходный интервал составил 1,7 месяца, а через 3 месяца наблюдения – 2,3 месяца. Различия статистически достоверны (p < 0,05). Таким образом, в группе Канефрона Н средний интервал между обострениями увеличился на 1,7 месяца, а в контрольной группе на 0,7 месяца (рисунок 2)
Всего проведено 27 стандартных курсов лечения Канефроном Н: 5 пациенов (18,5%) отмечали отличный клинический эффект, 17 (63,0%) – хороший эффект, а в 5 случаях (18,5%) эффект был удовлетворительным. Все пациенты отметили улучшение симптоматики, уменьшение болей в области мочевого пузыря, исчезновение резей, связанных с мочеиспусканием, а также увеличение интервалов между обострениями заболевания, при этом сами обострения протекали в более легкой форме, чем до лечения Канефроном Н.
Препарат показал хорошую безопасность и переносимость всеми пациентами: побочных эффектов, аллергических реакций за время наблюдения отмечено не было.
Таким образом, при лечении как острой ИМП, так и персистирующей бактериальной инфекции нижних мочевых путей, являющейся одной из проблемных тем в урологической практике, растительный препарат Канефрон® Н является эффективным и безопасным средством. Он значительно увеличивает диурез, что является одним из ключевых моментов при лечении больных с мочевой инфекцией (антиадгезивное действие, «самопромывание организма»). Снижение бактериурии способствует уменьшению персистенции микроорганизмов в мочевых путях, что приводит к увеличению безрецидивного периода. Следует отметить противовоспалительный эффект препарата, особо ценный в лечении острой симптоматики. Удобство применения (пероральная форма) обеспечивает комплаентность пациентов с урологической инфекцией, также способствуя повышению эффективности лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.