Возможности и перспективы лечения плацентарной недостаточности
- Аннотация
- Статья
- Ссылки
- English


Введение
На долю патологии плаценты, включая ее недостаточность, приходится от 30 до 60% в структуре причин перинатальной заболеваемости и смертности [1–3]. Благодаря прогрессу в современной перинатологии удалось решить многие проблемы, связанные с гестационным процессом и антенатальной охраной плода. Сегодня можно определить условия, влияющие на уровень перинатальных потерь, и следует констатировать, что в развитых странах и отдельных медицинских учреждениях РФ широкое внедрение в акушерскую практику современных диагностических и лечебных технологий позволило добиться снижения перинатальной заболеваемости и смертности [4].
Первичные звенья в патогенезе плацентарной недостаточности – сниженный маточно-плацентарный кровоток, отставание в формировании котиледонов и плодово-плацентарного кровообращения [3]. На этом фоне обычно усилено развитие компенсаторно-приспособительных механизмов в плаценте, особенно в ранние сроки беременности. В результате чрезмерной стимуляции компенсаторно-приспособительных механизмов происходит преждевременное созревание плаценты, что приводит к срыву адаптационных реакций. Формируется синдром плацентарной недостаточности, имеющий морфологические и функциональные проявления. К основным морфологическим проявлениям можно отнести гипоплазию плаценты, редукцию сосудистого русла плаценты и отсутствие с его стороны компенсаторных реакций. Что касается функциональных проявлений, то это прежде всего церебральные повреждения плода. В настоящее время наиболее признанными механизмами этих повреждений являются гипоксически-ишемический и инфекционный. Нельзя также не сказать о врожденных и наследственных заболеваниях. Крайним проявлением экстремального состояния фетоплацентарного комплекса является антенатальная гибель плода [5].
Предотвратить нежелательное влияние на плод лекарственных средств, проникающих через плаценту, – важная задача, которая занимает центральное место в тактике фармакотерапии у беременных с фетоплацентарной недостаточностью. Однако и без учета влияния лекарств на плод (имеются в виду случаи терапии по витальным показаниям) фармакотерапия имеет особенности, обусловленные перестройкой обмена веществ в организме беременной, а также связанные с участием плаценты и плода в кинетике применяемых препаратов.
Проблема фармакологической защиты организма при фетоплацентарной недостаточности имеет два четко разграниченных аспекта: профилактический и лечебный. Профилактический аспект – это соблюдение условий, способствующих предупреждению фетального дистресса: прегравидарная подготовка, современные диагностические возможности, прогнозирование перинатальных осложнений, адекватная тактика ведения. Учитывая определенную стадийность в развитии фетоплацентарной недостаточности, можно также говорить о лечебно-профилактическом аспекте.
Современная фармакотерапия фетоплацентарной недостаточности базируется на четырех основных направлениях:
- коррекция метаболических и гемодинамических нарушений, связанных с заболеванием матери;
- воздействие на патологические изменения маточно-плацентарного кровообращения;
- улучшение снабжения плода кислородом и энергетическими веществами, что определяет повышение адаптационных возможностей в системе «мать – плод» и устойчивости плода к гипоксии;
- поддержание метаболического и биохимического равновесия в плодной системе, благоприятствующего течению обменных процессов.
Исходя из основных положений патогенеза фетоплацентарной недостаточности и ее следствия, каковым является задержка внутриутробного роста плода, можно выделить основное звено приложения терапии этого состояния – улучшение кровотока в системе «мать – плацента – плод». Улучшение маточно-плацентарного кровотока достигается применением различных комбинаций медикаментозных средств [6], среди которых особое место занимает дипиридамол. Дипиридамол был представлен на рынке как вазодилататор в 1959 г. Последующие исследования продемонстрировали его антиагрегантную активность, ассоциированную со снижением адгезии тромбоцитов, что расширило показания к его применению [7, 8].
В акушерстве и гинекологии дипиридамол показан к применению для профилактики тромбозов, нарушений микроциркуляции любого генеза, профилактики и лечения плацентарной недостаточности при осложненной беременности. Терапевтическая доза составляет 75 мг/сут (максимальная рекомендованная суточная доза 225 мг), продолжительность приема – четыре – шесть недель с возможным повторным назначением курса лечения.
Дипиридамол оказывает влияние как на первичную, так и на вторичную агрегацию тромбоцитов, тормозит их адгезию, потенцирует антиагрегационный эффект простациклина. В механизме действия существенное значение имеет ингибирование фосфодиэстеразы и повышение содержания циклического аденозинмонофосфата в тромбоцитах, что приводит к торможению их агрегации. Кроме того, стимулируется высвобождение простациклина эндотелиальными клетками, угнетается образование тромбоксана А2. Дипиридамол оказывает вазодилатирующее действие на коронарные сосуды путем ингибирования аденозиндезаминазы. При этом тормозится обратный захват аденозина эритроцитами, повышается его концентрация в крови. Аденозин тормозит аденилатциклазу и в свою очередь увеличивает содержание циклического аденозинмонофосфата в тромбоцитах. Наряду с этим аденозин влияет на гладкую мускулатуру сосудов и препятствует высвобождению катехоламинов. Вазодилатирующее действие дипиридамола также связано с его способностью потенцировать выработку оксида азота эндотелиоцитами [9].
Дипиридамол также обладает антиоксидантной активностью. Открытые более 20 лет назад его антиоксидантные свойства продолжают активно изучаться как в экспериментах на животных моделях, так и в клинической практике. Дипиридамол устраняет продукты свободнорадикального окисления путем передачи электронов от гидрофильных и гидрофобных молекул, вследствие чего повышается васкулярная протекция. Протективный эффект выявлен преимущественно в отношении перекисного окисления мембран и митохондриальных липидов эритроцитов и других клеток крови. Кроме того, дипиридамол ингибирует образование свободных радикалов в тромбоцитах и эндотелиальных клетках, что приводит к улучшению окислительно-восстановительных клеточных реакций. Во многих экспериментальных исследованиях продемонстрировано, что нейтрализация свободных радикалов предупреждает и развитие патологической вазореактивности, и нарушение проницаемости гематоэнцефалического барьера [10].
Основная цель назначения дипиридамола во время беременности состоит в улучшении плацентарного кровотока и предупреждении дистрофических изменений в плаценте, устранении гипоксии тканей плода и накоплении в них гликогена. Препарат может с эффектом применяться у беременных с высоким риском плацентарной недостаточности (с внутриутробными инфекциями, преэклампсией, аутоиммунными заболеваниями, экстрагенитальными заболеваниями – сахарным диабетом, метаболическим синдромом), а также при высоком риске тромбообразования. Эффекты препарата универсальны и реализуются вне зависимости от причин, вызвавших нарушение плацентарного кровотока.
Цель исследования
Улучшение перинатальных исходов при плацентарной недостаточности путем разработки терапевтических подходов, включающих применение препарата Курантил® N25 (дипиридамол), который назначался беременным с фетоплацентарной недостаточностью по 50 мг три раза в сутки в течение четырех недель.
Материал и методы
Под наблюдением находилось 27 беременных с фетоплацентарной недостаточностью в сроке гестации 32–34 недели. Диагноз плацентарной недостаточности был установлен на основании клинико-лабораторных данных: эхографических признаков задержки внутриутробного роста плода различной степени тяжести, структурных изменений в плаценте в виде «раннего» старения и кальциноза, особенностей строения пуповины, маловодия. Кроме того, были отмечены признаки хронической гипоксии плода по данным кардиомониторного наблюдения, симптомы истощения гормональной функции плаценты по данным иммуноферментных исследований, патологические значения плодово-плацентарного кровотока по данным импульсной допплерометрии.
Медиана возраста пациенток – 26 лет (25-й перцентиль – 23 года, 75-й перцентиль – 30 лет). Первобеременных было 14 (51,9%), первые роды произошли у 22 (81,5%) пациенток, вторые роды – у пяти (18,5%). У 13 (48,1%) женщин анамнез был отягощен искусственными абортами. 70,4% пациенток ранее перенесли гинекологические заболевания. Все 27 (100%) беременных страдали различными экстрагенитальными заболеваниями: ожирением (14,8%), заболеваниями эндокринной системы (14,8%), заболеваниями желудочно-кишечного тракта (48,1%), заболеваниями почек и мочевыводящих путей (18,5%), заболеваниями сердечно-сосудистой системы (37%), гипертонической болезнью (22,2%).
Течение беременности осложнилось присоединением преэклампсии у 15 (55,6%) пациенток. У 20 (74,1%) беременность протекала на фоне угрозы ее прерывания с ранних сроков.
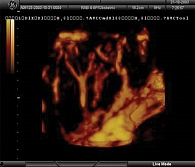
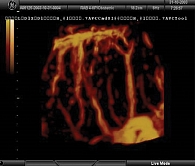
Необходимость контроля состояния внутриплацентарного кровотока в процессе терапии для своевременной оценки влияния медикаментозных препаратов очевидна. В ходе исследования оценивалась эффективность лечебного воздействия препарата Курантил® N25 (дипиридамол) на уровень внутриплацентарного кровотока и состояние плодово-плацентарной гемодинамики. Для контроля над эффективностью лечения использовалась методика трехмерной допплерометрии. Исследование проводилось на ультразвуковом приборе Voluson-730, оснащенном специализированным трехмерным датчиком (RAB 4-8p). Кровоток исследовался в пяти зонах: центральной, двух парацентральных и двух периферических. Вычислялись индекс васкуляризации, индекс кровотока и васкуляризационно-поточный индекс. Исходя из основных положений патогенеза плацентарной недостаточности и задержки внутриутробного роста плода как ее следствия, можно выделить основное звено приложения терапии этого состояния – улучшение маточно-плацентарного кровотока и нормализация реологических и гемостазиологических нарушений. В связи с этим в комплекс терапии был включен дипиридамол. Пациенткам был назначен Курантил® N25 (дипиридамол) по 50 мг три раза в сутки в течение четырех недель. Исследование объемного внутриплацентарного кровотока у беременных с фетоплацентарной недостаточностью проводилось до лечения и через две недели применения препарата Курантил® N25 (дипиридамол). После этого лечение продолжалось еще в течение двух недель.
Результаты и их обсуждение
До назначения препарата Курантил® N25 (дипиридамол) показатели внутриплацентарной гемодинамики были низкими, преимущественно в центральной зоне плаценты (гиповаскуляризация плаценты). Изменения внутриплацентарной гемодинамики, полученные через две недели после проведения терапии, представлены в табл. 1. Во всех пяти зонах плаценты после двухнедельной терапии дипиридамолом частота низких уровней внутриплацентарной гемодинамики уменьшилась с 4,3 до 2 раз. Частота нормативных значений увеличилась с 1,1 до 6 раз. В периферических зонах плаценты, в правой парацентральной, а также в центральной зоне появились участки гиперваскуляризации.
Как видно из табл. 2, показатели внутриплацентарной гемодинамики: индекс васкуляризации, индекс кровотока и васкуляризационно-поточный индекс – во всех зонах плаценты достоверно повышались после применения препарата Курантил® N25 (дипиридамол) (p < 0,001) (рис. 1 и 2).
Полученные результаты свидетельствуют о возможности с помощью неинвазивной диагностической методики – 3D-энергетической допплерометрии контролировать гемодинамические процессы в плаценте, выявлять нарушения плацентарного кровотока, мониторировать компенсаторные реакции плаценты и тем самым способствовать своевременному назначению патогенетически обоснованной терапии дипиридамолом.
У 15 (55,6%) пролеченных беременных роды произошли через естественные родовые пути. У 12 (44,4%) пациенток было запланировано родоразрешение путем операции кесарева сечения, однако в связи с дородовым излитием околоплодных вод или самопроизвольным развитием родовой деятельности четырех пациенток прооперировали в экстренном порядке. Основным показанием к операции явилась прогрессирующая фетоплацентарная недостаточность у всех пациенток, в том числе у четырех (14,8%) в сочетании с тазовым предлежанием плода.
У четырех (14,8%) пациенток дети родились недоношенными. Все дети родились с признаками задержки внутриутробного роста плода: у 15 (55,6%) новорожденных первой степени, у восьми (29,6%) – второй степени и у четырех (14,8%) детей – третьей степени. Признаки гипотрофии второй степени были выявлены у восьми (29,6%) новорожденных и третьей степени – у четырех (14,8%).
15 (55,6%) детей родились в удовлетворительном состоянии с оценкой состояния по шкале Апгар 8–9 баллов. У десяти (37,0%) новорожденных при рождении диагностирован гипоксический синдром, оценка по шкале Апгар составила 7–8 баллов. Двое (7,4%) новорожденных родились в состоянии асфиксии, оценка по шкале Апгар на первой и пятой минуте составила 6–7 баллов.
15 (55,6%) новорожденных были своевременно выписаны домой в удовлетворительном состоянии. 12 (44,4%) новорожденных были переведены на этапное лечение.
Выводы
Несмотря на положительный эффект от проводимой терапии по данным 3D-энергетической допплерометрии, только у 55,6% новорожденных ранний неонатальный период протекал без осложнений. Это можно объяснить особенностями состояния беременных, имевших отягощенный соматический, гинекологический и репродуктивный анамнез и составлявших группу высокого риска перинатальной патологии. Рождение более половины здоровых новорожденных у этого контингента женщин, безусловно, является следствием адекватно проведенной и патогенетически обоснованной терапии.
S.V. Novikova, E.B. Tsivtsivadze, V.U. Leonova, A.A. Efanov
Moscow Regional Research Institute of Obstetrics and Gynecology
Contact person: Svetlana Viktorovna Novikova, sv_novikova@list.ru
The article is devoted to the expediency of treating placental insufficiency. In 27 pregnant women at the gestational age of 32–34 weeks, placental insufficiency was detected with the three-dimensional dopplerometry. All of them were treated with dipyridamole for 4 weeks. The positive effect of therapy was recorded with a second ultrasound study. In 55.6% of newborns early neonatal period progressed without complications. This is consequents of adequately end pathogenically substantiated therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.