количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Тактика ведения беременности при хронической почечной недостаточности: осложнения и исходы
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" №1 (11)
- Аннотация
- Статья
- Ссылки
- English
Представлены результаты исследования осложнений и исходов беременности женщин, страдающих хронической болезнью почек (ХБП) III стадии и хронической почечной недостаточностью (ХПН). Проанализированы изменения уровня креатинина, суточной протеинурии, гемоглобина и артериального давления в разные сроки гестации и после родов. Установлено, что наиболее частыми акушерскими осложнениями у беременных с ХПН являются присоединение преэклампсии (гестоза) и развитие фетоплацентарной недостаточности, которые требуют преждевременного родоразрешения этих пациенток. У женщин с ХБП III стадии при стабильной функции почек, в отсутствие тяжелой артериальной гипертензии и обострения заболевания почек на момент наступления беременности, вероятность благоприятного исхода беременности повышается при интенсивном совместном наблюдении пациенток акушером-гинекологом и нефрологом на стадии планирования и на протяжении всей беременности, а также при условии профилактики преэклампсии начиная с ранних сроков беременности.
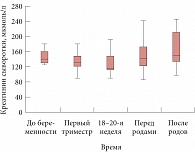
Рис. 1. Динамика уровня креатинина в сыворотке во время беременности и после родов у пациенток с ХПН
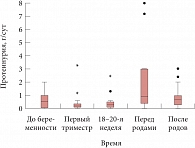
Рис. 2. Динамика суточной протеинурии во время беременности и после родов у пациенток с ХПН

Таблица 1. Показатели функции почек, активности их заболевания и «нефрологические» исходы беременности у пациенток с ХПН
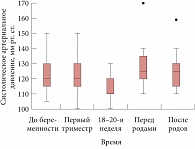
Рис. 3. Динамика систолического артериального давления во время беременности и после родов у пациенток с ХПН
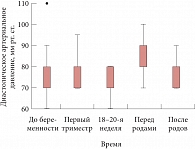
Рис. 4. Динамика диастолического артериального давления во время беременности и после родов у пациенток с ХПН
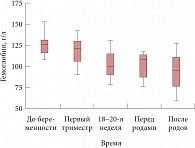
Рис. 5. Динамика уровня гемоглобина во время беременности и после родов у пациенток с ХПН
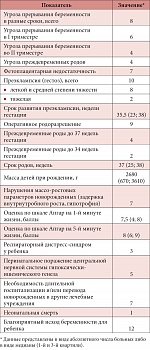
Таблица 2. Особенности течения, акушерские осложнения и исходы беременности у пациенток с ХПН
Введение
В XXI веке мировое сообщество столкнулось с глобальной проблемой – широкой распространенностью хронических болезней сердца, легких, почек, в том числе у женщин репродуктивного возраста. Борьба с хроническими заболеваниями имеет не только медицинское, но и огромное социально-экономическое значение ввиду крайне негативного влияния этих заболеваний на здоровье населения и колоссальных затрат на лечение сопутствующих осложнений [1]. Интерес к хронической болезни почек (ХБП) значительно вырос в начале ХХI века, когда были опубликованы данные крупных эпидемиологических исследований, выявляющих высокую частоту нарушений функции почек в популяции и неспособность диализных служб по всему миру справиться с потоком пациентов, находящихся на терминальной стадии почечной недостаточности. В 2002 г. Комитет «Инициатива по качеству лечения и исходам заболеваний почек» Национального почечного фонда США (Kidney Disease Outcomes Quality Initiative of the National Kidney Foundation, KDOQI-KNF) разработал концепцию ХБП и предложил устанавливать диагноз ХБП на основании следующих критериев [2]:
-
любые клинические или лабораторные маркеры повреждения почек, включая изменение состава мочи и крови, подтвержденные с интервалом не менее3 месяцев (эритроцитурия, лейкоцитурия, протеинурия, микроальбуминурия и др.);
- любые маркеры необратимых структурных изменений почек, выявленные однократно, во время прижизненного морфологического исследования или с помощью визуализирующих методов обследования (ультразвуковые, рентгенологические, радиоизотопные, магнитно-резонансная томография);
-
снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин (при расчете на стандарт площади поверхности тела человека 1,73 м²) в течение3 месяцев и более, в отсутствие других признаков повреждения почек;
-
трансплантация почки в анамнезе, вне зависимости от СКФ, наличия или отсутствия маркеров повреждения почечной ткани.
KDOQI в 2002 г. также разработана расширенная классификация стадий ХБП, которая в настоящее время является международной. Согласно данной классификации выделяют 5 стадий заболевания. Начиная со II стадии ХБП у пациентов уже могут проявляться начальные признаки снижения функции почек, усиливающиеся по мере прогрессирования вызвавшего ее заболевания. При III и IV стадиях ХБП (СКФ менее
60 мл/мин, но более 15 мл/мин) у пациентов имеется хроническая почечная недостаточность (ХПН), которую еще можно лечить консервативно, не прибегая к проведению заместительной терапии. Пациенты с V стадией ХБП (терминальная стадия ХПН, СКФ менее 15 мл/мин) нуждаются в проведении заместительной терапии.
60 мл/мин, но более 15 мл/мин) у пациентов имеется хроническая почечная недостаточность (ХПН), которую еще можно лечить консервативно, не прибегая к проведению заместительной терапии. Пациенты с V стадией ХБП (терминальная стадия ХПН, СКФ менее 15 мл/мин) нуждаются в проведении заместительной терапии.
Беременность и ХБП
Беременность у женщин с заболеваниями почек даже при сохранной их функции (ХБП
I стадии) сопровождается повышенной по сравнению с показателем в общей популяции частотой акушерских и перинатальных осложнений, в том числе преждевременных родов; зачастую эти осложнения обусловливают увеличение числа случаев родоразрешения путем кесарева сечения и потребности новорожденных в интенсивной терапии [3]. С ухудшением функции почек растет частота этих осложнений, то есть стадия ХБП наряду с артериальной гипертонией и протеинурией более 1 г/сут является фактором риска неблагоприятного исхода для матери и новорожденного [4–6].
I стадии) сопровождается повышенной по сравнению с показателем в общей популяции частотой акушерских и перинатальных осложнений, в том числе преждевременных родов; зачастую эти осложнения обусловливают увеличение числа случаев родоразрешения путем кесарева сечения и потребности новорожденных в интенсивной терапии [3]. С ухудшением функции почек растет частота этих осложнений, то есть стадия ХБП наряду с артериальной гипертонией и протеинурией более 1 г/сут является фактором риска неблагоприятного исхода для матери и новорожденного [4–6].
Следует отметить, что еще в середине XX века беременность у пациенток со сниженной функцией почек была практически бесперспективной. С течением времени исходы беременности у женщин с ХБП и ХПН улучшались. Так, если в 1950 г. на долю перинатальной смертности в группе пациенток с уровнем креатинина в сыворотке
1,5–3,0 мг/дл (132,5–265 мкмоль/л) приходилось 58%, а при уровне креатинина более 3,0 мг/дл (более 265 мкмоль/л) – 100%, то к 1980 г. данный показатель снизился до 10 и 53% соответственно [7]. По обобщенным данным 1985–2007 гг., у женщин с уровнем креатинина в сыворотке 125–180 мкмоль/л перинатальная смертность была равна 5%, частота стойкой потери почечной функции в послеродовом периоде более чем на 25% от исходной и развития терминальной стадии ХПН через 1 год после родов составила соответственно 20 и 2%. При уровне креатинина более 180 мкмоль/л эти показатели достигали 10, 50 и 35% соответственно [8]. Таким образом, вероятность благоприятного исхода беременности даже при уровне креатинина в сыворотке крови
125–180 мкмоль/л (ХБП III стадии) достаточно велика.
125–180 мкмоль/л (ХБП III стадии) достаточно велика.
Эти и другие данные легли в основу действующего приказа Минздравсоцразвития России от 03.12.2007 № 736 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности», согласно которому основанием для прерывания беременности служит ХПН любой этиологии с уровнем креатинина в крови до беременности более 200 мкмоль/л или с прогрессирующим нарастанием уровня креатинина в крови до этого показателя в любой срок беременности [9].
При ухудшении функции почек значимой проблемой у больных с ХБП является более высокая по сравнению со здоровыми женщинами частота присоединения преэклампсии (гестоза), характеризующейся чаще всего появлением/нарастанием артериальной гипертонии, протеинурии, отеков. Чем выше уровень креатинина, тем больше вероятность развития преэклампсии: при уровне креатинина до беременности менее 125 мкмоль/л преэклампсия развивалась у 20% беременных, при 125–
180 мкмоль/л – у 40%, при уровне более 180 мкмоль/л – у 60%, а у пациенток на гемодиализе она наблюдалась в 75% случаев [8]. В этих условиях важную роль приобретает профилактика преэклампсии у беременных с ХПН. Тяжелая преэклампсия способна спровоцировать такие угрожающие жизни осложнения, как эклампсия, острая почечная недостаточность, инсульт, полиорганная недостаточность, которые являются одними из основных причин материнской смертности. Патогенез этого осложнения в настоящее время остается не совсем ясным, однако известно, что недостаточная инвазия трофобласта в ранние сроки беременности приводит к неполноценной гестационной перестройке сосудов миометрия и ишемии плаценты. Развиваются массивное поражение эндотелия, артериальная гипертония, поражение почек, фетоплацентарная недостаточность, в тяжелых случаях – полиорганная недостаточность [10].
180 мкмоль/л – у 40%, при уровне более 180 мкмоль/л – у 60%, а у пациенток на гемодиализе она наблюдалась в 75% случаев [8]. В этих условиях важную роль приобретает профилактика преэклампсии у беременных с ХПН. Тяжелая преэклампсия способна спровоцировать такие угрожающие жизни осложнения, как эклампсия, острая почечная недостаточность, инсульт, полиорганная недостаточность, которые являются одними из основных причин материнской смертности. Патогенез этого осложнения в настоящее время остается не совсем ясным, однако известно, что недостаточная инвазия трофобласта в ранние сроки беременности приводит к неполноценной гестационной перестройке сосудов миометрия и ишемии плаценты. Развиваются массивное поражение эндотелия, артериальная гипертония, поражение почек, фетоплацентарная недостаточность, в тяжелых случаях – полиорганная недостаточность [10].
Для профилактики преэклампсии проводят терапию антитромбоцитарными препаратами. Во многих случаях эффективной является комбинация ацетилсалициловой кислоты (аспирина) и дипиридамола, особенно у женщин с заболеваниями почек [11]. Крупный систематический обзор (42 исследования, включающих более 32 000 женщин с высоким риском развития преэклампсии) продемонстрировал, что прием антитромбоцитарных препаратов (низкие дозы аспирина или дипиридамол) по сравнению с плацебо или отсутствием лечения указанными выше препаратами умеренно снижает риск развития преэклампсии (на 15%), преждевременных родов до 37 недель беременности (на 8%) и смерти новорожденных (на 14%) [12].
С целью улучшения исходов беременности при высоком риске развития преэклампсии применяются прямые антикоагулянты. Прочно занял место в акушерско-гинекологической практике гепарин (нефракционированный и низкомолекулярный). Известно, что у женщин с тяжелой преэклампсией в анамнезе применение гепарина в сочетании с аспирином в качестве профилактики преэклампсии, задержки внутриутробного роста плода и неблагоприятного исхода беременности более эффективно, чем применение с этой целью только аспирина [13–15]. Метаанализ рандомизированных контролируемых исследований показал, что у женщин с антифосфолипидным синдромом комбинация гепарина и аспирина также превосходила по эффективности прием только аспирина (оценивалась частота рождения живых детей) [16].
Действие гепарина не ограничивается антикоагулянтным эффектом; он прямо или опосредованно через гепарансульфат, протеогликаны или гепаринсвязывающий
EGF-подобный фактор роста (epidermal growth factor – эпидермальный фактор роста) участвует в адгезии бластоцисты к эндометрию и последующей инвазии [17]. Важно, что у женщин с привычным невынашиванием беременности неясной этиологии использование низкомолекулярного гепарина начиная с I триместра и на протяжении всей беременности существенно снижало частоту ранних и поздних потерь плода [18]. Некоторые авторы препаратами выбора среди антикоагулянтных средств во время беременности называют именно низкомолекулярные гепарины [19, 20].
EGF-подобный фактор роста (epidermal growth factor – эпидермальный фактор роста) участвует в адгезии бластоцисты к эндометрию и последующей инвазии [17]. Важно, что у женщин с привычным невынашиванием беременности неясной этиологии использование низкомолекулярного гепарина начиная с I триместра и на протяжении всей беременности существенно снижало частоту ранних и поздних потерь плода [18]. Некоторые авторы препаратами выбора среди антикоагулянтных средств во время беременности называют именно низкомолекулярные гепарины [19, 20].
У пациенток с генетически обусловленными тромбофилиями гепарин не только снижает частоту спонтанных абортов, но и уменьшает риск задержки внутриутробного роста плода, преждевременных родов и преэклампсии. У большинства больных генетическая тромбофилия, не являясь причиной патологии почек, способствует развитию сочетания тромботической микроангиопатии и существующих гистологических изменений, вероятно, в результате дополнительной локальной активации внутрисосудистого свертывания крови как следствия активного иммуновоспалительного процесса в почках [21]. Сочетание тромботической микроангиопатии и хронического гломерулонефрита, независимо от морфологического варианта последнего, может способствовать прогрессированию патологии почек, индуцируя быстрое развитие нефросклероза вследствие ишемического повреждения ткани почки, присоединившегося к иммунному воспалению. Полученные в настоящее время сведения дают основание шире понимать связь тромбофилии с сосудистыми и метаболическими заболеваниями почек. Эти исследования имеют серьезные перспективы ввиду роли тромбофилии в развитии сосудистой патологии сердца и головного мозга. Доказано, что носительство генотипа 4G/4G гена ингибитора активатора плазминогена 1-го типа (plasminogen activator inhibitor-1, PAI-1) и носительство 4 и более «протромбогенных» аллелей ухудшают «почечную выживаемость» у больных с патологией почек, ассоциированной с тромбофилией [21]. У больных с хроническим гломерулонефритом наличие мультигенной тромбофилии повышает риск развития неблагоприятного «почечного исхода», особенно при сочетании носительства генотипа 4G/4G гена PAI-1 с аллелем T гена метилентетрагидрофолатредуктазы (methylenetetrahydrofolate reductase, MTHFR). Гены PAI-1 и MTHFR обладают синергизмом в отношении риска прогрессирующего ухудшения функции почек при различных почечных заболеваниях [21].
Учитывая данные исследования, в протокол профилактики преэклампсии и ухудшения функции почек у беременных с ХПН включили использование гепарина и дипиридамола. Механизм протективного воздействия гепарина при беременности не ограничивается, по-видимому, прямым антикоагулянтным эффектом. Одним из важнейших патогенетических звеньев преэклампсии является снижение уровня фактора роста эндотелия сосудов (vascular endothelial growth factor, VEGF) и повышение уровня его растворимых рецепторов (sFlt1). Применение низкомолекулярных гепаринов во время беременности повышает уровень циркуляции VEGF и sFlt1, но уровень VEGF увеличивается в большей степени [22]. In vitro показано, что нефракционированный и низкомолекулярный гепарин усиливает ангиогенез в среде, кондиционированной клетками человеческой плаценты, что косвенно подтверждает роль неантикоагулянтного эффекта гепарина в профилактике преэклампсии [23].
Цель исследования
Изучить осложнения и исходы беременности, влияние беременности на состояние функции почек у женщин с ХПН и методы профилактики преэклампсии у таких пациенток.
Материал и методы
В исследование были включены 13 беременных женщин, наблюдавшихся в Московском областном НИИ акушерства и гинекологии (МОНИИАГ) в период с 2009 по 2012 г. с нефропатиями различного генеза и ХПН (снижение СКФ < 60 мл/мин). Все пациентки приняли решение о сохранении беременности после того, как они были проинформированы о высоком риске осложнений беременности при ХПН для матери и для плода. Средний возраст пациенток составил 29 (21–36 лет) лет. Заболеваниями, послужившими причинами развития ХПН, были хронический гломерулонефрит (n = 5), врожденные аномалии развития мочеполовой системы с вторичным пиелонефритом (n = 3), первичный хронический пиелонефрит (n = 1), хронический тубулоинтерстициальный нефрит (n = 1) и люпус-нефрит (n = 1). Две женщины были реципиентками почечного аллотрансплантата: у одной из них причиной терминальной стадии ХПН был хронический гломерулонефрит, у другой – хронический тубулоинтерстициальный нефрит. Ни у кого из пациенток на тот момент не отмечалось обострения заболевания почек или тяжелой артериальной гипертонии. У 3 из 13 пациенток длительность ХБП неизвестна, поскольку заболевание почек выявлено во время беременности, а остальные 10 страдали ХБП длительно: медиана продолжительности ХБП составила 22,5 (8–28) года.
Все пациентки, включенные в исследование, к моменту наступления беременности имели III стадию ХБП: медиана СКФ до беременности составила 51 мл/мин (интерквартильный размах 34,5–59 мл/мин).
Благополучным исходом беременности у женщин с ХПН было решено считать рождение ребенка без аномалий развития и выживание его в постнатальном периоде без значимого ухудшения функции почек у матери после родов (отсутствие стойкого снижения СКФ или снижение СКФ менее 25% от исходного уровня). Неблагоприятным исходом для новорожденного считалась антенатальная или интранатальная гибель или его смерть в младенческом возрасте (в течение первого года жизни), а для матери – стойкое снижение СКФ после родов на 25% и более от СКФ до беременности и/или необходимость начала терапии, замещающей функцию почек, в течение года после родов.
Выявление ХБП и определение ее стадий производилось в соответствии с концепцией Национального почечного фонда США «Инициатива по улучшению исходов при всех заболеваниях почек» (Kidney Disease: Improving Global Qutcomes, KDIGO)
[18, 24, 25]. Диагноз «острое повреждение почек» устанавливался при повышении уровня креатинина в сыворотке на ≥ 0,3 мг/дл (≥ 265 мкмоль/л) в течение 48 часов, или в 1,5 раза и более по сравнению с исходным уровнем, или при снижении объема мочи до менее 0,5 мл/кг/ч за 6 часов [13].
Диагноз преэклампсии устанавливался при появлении (или нарастании тяжести) артериальной гипертонии в сочетании с протеинурией более 300 мг/сут после 20-й недели гестации. У женщин с исходной протеинурией преэклампсия диагностировалась при неуклонном нарастании протеинурии в сочетании с появлением или усугублением артериальной гипертонии. Ухудшение маточно-плацентарно-плодового кровотока по данным ультразвуковой допплерографии считалось дополнительным признаком, свидетельствующим в пользу преэклампсии. Анемия беременных диагностировалась при снижении уровня гемоглобина 105–91 г/л (легкой степени), 90–71 г/л (средней степени), 70 г/л и ниже (тяжелой степени).
На этапе прегравидарной подготовки или с I триместра беременности все пациентки принимали гестагенсодержащие препараты – дидрогестерон или микронизированный прогестерон – для профилактики первичной фетоплацентарной недостаточности. При планировании беременности препараты назначались во вторую фазу менструального цикла с продолжением терапии в непрерывном режиме с момента положительного теста на беременность до 20-й недели гестации с постепенной их отменой в течение 7 дней. Дидрогестерон назначали по следующей схеме: перорально по 10 мг² р/сут, микронизированный прогестерон до 12-й недели гестации применялся вагинально 200 мг/сут, после 12-й недели – перорально по 300 мг/сут. Учитывая прогестероновую составляющую указанных препаратов, в период лечения особое внимание уделялось профилактике инфекции мочевыводящих путей (ИМП) и выявлению бактериурии. Поскольку эндотелиально-тромбоцитарная дисфункция является одним из патогенетических факторов развития/прогрессирования как преэклампсии и фетоплацентарной недостаточности, так и ХПН, все беременные получали своевременную антикоагулянтную терапию. С этапа прегравидарной подготовки или с ранних сроков беременности (в отсутствие такой подготовки) пациенткам подкожно вводили низкомолекулярный гепарин 1–2 р/сут или они получали ингаляции гепарина через небулайзер по 12 500–25 000 ед. 2 р/сут с интервалом 12 часов. Дозы препаратов корректировались в соответствии с показателями гемостазиограммы. Антикоагулянты отменялись не позднее чем за 12 часов до родов. Терапия гепарином возобновлялась в первые сутки послеродового периода (не ранее чем через 6 часов после родов) и продолжалась в течение 5–6 недель. Ингаляционный способ введения нефракционированного гепарина является более приемлемым для длительного амбулаторного применения (нет необходимости жесткого коагуляционного контроля, стоимость нефракционированного гепарина более низкая) и характеризуется значительно меньшим числом гемостазиологических и инъекционных осложнений [26, 27]. Кроме того, все пациентки принимали дипиридамол, начиная с 25 мг 3 р/сут с постепенным увеличением дозы до 75 мг 3 р/сут.
Для коррекции фетоплацентарной недостаточности беременным назначали фосфолипиды по 5 мл (250 мг) внутривенно в течение 10 дней с переходом на пероральный прием по 300–600 мг 3 р/сут, раствор гемодеривата депротеинизированной крови телят по 4–5 мл (160–200 мг) в 200 мл 5%-ного раствора глюкозы внутривенно капельно через день, курс лечения – 10 инфузий, с последующим пероральным приемом этого препарата по 1 драже (200 мг) 3 р/сут в течение 2 недель. У беременных с высокой суточной потерей белка в комплекс лечения фетоплацентарной недостаточности входили растворы аминокислот, оказывающие метаболическое действие, по 400 мл внутривенно капельно через день, длительность лечения зависела от выраженности страдания плода. При фетоплацентарной недостаточности в сочетании с повышенной сократительной активностью матки назначались бета-адреномиметики: гексопреналин по 0,25–0,5 мг 4–6 р/сут внутрь или внутривенно капельно в дозе 5 мг
в 400 мл 0,9%-ного раствора хлорида натрия со скоростью 10–30 капель в минуту. При угрозе преждевременных родов, преэклампсии всем пациенткам в течение 2 суток проводилась профилактика респираторного дистресс-синдрома плода дексаметазоном в дозе 8 мг/сут внутримышечно.
Лечение анемии во время беременности проводилось сульфатом железа в сочетании с фолиевой кислотой, аскорбиновой кислотой и витамином В₁₂ по 1–2 капсулы 3 р/сут длительно (препарат Феро-Фольгамма, 1 капсула которого содержит 37 мг железа, 10 мкг цианокобаламина, 5 мг фолиевой кислоты и 100 мг аскорбиновой кислоты), а также глюконатом дигидратом железа в комбинации с медью и марганцем по 2–4 ампулы в сутки в зависимости от показателей гемоглобина (препарат Тотема, 1 ампула которого содержит 50 мг железа, 0,7 мг меди и 1,33 мг марганца). При развитии в послеродовом периоде тяжелой анемии добавлялось введение стимулирующих эритропоэз препаратов длительного действия
(метоксиполиэтиленгликоль-эпоэтин бета, 1–2 введения по 75–100 мкг подкожно).
В плановом порядке с целью коррекции артериального давления применялись дигидропиридиновые антагонисты кальция (амлодипин, нифедипин), в некоторых случаях они назначались в комплексе с селективными бета-адреноблокаторами (бисопролол, небиволол). Для лечения преэклампсии в обязательном порядке использовалась также классическая магнезиальная терапия под контролем уровня магния в сыворотке крови. Стандартную суточную дозу сульфата магния уменьшали в 2–4 раза в соответствии со снижением СКФ для предупреждения гипермагниемии.
Результаты
У всех пациенток беременность была одноплодной. 4 из 13 пациенток планировали беременность, наблюдаясь и консультируясь у акушера-гинеколога и нефролога. Остальные женщины обратились к акушеру-гинекологу по факту беременности, а затем были направлены к нефрологу в различные сроки гестации. Медиана сроков беременности при первой явке пациенток в женскую консультацию составила 8 недель (интерквартильный размах 4–13 недель), при обращении к специалисту МОНИИАГ – 11 недель (интерквартильный размах 4–33 недели), при обращении к нефрологу – 12 недель (интерквартильный размах 7–34 недели). Обращает на себя внимание позднее обращение 4 беременных к нефрологу (17, 19, 21 и 34-я недели гестации), когда было уже сложно повлиять на исход беременности.
Из 13 пациенток 3 были первобеременными, у остальных беременность была повторной: от второй до седьмой. У 5 из 10 повторнобеременных в анамнезе была одна успешная беременность. У 5 из 13 беременных был отягощен акушерский анамнез: у 4 – самопроизвольными выкидышами, у 1 – преждевременными родами на сроке 24 недели. Кроме того, еще у одной женщины ребенок умер на 7-е сутки после экстренного кесарева сечения по поводу острой гипоксии плода, а у другой в анамнезе имела место антенатальная гибель плода в 38 недель гестации.
С целью выявления генетической формы тромбофилии были обследованы 12 беременных. У 10 из 12 обследованных выявлены мутации генов свертывающей системы: у 6 из 10 больных обнаружена мутация только в одном гене, а остальные 4 пациентки имели мультигенную генетическую форму тромбофилии. Гомозиготные мутации были выявлены у 4 пациенток. У большинства женщин мутантные аллели обнаруживались в генах MTHFR (n = 8) и PAI-1 (n = 6).
В таблице 1 представлены показатели функции почек, активности заболевания и «нефрологические» исходы беременности у обследованных больных.
Изучены изменения уровня креатинина, суточной протеинурии, гемоглобина и артериального давления в динамике у обследуемых пациенток в разные сроки гестации и после родов. Во время беременности у всех пациенток отмечена характерная, свойственная и здоровым беременным женщинам, динамика уровня креатинина в сыворотке, но в более высоком диапазоне значений (рис. 1). Так, если до беременности медиана уровня креатинина в сыворотке составила 138 мкмоль/л (интерквартильный размах 125–180 мкмоль/л), то в I триместре отмечалось статистически не значимое снижение этого показателя до 131 мкмоль/л (интерквартильный размах 90–199 мкмоль/л). Минимальное значение медианы уровня креатинина в сыворотке наблюдалось в 18–20 недель гестации – 116 мкмоль/л (интерквартильный размах 90–209 мкмоль/л). Описанные изменения уровня креатинина были обусловлены возрастанием почечного плазмотока и СКФ, отмечаемым уже в ранние сроки беременности [28]. К моменту родов произошло статистически значимое повышение уровня креатинина по сравнению с таковым в сроки гестации 18–20 недель: медиана составила 143 мкмоль/л (интерквартильный размах
86–241 мкмоль/л; p = 0,002), что можно объяснить как присоединением преэклампсии у отдельных беременных, так и физиологическим снижением СКФ к моменту родов [28]. В послеродовом периоде в целом также отмечен рост уровня креатинина в сыворотке крови – медиана 150 мкмоль/л (интерквартильный размах 98–245 мкмоль/л), но данный показатель достоверно не отличался от уровня креатинина непосредственно перед родами и до беременности.
У большинства пациенток до беременности суточная потеря белка не превышала 1 г: у 7 больных протеинурия составляла менее 0,3 г/сут, а у 4 – 0,3–1 г/сут. Потеря белка с мочой более 1 г/сут до беременности наблюдалась лишь у 2 больных (медиана 0,5 г/сут; интерквартильный размах 0–2 г/сут); и величина потери снижалась, хотя и статистически недостоверно, до медианы 0,19 г/сут (интерквартильный размах 0–3,3 г/сут) в I триместре, а к 18–20 неделям незначительно увеличивалась до значения медианы 0,3 г/сут (интерквартильный размах 0–2,48 г/сут) (рис. 2). Перед родами протеинурия резко возрастала – медиана этого показателя составила 0,92 г/сут (интерквартильный размах 0–8; p = 0,003) по сравнению с протеинурией в 18–20 недель гестации, что можно объяснить развитием у многих больных преэклампсии. После родов протеинурия уменьшилась – медиана ее составила 0,67 г/сут (интерквартильный размах 0–3 г/сут), что достоверно ниже, чем перед родами (p = 0,026).
В нашем исследовании хроническая артериальная гипертония до беременности отмечалась у 3 из 13 больных (табл. 1). Осуществлялся динамический контроль за уровнем артериального давления, 8 из 13 беременных нуждались в гипотензивных препаратах, которые назначались с учетом тератогенности. Пациентки с хронической артериальной гипертонией, находящиеся на гипотензивной терапии до беременности, продолжили прием антигипертензивных препаратов во время беременности, а 5 – начали прием de novo в различные сроки гестации. На фоне медикаментозной коррекции артериальное давление находилось в пределах нормы.
До наступления беременности медиана систолического артериального давления у женщин составляла 120 мм рт. ст. (от 105 до 150 мм рт. ст.), а в I триместре и на сроке 18–20 недель гестации она практически не изменялась (рис. 3). К моменту родов систолическое артериальное давление достоверно повысилось (медиана 125 мм рт. ст.; интерквартильный размах 110–170;
p = 0,01 при сравнении с уровнем артериального давления в 18–20 недель) и сохранялось таковым в раннем послеродовом периоде. Медиана диастолического артериального давления (рис. 4) была равна 80 мм рт. ст. в течение всего периода наблюдения, однако в динамике исследования в группе пациенток также наблюдалось значимое повышение диастолического артериального давления перед родами по сравнению с 18–20-й неделями беременности, p = 0,01. Диастолическое артериальное давление значимо снижалось после родоразрешения. Основной причиной повышения артериального давления перед родами, судя по всему, было присоединение преэклампсии.
Анемия однозначно оказывает неблагоприятное влияние на течение беременности родов и послеродового периода, а также на состояние плода. У пациенток с ХБП анемия дополнительно способствует ишемии почек, усугубляя этим вероятность ухудшения их функций. Почти у трети больных с ХПН во время беременности имел место неблагоприятный фон – анемия до беременности (табл. 1). Во время беременности частота развития анемии нарастала, а после родов она наблюдалась у всех пациенток. Случаев тяжелой анемии во время беременности не было, а в послеродовом периоде анемия тяжелой степени развилась у 4 из 13 больных, несмотря на то что кровопотеря в родах не превышала физиологической нормы. Динамика уровня гемоглобина, представленная на рисунке 5, наглядно демонстрирует статистически значимые колебания этого показателя в зависимости от сроков гестации. Так, если до беременности медиана уровня гемоглобина составляла 125,5 г/л (интерквартильный размах
108–153 г/л), то уже в I триместре беременности она значимо снижалась до 121 г/л (интерквартильный размах 90–142 г/л;
p = 0,026). К сроку гестации 18–20 недель происходило дальнейшее статистически достоверное по сравнению с I триместром снижение уровня гемоглобина – медиана 100 г/л (интерквартильный размах 78–131; p = 0,003). К моменту родов за счет активного лечения анемии медиана уровня гемоглобина незначимо возрастала до 108 г/л (интерквартильный размах
76–117 г/л), а после родов регистрировалось наиболее низкое значение этого показателя – 95 г/л (интерквартильный размах
59–127 г/л).
76–117 г/л), а после родов регистрировалось наиболее низкое значение этого показателя – 95 г/л (интерквартильный размах
59–127 г/л).
До беременности диагноз хронической ИМП был установлен у 6 из 13 больных, в том числе у 1 из 2 пациенток с трансплантированной почкой (хронический пиелонефрит почечного трансплантата). Мочевая инфекция во время беременности (на 15–29-й неделях гестации), требующая антибактериальной терапии, развилась у 7 женщин. Обращало на себя внимание скачкообразное повышение уровня креатинина в сыворотке крови в среднем на 15–20% от исходного (162–184 мкмоль/л) у всех 7 больных, коррелирующее со снижением у них СКФ в отсутствие клинических проявлений ИМП. Это требовало проведения дифференциального диагноза между ИМП, обострением другой имеющейся нефрологической патологии, например гломерулонефрита, присоединением/утяжелением преэклампсии. На фоне лечения ИМП уровень креатинина крови снижался и возвращался к исходному, увеличивалась СКФ, что доказывало необходимость и эффективность антибактериальной терапии и подчеркивало значимость даже бактериурии низкой степени (10³–10⁴ КОЕ/мл) для снижения азотовыделительной функции почек у этого контингента пациенток.
Гестационное обострение хронического гломерулонефрита наблюдалось у 2 из 6 пациенток, одна из которых страдала
IgA-нефропатией, а вторая – люпус-нефритом, что являлось показанием к назначению им глюкокортикоидов. Иммуносупрессивную терапию во время беременности получали 4 пациентки (2 женщины с обострением гломерулонефрита и 2 женщины с наличием почечного трансплантата).
IgA-нефропатией, а вторая – люпус-нефритом, что являлось показанием к назначению им глюкокортикоидов. Иммуносупрессивную терапию во время беременности получали 4 пациентки (2 женщины с обострением гломерулонефрита и 2 женщины с наличием почечного трансплантата).
У пациенток с ХПН выявлена высокая частота развития акушерских осложнений (табл. 2). У 8 наблюдалась угроза прерывания беременности в различные сроки гестации; наиболее часто это осложнение встречалось в I триместре беременности (n = 6).
Во II триместре угроза прерывания беременности наблюдалась у 4 больных, как и угроза преждевременных родов (n = 4).
У 3 из 8 пациенток данное осложнение возникало неоднократно в разные сроки гестации – у каждой из них диагностировано
от 3 до 5 эпизодов угрозы прерывания беременности. У 7 беременных с ХПН диагностирована фетоплацентарная недостаточность.
Во II триместре угроза прерывания беременности наблюдалась у 4 больных, как и угроза преждевременных родов (n = 4).
У 3 из 8 пациенток данное осложнение возникало неоднократно в разные сроки гестации – у каждой из них диагностировано
от 3 до 5 эпизодов угрозы прерывания беременности. У 7 беременных с ХПН диагностирована фетоплацентарная недостаточность.
Несмотря на профилактику преэклампсии у всех наблюдавшихся нами беременных, это осложнение развилось у 10 из 13. Но тяжелая преэклампсия наблюдалась лишь у 2 из 10 больных, у остальных 8 диагностирована преэклампсия легкой и средней степени тяжести (менее 11 баллов по шкале оценки гестоза по Г.М. Савельевой). У большинства беременных преэклампсия развивалась в поздние сроки беременности, в период, когда прогноз для ребенка при досрочном родоразрешении в основном благоприятен, – медиана развития преэклампсии составила 35,5 недель (27–38 недель). В случае присоединения преэклампсии легкой и средней степени тяжести в условиях специализированного акушерского стационара на фоне комплексного лечения нам удавалось пролонгировать беременность; вследствие этого медиана сроков родов составила 37 недель (интерквартильный размах 25–38 недель). Преждевременные роды в целом наблюдались у 6 женщин, до 34-й недели гестации – у 2. Оперативное родоразрешение потребовалось 9 пациенткам. Срочные самопроизвольные роды на фоне длительной перидуральной анестезии произошли у 4 пациенток, 2 из которых были реципиентками почечного трансплантата.
Благополучный акушерский исход наблюдался у 12 пациенток. В одном случае зарегистрирована неонатальная смерть (на 12-й день жизни погибла глубоко недоношенная девочка, родившаяся с массой 670 г на 25-й неделе беременности у пациентки с тяжелой преэклампсией).
Недоношенными родились 4 детей (в сроке гестации 25, 30, 33 и 36 недель беременности). В общей группе средняя масса новорожденных составила 2368,4 ± 784,3 г (медиана – 2680 г; квартили: 670 г; 3610 г). Если не учитывать массу тела глубоко недоношенной девочки, у остальных 12 детей медиана этого показателя была 2705 г (квартили: 1220 г; 3610 г). Нарушения массо-ростовых параметров (задержка внутриутробного роста плода, гипотрофия) констатированы у 7 из 13 новорожденных.
Медиана оценки по шкале Апгар на 1-й минуте жизни составила 7,5 балла (квартили: 4; 8 баллов), на 5-й минуте – 8 баллов (квартили: 6; 9 баллов), что в целом является неплохим показателем. Реанимационное лечение проводилось 3 недоношенным новорожденным с респираторным дистресс-синдромом. Перинатальное поражение центральной нервной системы ишемически-гипоксического генеза констатировано у 5 детей. В переводе в другие лечебные учреждения нуждались 54% новорожденных, остальные были выписаны домой. В настоящее время известно, что 11 из 12 выживших детей развиваются нормально, об одной девочке информация отсутствует (в связи с переездом родителей в другой регион страны).
Острое повреждение почек перед родами, в родах и раннем послеродовом периоде развилось у 3 из 13 пациенток с ХПН (табл. 1), в том числе у обеих женщин с тяжелой, рано развившейся преэклампсией (на 23-й и 29-й неделях беременности), и у одной больной с преэклампсией средней степени тяжести в сроке гестации 33 недель. Ни одной пациентке с острым повреждением почек не потребовалась терапия, замещающая функцию почек. У этих 3 больных в послеродовом периоде отмечено дальнейшее стойкое снижение СКФ – более чем на 25%, но менее чем на 50% от СКФ до беременности, хотя только одна из них перешла в следующую (IV) стадию ХБП (после родов у нее наблюдалось стойкое снижение СКФ до 28–29 мл/мин). Ни у одной из пациенток не возникла необходимость начать регулярное лечение гемодиализом в течение 12 месяцев после родов. Таким образом, благоприятный «нефрологический» исход беременности можно констатировать у 10 из 13 больных. У одной из 3 пациенток с неблагоприятным «нефрологическим» исходом (снижение СКФ более 25% после родов по сравнению со значением до беременности) отмечался и неблагоприятный акушерский исход (поздняя неонатальная смерть на 12-е сутки жизни глубоко недоношенного ребенка).
Обсуждение результатов
Таким образом, в данном исследовании особенностей течения и исходов беременности при ХПН, включавшем 13 женщин с ХБП III стадии, получены следующие результаты: благоприятный акушерский исход – у 12 пациенток, благоприятный «нефрологический» исход – у 10. Антенатальных, интранатальных и ранних неонатальных (в первые 7 дней жизни) смертей в исследовании не было. В неонатальном периоде погиб 1 ребенок.
По данным G. Piccoli и соавт. [3], описавших исходы беременности у женщин с ХБП различных стадий, у 17 пациенток с ХБП III cтадии (средняя СКФ 50,3 мл/мин) число случаев преждевременных родов до 37 недель гестации составило 82%, до 34 недель – 41%, средний гестационный возраст плода на момент родов составил 34,5 ± 2,3 недель, средняя масса тела новорожденных – 2180,6 ± 572,9 г, 47% детей нуждались в реанимационной терапии. Конечно, сравнивать результаты различных исследований можно с известной долей осторожности. Согласно результатам данного исследования, средний гестационный срок родов составил 35,9 ± 3,6 недель (медиана 37 недель), средняя масса тела новорожденных – 2368,4 ± 784,3 г (медиана 2680 г), необходимость в реанимационном пособии возникла только у 3 недоношенных новорожденных.
В данном исследовании у беременных пациенток с ХПН отмечалась высокая частота развития преэклампсии – у 10 из 13, но тяжелые формы были зарегистрированы только у 2 беременных с этим осложнением. Предложена гипотеза, объясняющая предрасположенность к развитию преэклампсии пациенток с ХБП: наличие общего патогенетического звена этих двух состояний – дисбаланса ангиогенных и антиангиогенных факторов [29]. С развитием тяжелых форм преэклампсии у ряда пациенток связано и стойкое снижение функции почек после родов. По нашему мнению, наиболее эффективной мерой улучшения исхода беременности, профилактики преэклампсии у женщин с ХБП или, по крайней мере, отдаления сроков развития и снижения тяжести этого осложнения является применение гестагенов в I–II триместрах беременности, а также использование гепарина в сочетании с антитромбоцитарными препаратами на протяжении всего срока гестации. Терапия гепарином частично предупреждает и дальнейшее ухудшение функции почек во время беременности и в послеродовом периоде. У пациенток с ХБП и подтвержденной генетической тромбофилией и/или антифосфолипидным синдромом целесообразно назначать гепарин до наступления беременности, на этапе планирования, а продолжать гепаринотерапию во время гестации и после родов желательно у всех больных не менее 1,5 месяцев.
Прогнозировать с высокой долей вероятности развитие тяжелой преэклампсии, неблагоприятного «нефрологического» или акушерского исхода у конкретных пациенток было практически невозможно. Напротив, у наших больных с существенным снижением функции почек, сохранявшимся после родов, исходный фон был относительно благоприятным: до беременности ни у одной из 3 пациенток не было артериальной гипертонии или «большой» протеинурии; СКФ у всех превышала 50 мл/мин (от 54 до 59 мл/мин). У 2 больных суточная протеинурия была следовой, а у третьей пациентки колебалась от 0,7 до 1,25 г/сут. Акушерский анамнез у этих женщин также не был отягощенным. Разумеется, опрометчиво делать какие-либо выводы на основании анализа столь малого числа наблюдений, однако обращает внимание наличие генетической тромбофилии у всех больных с неблагоприятным «нефрологическим» исходом. Более того, у больной с наиболее тяжелой ранней преэклампсией и выраженным стойким снижением функции почек после родов, ребенок которой умер на 12-е сутки постнатального периода, были обнаружены 2 гомозиготные и 4 гетерозиготные мутации генов системы гемостаза, в том числе гомозиготное носительство генотипа 4G/4G гена PAI-1 с аллелями Т гена MTHFR. По-видимому, сочетание ХБП и генетической тромбофилии оказывает наиболее неблагоприятное влияние на течение и исход беременности, а также на «нефрологический» прогноз после родов.
Развитие тяжелой послеродовой анемии при умеренной кровопотере у пациенток с ХПН обусловлено нарушением компенсаторных возможностей организма, прежде всего дефицитом эндогенного эритропоэтина. Вот почему при лечении тяжелой анемии после родов у женщин с ХПН актуально введение препаратов эритропоэтина наряду с продолжением лечения препаратами железа, предпочтительно – стимулирующими эритропоэз препаратами пролонгированного действия, так как в амбулаторных условиях необходимость частого введения короткодействующих препаратов эритропоэтина пациенткам с грудными детьми связана с большими организационными трудностями.
При ведении беременности у пациенток с ХБП целесообразно придерживаться следующих рекомендаций:
- Пациенки должны находиться под наблюдением акушера-гинеколога и нефролога во время планирования беременности, при необходимости консультироваться у других специалистов (ревматолог, уролог, гематолог и др.). После наступления беременности женщины должны наблюдаться совместно акушером-гинекологом, имеющим опыт ведения беременных с заболеваниями почек, и специалистом-нефрологом по индивидуальному плану.
- При планировании беременности следует отменить препараты, запрещенные во время беременности, в том числе ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина II, статины (основные средства нефропротекции).
- Уже с этапа планирования беременности необходима профилактика акушерских осложнений (преэклампсии, фетоплацентарной недостаточности) путем применения антикоагулянтов в сочетании с антиагрегантами и гестагенами.
- Не следует вводить жесткие ограничения на потребление жидкости и поваренной соли, ни в коем случае не снижать количество белка в пище, тщательно контролировать артериальную гипертонию, при необходимости проводить ее медикаментозную коррекцию, проводить профилактику и терапию анемии.
- Необходимо внимательнее, чем у здоровых беременных, контролировать уровень креатинина в сыворотке, мочевой кислоты, суточной протеинурии, СКФ, коагулограммы, проводить ультразвуковое исследование почек, оценку показателей состояния плода, мониторинг бессимптомной бактериурии. Алгоритм данных исследований составляется индивидуально для каждой пациентки, исходя из особенностей ее нефрологического заболевания, а также осложнений настоящей беременности.
- При появлении симптомов фетоплацентарной недостаточности, пиелонефрита, подозрении на развитие преэклампсии или обострения основного заболевания необходимы срочная госпитализация беременных в акушерский стационар и лечение данных осложнений по существующим протоколам.
-
После родоразрешения пациентки должны находиться под амбулаторным наблюдением у нефролога. В случае обострения основного заболевания, при прогрессирующем снижении функции почек после родов обязателен перевод пациентки в нефрологическое отделение.
Выводы
- У женщин с ХБП III стадии при стабильной функции почек, в отсутствие тяжелой артериальной гипертонии и/или обострения заболевания почек на момент наступления беременности, вероятность благоприятного исхода беременности достаточно велика.
- Наиболее часто выявляемыми акушерскими осложнениями у беременных с ХПН являются присоединение преэклампсии (гестоза) и развитие фетоплацентарной недостаточности, которые требуют преждевременного родоразрешения.
- Вероятность стойкого снижения функции почек у беременных данного контингента повышается в случае раннего присоединения преэклампсии (гестоза) и коррелирует с ее тяжестью. Вероятность благоприятного акушерского и «нефрологического» исхода повышается при планировании беременности, интенсивном совместном ведении беременных акушером-гинекологом и нефрологом, а также профилактики преэклампсии с ранних сроков беременности.
1. Шилов Е.М., Козловская Н.Л., Бобкова М.Ю. и др. Хроническая болезнь почек и программа народосбережения Российской Федерации // Клиническая нефрология. 2010. № 3. С. 29–38.
2. Никольская И.Г., Новикова С.В., Баринова И.В. и др. Хроническая болезнь почек и беременность: этиология, патогенез, классификация, клиническая картина, перинатальные осложнения // Российский вестник акушера-гинеколога. 2012. № 5. С. 21–30.
3. Piccoli G.B., Fassio F., Attini R. et al. Pregnancy in CKD: whom should we follow and why? // Nephrol. Dial. Transplant. 2012. Vol. 27. Suppl. 3. P. 111–118.
4. Ahmad A., Samuelsen S. Hypertensive disorders in pregnancy and fetal death at different gestational lengths: a population study of 2 121 371 pregnancies // BJOG. 2012. Vol. 119. № 12. P. 1521–1528.
5. Bakker R., Steegers E.A., Hofman A. et al. Blood pressure in different gestational trimesters, fetal growth, and the risk of adverse birth outcomes: the generation R study // Am. J. Epidemiol. 2011. Vol. 174. № 7. P. 797–806.
6. Piccoli G.B., Attini R., Vasario E. et al. Pregnancy and chronic kidney disease: a challenge in all CKD stages // Clin. J. Am. Soc. Nephrol. 2010. Vol. 5. № 5. P. 844–855.
7. Davison J.M., Lindheimer M.D. Chronic renal disease // Clin. Obstet. Gynecol. 1984. Vol. 27. № 4. P. 891–901.
8. Williams D., Davison J. Chronic kidney disease in pregnancy // BMJ. 2008. Vol. 336. № 7637. P. 211–215.
9. Никольская И.Г., Новикова С.В., Будыкина Т.С. и др. Беременность у беременных с хронической почечной недостаточностью: тактика ведения и родоразрешения при консервативно-курабельной стадии // Российский вестник акушера-гинеколога. 2012. № 6. С. 21–28.
10. Серов В.Н. Профилактика материнской смертности // РМЖ. 2008. № 1. С. 1–5.
11. Рогов В.А., Тареева И.Е., Сидорова И.С. и др. Ацетилсалициловая кислота и Курантил в профилактике осложнений беременности при гломерулонефрите и гипертонической болезни // Терапевтический архив. 1993. № 6. С. 65–68.
12. Knight M., Duley L., Henderson-Smart D.J. et al. WITHDRAWN: Antiplatelet agents for preventing and treating pre-eclampsia // Cochrane Database Syst. Rev. 2007. Vol. 18. № 2. CD000492.
13. Gris J.C., Chauleur C., Molinari N. et al. Addition of enoxaparin to aspirin for the secondary prevention of placental vascular complications in women with severe pre-eclampsia. The pilot randomised controlled NOH-PE trial // Thromb. Haemost. 2011. Vol. 106. № 6. P. 1053–1061.
14. Sergio F., Maria Clara D., Gabriella F. et al. Prophylaxis of recurrent preeclampsia: low-molecular-weight heparin plus low-dose aspirin versus low-dose aspirin alone // Hypertens Pregnancy. 2006. Vol. 25. № 2. P. 115–127.
15. Urban G., Vergani P., Tironi R. Antithrombotic prophylaxis in multiparous women with preeclampsia or intrauterine growth retardation in an antecedent pregnancy // Int. J. Fertil. Womens Med. 2007. Vol. 52. № 2–3. P. 59–67.
16. Mak A., Cheung M.W., Cheak A.A. et al. Combination of heparin and aspirin is superior to aspirin alone in enhancing live births in patients with recurrent pregnancy loss and positive anti-phospholipid antibodies: a meta-analysis of randomized controlled trials and meta-regression // Rheumatology Oxford. 2010. Vol. 49. № 2. P. 281–288.
17. Fiedler K., Würfel W. Effectivity of heparin in assisted reproduction // Eur. J. Med. Res. 2004. Vol. 9. № 4. P. 207–214.
18. KDIGO Clinical Practice Guideline for Acute Kidney Injury // Kidney Int. Suppl. 2012. Vol. 2. № 1. P. 1–126.
19. Badawy A.M., Khiary M., Sherif L.S. Low-molecular weight heparin in patients with recurrent early miscarriages of unknown aetiology // J. Obstet. Gynaecol. 2008. Vol. 28. № 3. P. 280–284.
20. Brenner B. Enoxaparin use in pregnancy: state of the art // Womens Health (Lond. Engl.). 2007. Vol. 3. № 1. P. 9–14.
21. Боброва Л.А. Поражение почек при наследственных и приобретенных тромбофилиях: автореф. дис. … канд. мед. наук. М., 2010. 24 с.
22. Yagel S. Angiogenesis in gestational vascular complications // Thromb. Res. 2011. Vol. 127. Suppl. 3. P. 64–66.
23. Sobel M.L., Kingdom J., Drewlo S. Angiogenic response of placental villi to heparin // Obstet. Gynecol. 2011. Vol. 117. № 6. P. 1375–1383.
24. Levey A.S., Eckardt K.U., Tsukamoto Y. et al. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO) // Kidney Int. 2005. Vol. 67. № 6. P. 2089–2100.
25. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification and stratification // Am. J. Kidney Dis. 2002. Vol. 39. № 2. Suppl. 1. P. 1–266.
26. Федорова М.В., Ефимов В.С., Петрухин В.А. и др. Использование ингаляций гепарина в акушерской практике // Вестник Российской ассоциации акушеров-гинекологов. 1996. № 1. 69–73.
27. Шалина Р.И., Ефимов В.С., Гришин В.Л. и др. Коррекция гемокоагуляции как способ предупреждения преэклампсии у беременных // Тромбозы и геморрагии, ДВС-синдром. Проблемы лечения: тезисы докладов III Всероссийской конференции. М., 1997. С. 167–168.
28. Руководство по нефрологии / под ред. Р.В. Шрайера. Пер. с англ. под ред. Н.А. Мухина. М.: ГЭОТАР-Медиа, 2009. 560 с.
29. Cornelis T., Odutayo A., Keunen J. et al. The kidney in normal pregnancy and preeclampsia // Semin. Nephrol. 2011. Vol. 31. № 1. P. 4–14.
Pregnancy management in women with chronic kidney disease: complications and outcomes
I.G. Nikolskaya, S.V. Novikova, A.V. Mikayelyan,V.M. Guryeva, T.S. Budykina, I.I. Bocharova, M.S. Krupskaya
Moscow Regional Scientific Institute of Obstetrics and Gynecology
Ye.I. Prokopenko, A.V. Vatazin, N.Ye. Budnikova
Ye.I. Prokopenko, A.V. Vatazin, N.Ye. Budnikova
Moscow Regional Research Clinical Institute named after M.F. Vladimirsky
Contact person: Irina Georgiyevna Nikolskaya, guzmoniiag@gmail.com
Pregnancy complications and outcomes were studied in women with stage III chronic kidney disease (CKD) and chronic kidney failure (CKF). Dynamics of serum creatinine, daily proteinuria, hemoglobin levels and blood pressure was estimated during pregnancy and post partum. In CKF patients, pre-eclampsia (gestosis) and placental insufficiency were the most frequent obstetric complications requiring preterm delivery. In women with stage III CKD, factors improving pregnancy outcomes were stable background kidney disease/kidney function, absence of severe arterial hypertension at the time of pregnancy initiation, close obstetrician and nephrologist supervision during pregnancy planning and throughout the course of pregnancy, early prevention of pre-eclampsia.
Новости на тему
19.08.2022 01:00:00
15.08.2022 01:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.