Комплексный подход к ведению пациентов с ожирением и инсулинорезистентностью
- Аннотация
- Статья
- Ссылки
- English
Как известно, висцеральное ожирение является компонентом метаболического синдрома. Установлены также серьезные неблагоприятные долгосрочные эффекты ожирения в виде сердечно-сосудистых, метаболических и репродуктивных нарушений.
Ожирение и инсулинорезистентность (ИР) ассоциируются с нарушением репродуктивной функции как у женщин, так и у мужчин. Согласно результатам исследований, связь между высокими показателями индекса массы тела и бесплодием отмечается в 25–50% случаев. Инсулинорезистентность усугубляет развитие гиперандрогении у женщин с ожирением, способствует прогрессированию синдрома поликистозных яичников, что может стать причиной нарушений овуляторного цикла и, как следствие, бесплодия. Патологическая ИР у беременных способна привести к развитию гестационного сахарного диабета, артериальной гипертензии и даже прерыванию беременности.
Метаболический синдром с проявлениями висцерального ожирения, гиперинсулинемии и ИР является сложной мультидисциплинарной проблемой. Лечение метаболического синдрома должно быть комплексным. Так, в сопровождение комплексной терапии метаболического синдрома и ассоциированных с ИР состояний, например синдрома поликистозных яичников, в качестве нутритивной поддержки можно добавлять мио-инозитол.
Как известно, висцеральное ожирение является компонентом метаболического синдрома. Установлены также серьезные неблагоприятные долгосрочные эффекты ожирения в виде сердечно-сосудистых, метаболических и репродуктивных нарушений.
Ожирение и инсулинорезистентность (ИР) ассоциируются с нарушением репродуктивной функции как у женщин, так и у мужчин. Согласно результатам исследований, связь между высокими показателями индекса массы тела и бесплодием отмечается в 25–50% случаев. Инсулинорезистентность усугубляет развитие гиперандрогении у женщин с ожирением, способствует прогрессированию синдрома поликистозных яичников, что может стать причиной нарушений овуляторного цикла и, как следствие, бесплодия. Патологическая ИР у беременных способна привести к развитию гестационного сахарного диабета, артериальной гипертензии и даже прерыванию беременности.
Метаболический синдром с проявлениями висцерального ожирения, гиперинсулинемии и ИР является сложной мультидисциплинарной проблемой. Лечение метаболического синдрома должно быть комплексным. Так, в сопровождение комплексной терапии метаболического синдрома и ассоциированных с ИР состояний, например синдрома поликистозных яичников, в качестве нутритивной поддержки можно добавлять мио-инозитол.
За последние десятилетия избыточную масса тела и ожирение по праву можно отнести к одной из значимых медико-социальных проблем.
Согласно данным экспертов Всемирной организации здравоохранения, в 2016 г. в мире 39% лиц старше 18 лет (39% мужчин и 40% женщин) имели избыточный вес, около 13% взрослого населения (11% мужчин и 15% женщин) – ожирение [1].
Известно, что ожирение может стать триггером развития сахарного диабета (СД) 2 типа, артериальной гипертензии (АГ), ишемической болезни сердца, неалкогольной жировой болезни печени, синдрома обструктивного апноэ во сне, различных нарушений репродуктивной функции у мужчин и женщин, поражения опорно-двигательного аппарата, некоторых онкологических заболеваний и др.
Согласно современным представлениям, в основе развития экзогенно-конституционального (первичного) ожирения лежит дисбаланс между потреблением пищи и расходом энергии. Доля вторичного ожирения, то есть ожирения при различных заболеваниях (эндокринных, центральной нервной системы и др.), включая ятрогенное ожирение, составляет около 5%.
В многочисленных исследованиях продемонстрировано, что риск развития СД 2 типа возрастает по мере увеличения массы жировой ткани. Неоспоримым является и тот факт, что именно висцеральное (центральное, абдоминальное, андроидное) ожирение обусловливает высокий риск развития различных кардиометаболических нарушений.
Как известно, висцеральное (абдоминальное) ожирение является одним из компонентов метаболического синдрома. Метаболический синдром объединяет группу метаболических и клинических признаков (маркеров), таких как абдоминальное ожирение, инсулинорезистентность (ИР), гиперинсулинемия, нарушение толерантности к углеводам или СД 2 типа, дислипидемия, АГ. Распространенность метаболического синдрома среди населения довольно высока.
Согласно современным представлениям, в основе развития ожирения и нарушений углеводного обмена лежит ИР на фоне гипертрофии и дисфункции жировых клеток.
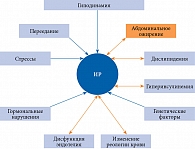
В течение последних десятилетий проведено много исследований, посвященных механизмам влияния избытка жировой ткани на развитие системной резистентности к инсулину, однако причины данной проблемы до конца не установлены. Доказано, что гиперинсулинемия, которая развивается на фоне ИР, приводит к увеличению массы тела, замыкая порочный круг (рис. 1) и вызывая целый спектр других патофизиологических осложнений, включая гиперлипидемию, АГ, атеросклероз [2].
Инсулинорезистентность характеризуется снижением чувствительности тканей (жировой, мышечной и печеночной) к действию инсулина, что ведет к понижению синтеза гликогена, активации гликогенолиза и глюконеогенеза. В данной ситуации снижение толерантности к углеводам может быть преодолено повышением и поддержанием высокой секреторной активности β-клеток. Когда гиперсекреторная активность достигает предела, но не может преодолеть ИР, нарушается гомеостаз глюкозы. Феномен ИР обусловлен рецепторными, а также пре- и пострецепторными механизмами, которые продолжают активно изучаться [3]. ИР может быть следствием как приобретенных состояний (глюкозотоксичность, липотоксичность, прием глюкокортикоидов, дисбаланс поступления и расхода энергии и др.), так и различных генетических синдромов, ассоциированных с ИР (лепречаунизм, ИР А и В типов) [4].
Существует мнение, что ИР служит физиологическим регулятором гомеостаза, однако в условиях патологии (например, при ожирении, провоспалительном статусе, повышенном глюконеогенезе, липолизе, нарушении механизмов передачи инсулинового сигнала) основным ее последствием является развитие СД 2 типа [3]. Кроме того, существует ряд заболеваний или состояний, ассоциированных с ИР. К ним относятся ожирение, неалкогольная жировая болезнь печени, синдром поликистозных яичников (СПКЯ), сердечно-сосудистые заболевания [4].
Как было отмечено ранее, ожирение и ИР связаны с нарушением репродуктивной функции как у женщин, так и у мужчин. Установлено, что высокие показателями индекса массы тела (ИМТ) в 25–50% случаев ассоциированы с бесплодием [5]. Доказана прямая связь между показателями ИМТ и абдоминальным ожирением, а также между увеличением ИМТ и тяжестью нарушений овариальной функции, сопровождающихся ановуляцией, неполноценностью лютеиновой фазы цикла и, следовательно, уменьшением числа беременностей [5]. Различные нарушения менструального цикла, в том числе ановуляторный менструальный цикл, у женщин с избыточной массой тела и ожирением встречаются в три – пять раз чаще, чем у женщин с нормальной массой тела.
Наряду с известными дисгормональными нарушениями на фоне избытка жировой ткани ИР усугубляет развитие гиперандрогении у женщин с ожирением, способствует прогрессированию СПКЯ, что может быть причиной нарушений овуляторного цикла и привести к бесплодию [6]. Распространенность ожирения и ИР среди женщин с СПКЯ в среднем составляет около 65%.
Гиперинсулинемия стимулирует синтез яичниковых андрогенов, а также ингибирует секрецию глобулинов, связывающих половые гормоны, в печени, что приводит к увеличению циркуляции свободных андрогенов в кровотоке. Патологическая ИР у беременных может обусловливать развитие гестационного СД, АГ и даже прерывание беременности. Увеличивается риск осложнений и в неонатальном периоде, что связано с нарушениями развития плода, гипертрофией или гипотрофией плода. У женщин с патологической ИР встречается в два-три раза чаще, чем у здоровых женщин [7].
Являясь фактором риска развития кардиометаболических нарушений, ожирение у женщин репродуктивного возраста сопровождается не только нарушениями менструального цикла, бесплодием, синдромом гиперандрогении, патологией эндометрия, повышенным риском развития рака эндометрия и молочных желез, но и плохой выживаемостью при раке яичников [8–11].
Ожирение неблагоприятно отражается и на репродуктивном потенциале мужчин. Влияние высокого ИМТ на частоту бесплодия у мужчин продемонстрировано в большом количестве исследований [12, 13]. Доказана тесная патогенетическая связь между андрогенным дефицитом и обусловленными им клиническими проявлениями, с одной стороны, и ИР и ассоциированными с ней компонентами метаболического синдрома, с другой стороны [12, 13].
Лечение метаболического синдрома должно быть комплексным и включать изменение образа жизни, лечение ожирения, коррекцию инсулинорезистентности на основе фармакотерапии (метформин), дислипидемии и АГ.
Так, к сопровождению комплексной терапии метаболического синдрома и ассоциированных с ИР состояний (например, СПКЯ) в качестве нутритивной поддержки можно добавлять мио-инозитол.
Мио-инозитол (МИ) представляет собой одним из изомеров инозитола. Являясь органическим осмолитом, МИ регулирует клеточный ответ на окружающую гипертоническую среду [14]. При повышении внеклеточного давления МИ поступает в клетки как с помощью простой диффузии, так и с помощью сложной системы транспортеров.
Известно, что МИ в основном встроен в мембраны эукариотических клеток в виде фосфатидил-миоинозитола – предшественника инозитол-3-фосфата, который действует как вторичный мессенджер при передаче нескольких эндокринных сигналов, включая фолликулостимулирующий гормон, тиреотропный гормон и инсулин.
В организм человека МИ поступает с пищей – около 1 г/сут. Основными его источниками являются злаки, бобовые, масличные семена и орехи [15]. Однако существенная часть суточной потребности в МИ (примерно 4 г) синтезируется самим организмом – почками.
В настоящее время установлено, что помимо метаболизма глюкозы инозитол тесно связан с репродуктивной функцией как у женщин, так и у мужчин [16].
Результаты проведенного систематического анализа продемонстрировали тенденцию к снижению ИР, избыточной секреции андрогенов, риска гирсутизма и акне, к нормализации липидного профиля и артериального давления на фоне приема мио-инозитола в дозе 4 г/сут.
Изучали воздействие мио-инозитола на ИР у 69 пациенток с гестационным диабетом. Женщины были рандомизированы на две группы. Основная группа получала мио-инозитол в дозе 4 г/сут и фолиевую кислоту в дозе 400 мкг/сут, контрольная группа – только фолиевую кислоту. Прием мио-инозитола способствовал значительному снижению уровней глюкозы плазмы натощак и инсулина до референсных значений. Показатели ИР, оцениваемые по модели гомеостаза, достоверно снизились у 50% участниц основной группы и 29% – контрольной (р = 0,0001). Прием мио-инозитола также способствовал повышению уровня адипонектина (р = 0,009) [17].
Представляют интерес данные о спобосности мио-инозитола улучшать липидный профиль у пациенток с СПКЯ. Оценка липидного профиля у 20 женщин с ожирением (ИМТ – 34 ± 6 кг/м2) до и после шести месяцев терапии свидетельствовала о повышении уровня липопротеинов высокой плотности на 0,1 ммоль/л (р < 0,05), снижение уровней липопротеинов низкой плотности с 3,50 ± 0,8 до 3,0 ± 1,2 ммоль/л (р < 0,05) и триглицеридов с 2,3 ± 1,5 до 1,75 ± 1,8 ммоль/л (р < 0,05) на фоне уменьшения ИР [18].
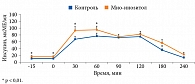
Применение мио-инозитола в течение восьми недель у 42 пациенток с ожирением и СПКЯ наряду с уменьшением уровней лютеинизирующего гормона и соотношения «лютеинизирующий гормон/фолликулостимулирующий гормон» позволило снизить ИМТ и уровень инсулина. При разделении пациенток в соответствии с их уровнями инсулина натощак на группу А (n = 15, инсулин < 12 мкЕд/мл) и группу Б (n = 27, инсулин > 12 мкЕд/мл) было установлено, что прием мио-инозитола способствовал снижению уровня инсулина в плазме крови только в группе Б, то есть при выраженной ИР. Таковой уменьшился с 20,3 ± 1,8 до 12,9 ± 1,8 мкЕд/мл (р < 0,00001). Показано, что именно в группе Б произошло снижение площади под кривой концентрации инсулина при проведении пробы на толерантность к глюкозе (рис. 2) [19].
Результаты другой работы продемонстрировали, что эффективность приема комплекса, содержащего мио-инозитол, пациентками с СПКЯ с целью повышения фертильности связана с уменьшением ИР [20].
Представляют также интерес данные в отношении курсового приема мио-инозитола для профилактики развития гестационного диабета у 83 беременных с СПКЯ. В основной группе (46 пациенток, принимавших мио-инозитол в течение всего срока беременности) диабет развился у 17%, в контрольной группе – у 54%. Риск развития гестационного диабета без нутритивной поддержки МИ повышался более чем в два раза (отношение шансов 2,4 при 95%-ном доверительном интервале (ДИ) 1,3–4,4) [21].
Результаты недавно опубликованного систематического обзора и метаанализа в отношении преимуществ использования мио-инозитола с позиции снижения риска развития гестационного сахарного диабета и его осложнений требуют проведения дальнейших крупномасштабных исследований исходя из недостаточной доказательной базы [22].
Инозитол способен воздействовать и на мужскую репродуктивную систему. Выявлено, что уменьшение концентрации мио-инозитола в придатках яичка коррелировало со снижением фертильности у трансгенных мышей [23]. Установлено также, что в сперматозоидах МИ выступает в роли вторичного мессенджера, модулируя внутриклеточные уровни Са2+, которые участвуют в регуляции окислительного метаболизма митохондрий и выработки аденозинтрифосфата [24].
Представлены данные систематического обзора (анализ 476 статей с последующей выборкой 20 рандомизированных контролируемых исследований) о влиянии добавления инозитола на гомеостаз глюкозы у 1239 взрослых пациентов.
В группе лиц с нарушением толерантности к глюкозе, получавших МИ, отмечено снижение уровня глюкозы плазмы натощак (средняя разница (РС) – -0,44 ммоль/л (95% ДИ -0,65– -0,23)), глюкозы плазмы через два часа после нагрузочного теста с 75 г глюкозы (РС – -0,69 ммоль/л (95% ДИ -1,14– -0,23)). В данной группе также выявлено уменьшение уровня инсулина плазмы натощак (РС – -38,49 пмоль/л (95% ДИ -52,63– -24,36)) и индекса HOMA-IR (РС – -1,96 ммоль × мМЕ/л (95% ДИ -2,62– -1,30)). Был сделан вывод, что прием инозитола способствует снижению уровня глюкозы в крови за счет улучшения чувствительности тканей к инсулину [25].
В настоящее время в России зарегистрирован комплекс Витажиналь Инозит, который является дополнительным источником мио-инозитола, фолиевой кислоты, витамина D3, галлата эпигаллокатехина и хрома для женщин и мужчин репродуктивного возраста. Благодаря синергичному воздействию компонентов комплекс Витажиналь Инозит может способствовать снижению риска развития сердечно-сосудистых осложнений у пациентов с метаболическим синдромом. Это происходит вследствие уменьшения уровня эндотелиального фактора роста и триглицеридов [26]. Компоненты комплекса регулируют энергетический обмен путем влияния на уровень лептина и гликированного гемоглобина [27]. Включение в состав хрома способствует уменьшению аппетита и тяги к сладкому.
Витажиналь Инозит может применяться дополнительно к основной терапии СПКЯ, для снижения ИР и инсулина у пациентов с метаболическим синдромом обоих полов, а также для улучшения состояния кожи и волос у женщин с гиперандрогенией.
Проведенные исследования позволяют рекомендовать следующие схемы применения Витажиналя Инозит. Так, для поддержки программ по лечению СПКЯ, при гестационном диабете, метаболическом синдроме, инсулинорезистентности, избыточной массе тела и/или ожирении, а также при угревой сыпи, андрогензависимой дермопатии, для улучшения состояния кожи и волос показаны два – четыре саше в сутки в течение трех – шести месяцев. При СД 2 типа – четыре саше в сутки в течение того же срока.
Поскольку метаболический синдром – мультидисциплинарная проблема и в основе его лечения лежит комплексный подход, добавление мио-инозитола можно рекомендовать в качестве нутритивной поддержки. Кроме того, требуется проведение дальнейших клинических исследований с адекватной мощностью и качеством для изучения и расширения возможностей добавления мио-инозитола к комплексному лечению метаболических нарушений.
M.E. Telnova, PhD, E.V. Goncharova, PhD, N.S. Martirosyan, PhD, I.A. Kuzina
I.M. Sechenov First Moscow State Medical University
Contact person: Milena E. Telnova, milena.telnova@mail.ru
In recent decades, overweight and obesity can rightfully be attributed to one of the most significant medical and social problems.
As is known, visceral obesity is one of the components of the metabolic syndrome. Serious adverse long-term effects of obesity in the form of cardiovascular, metabolic and reproductive disorders have also been established.
Obesity and insulin resistance (IR) are associated with impaired reproductive function in both women and men. According to research results, the relationship between high body mass index and infertility is noted in 25–50% of cases. Insulin resistance aggravates the development of hyperandrogenism in obese women, contributes to the progression of polycystic ovary syndrome, which can cause ovulatory cycle disorders and, as a consequence, infertility. Pathological IR in pregnant women can lead to the development of gestational diabetes mellitus, hypertension and even termination of pregnancy.
Metabolic syndrome with manifestations of visceral obesity, hyperinsulinemia and IR is a complex multidisciplinary problem. Treatment of metabolic syndrome should be comprehensive. Thus, myo-inositol can be added as nutritional support to accompany the complex therapy of metabolic syndrome and IR-associated conditions, for example polycystic ovary syndrome.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.