Впервые выявленная вторичная глаукома на фоне врожденной патологии органа зрения у пациентки в возрасте 50 лет
- Аннотация
- Статья
- Ссылки
- English
Пациентка в возрасте 50 лет впервые обратилась к офтальмологу после выявления у нее во время профилактического осмотра повышенного уровня внутриглазного давленяи (ВГД). Из анамнеза выяснено, что зрение снижено с детства, коррекцией не пользовалась, у офтальмолога не наблюдалась. В данном случае имели место сложности интерпретации результатов тонометрии, поскольку у пациентки наблюдалась «толстая» центральная толщина роговицы. Для оценки офтальмотонуса была использована технология Oculus CorVis ST, позволяющая установить биомеханически скорректированный уровень ВГД. На основании результатов обследования у пациентки диагностированы врожденная патология органа зрения, колобома радужной оболочки, вторичная некомпенсированная глаукома, колобома сосудистой оболочки, гиперметропия слабой степени, сложный гиперметропический астигматизм, субклинический кератоконус обоих глаз, периферический ретиношизис правого глаза.
Пациентка в возрасте 50 лет впервые обратилась к офтальмологу после выявления у нее во время профилактического осмотра повышенного уровня внутриглазного давленяи (ВГД). Из анамнеза выяснено, что зрение снижено с детства, коррекцией не пользовалась, у офтальмолога не наблюдалась. В данном случае имели место сложности интерпретации результатов тонометрии, поскольку у пациентки наблюдалась «толстая» центральная толщина роговицы. Для оценки офтальмотонуса была использована технология Oculus CorVis ST, позволяющая установить биомеханически скорректированный уровень ВГД. На основании результатов обследования у пациентки диагностированы врожденная патология органа зрения, колобома радужной оболочки, вторичная некомпенсированная глаукома, колобома сосудистой оболочки, гиперметропия слабой степени, сложный гиперметропический астигматизм, субклинический кератоконус обоих глаз, периферический ретиношизис правого глаза.



Введение
Вторичная глаукома представляет одну из важных проблем современной офтальмологии. По данным разных авторов, распространенность патологии колеблется в пределах 6–22%. Ее развитию могут способствовать многочисленные патологические состояния органа зрения, приводящие к изменениям дренажной системы глаза. Обычно это состояние возникает на фоне травмы, воспалительного заболевания увеального тракта, ишемического процесса в сетчатке глаза, а также в постоперационном периоде. В единичных случаях глаукома развивается у пациентов с врожденной патологией органа зрения с аномалиями развития дренажной системы глаза. Нередко, как в случае иридокорнеального эндотелиального синдрома, имеет место тяжелое течение глаукомы, которая попадает в категорию рефрактерной [1]. Тем не менее в некоторых случаях вторичная глаукома при врожденной патологии органа зрения может иметь благоприятное течение.
Рассмотрим клинические особенности впервые выявленной вторичной глаукомы на фоне врожденной патологии органа зрения, проявлениями которой стала колобома сосудистой оболочки и колобома радужной оболочки. Проанализируем погрешности тонометрии при наличии «толстой» центральной толщины роговицы (ЦТР), а также эффективность медикаментозного лечения.
Клинический случай
Впервые на прием в 2024 г. обратилась пациентка 50 лет с жалобами на сниженное зрение. Ранее на профилактическом осмотре выявлен повышенный уровень внутриглазного давления (ВГД), назначен дорзоламид 2% (без эффекта). Из анамнеза: зрение снижено с детского возраста, к офтальмологу не обращалась, коррекцией не пользовалась, деформация зрачков с рождения.
Сопутствующие заболевания: гипертоническая болезнь, по поводу которой получает медикаментозную терапию, аденоидэктомия.
Диагностическое обследование включало визометрию, тонометрию, пахиметрию, гониоскопию, оптическую когерентную томографию (ОКТ) (Cirrus HD-OCT 5000, CarlZeiss), стандартную автоматизированную периметрию на периметре TomeyAP-1000 по программе скрининга глаукомы. Биометрические параметры глаза исследовались на приборе Zeiss IOL Master 700. Эндотелиальная микроскопия проводилась на приборе SP-3000P (Topcon), стандартная бесконтактная тонометрия – на приборе Reichert 7 CR с возможностью получения роговично-компенсированного давления. Томографию роговицы и биомеханические параметры измеряли с помощью аппаратов Pentacam (Oculus) и CorVis ST соответственно. Диагностическое обследование включало также осмотр лазерного хирурга.
Оценивали следующие биомеханические параметры:
- показатель DA Ratio, определяемый как амплитуда деформации центральной вершины роговицы, разделенная на среднюю деформацию двух точек, расположенных на расстоянии 2 мм по обе стороны от вершины (назально и темпорально). Этот показатель позволяет судить о степени жесткости роговицы. Чем жестче роговица, то есть более устойчива к деформациям, тем меньше разброс значений в центре и двухмиллиметровой зоне и показатель DA;
- Integr. Radius (R) – радиус роговицы, вписанный в вогнутую поверхность, или обратное значение вписанного радиуса кривизны роговицы. Во время вогнутой фазы деформации рассчитывается центральный радиус кривизны роговицы, затем – обратный радиус (1/R) и площадь под ним. Далее определяется кривая зависимости радиуса от времени. Эта область называется интегрированным радиусом. Чем меньше вдавливание («жесткая» роговица), тем больше радиус вдавления, а значит, обратное значение этого радиуса меньше. Иными словами, чем выше жесткость роговицы, тем этот показатель ниже;
- SP-A1 – параметр жесткости для количественной оценки сопротивления роговицы деформации, определяемый как отношение нагрузки давления на роговицу к смещению между вершиной недеформированной роговицы и отклонению при первой аппланации, который измеряется в мм рт. ст./мм. Этот параметр описывается как смещение между вершиной роговицы в недеформированном состоянии и смещением роговицы при первой аппланации и является полезным индикатором устойчивости роговицы к деформации. Данный показатель, отражающий жесткость роговицы и внутреннюю биомеханику, зависит от уровня ВГД и ЦТР [2]. Считается, что более высокая жесткость роговицы отражает более высокую перипапиллярную жесткость склеры, а следовательно, большую уязвимость головки зрительного нерва [3].
В протоколе исследования помимо числовых значений трех биомеханических показателей (DA Ratio, Integr. Radius и SP-A1) представлено стандартное отклонение (SD) от средних значений нормативной базы. Если SD стремится к нулю, это говорит о среднем значении жесткости и косвенно свидетельствует о толерантном ВГД. Если SD отклоняется в сторону отрицательных значений, речь идет об увеличении жесткости ткани, и наоборот;
Stress Strain Index (SSI) – индекс напряжения и деформации, характеризующий жесткость роговицы. Этот фактор принят за 1,0 для среднего экспериментального поведения, полученного для ткани роговицы пациента в возрасте 50 лет. Более высокие значения SSI в этом случае свидетельствуют о более высокой жесткости ткани, и наоборот. SSI – скорректированный биомеханический индекс, который не зависит от ВГД и ЦТР, базируется на входных и выходных параметрах численного моделирования ЦТР, биомеханически скорректированного ВГД и SP (параметра жесткости) при максимальной вогнутости роговицы. Используется для оценки внутренней жесткости материала (ткани роговицы) [4].
BGF – биомеханический глаукомный фактор, характеризующий риск развития глаукомы при низких значениях ВГД. Его определение можно считать скринингом на глаукому низкого давления. Полученные значения BGF корректны только при нормальном офтальмотонусе (при высоком ВГД показатель минимальный). Согласно представленной шкале, значения до 0,25 указывают на отсутствие риска развития глаукомы, 0,25–0,5 – на минимальный риск развития глаукомы, более 0,5 – на высокий риск развития глаукомы при низком ВГД.
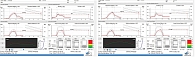
При осмотре острота зрения правого глаза – 0,3 с коррекцией sph +1,0 дптр, cyl-2,5 дптр ax71 = 0,6; левого глаза – 0,3 с коррекцией sph +1,0 дптр, cyl-2.0 дптр ax110 = 0,6. Переднезадняя ось правого глаза – 24,01 мм, левого – 23,86 мм. Толщина роговицы в центральной зоне выше средних значений – 638 мкм в правом глазу, 641 мкм – в левом. Уровень ВГД, определенный методом стандартной бесконтактной пневмотонометрии, в правом глазу – 34 мм рт. ст., в левом – 38 мм рт. ст. Биомеханически скорректированный уровень ВГД, полученный с использованием технологии Oculus CorVis ST, значительно ниже (рис. 1).
Отмечается значительное снижение показателей жесткости роговицы – DA Ratio до 3,0 (SD – 2,92) и Integr. Radius (IR) до 4,8 (SD – 2,87), а также возрастание жесткости фиброзной капсулы глаза – SP-A1 до 174,7 (SD – 2,92). Эти параметры коррелируют с ЦТР и уровнем ВГД. В данном случае имеет место физиологическая причина аномальных значений, связанная с толстой ЦТР, и патологическая, обусловленная повышенным офтальмотонусом. Индекс SSI составил 1,22 для обоих глаз, что существенно не отличается от средних значений.
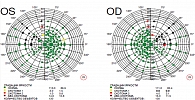
При исследовании светочувствительности сетчатки (рис. 2) выявлены сливные абсолютные парацентральные скотомы верхнетемпорально от точки фиксации.
По результатам В-сканирования обнаружены обширная колобома в центральном полюсе в обоих глазах и периферический ретиношизис в правом глазу (рис. 3).
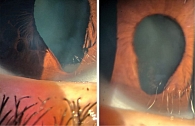
При осмотре оба глаза спокойные, роговица прозрачная, передняя камера умеренной глубины, влага прозрачная, радужка спокойная, зрачок каплевидной формы, подтянут к 6 часам (рис. 4). Хрусталики склерозированы, пигментные отложения на передней капсуле в левом глазу.
При осмотре глазного дна диск зрительного нерва монотонный, малого размера, умеренно проминирует в стекловидное тело, границы визуализируются в верхнем отделе, в нижнем отделе стушеваны, ход сосудистого пучка центральный. Перипапиллярно от нижней границы диска зрительного нерва обширная глубокая чашеобразная колобома сосудистой оболочки и склеры. В макулярной зоне рефлексы сглажены, видимая периферия сетчатки без очаговых изменений. Сосуды в ходе и диаметре не изменены.
При гониоскопии угол передней камеры открыт, среднеширокий, пигментация эндогенная слабой интенсивности.
Результаты ОКТ: макулярная зона без структурных изменений, ганглионарный клеточный комплекс в норме. ОКТ-признаки обширной колобомы сосудистой оболочки в нижненазальном секторе от края диска зрительного нерва. Параметры диска зрительного нерва искажены, визуально экскавация сглажена, физиологическая (рис. 5).
Данные, полученные при выполнении кератотопографии, представлены на рис. 6.
В правом глазу отмечаются слабая степень астигматизма в 1,1D и изменение топографии задней поверхности роговицы. В левом глазу астигматизм составил 0,9 D, наблюдаются изменения передней и задней поверхности роговицы.
С учетом результатов тонометрии пациентке на диагностическом приеме с гипотензивной целью была инстиллирована фиксированная комбинация бримонидина 0,2% и тимолола 0,5%. Через 30 минут уровень ВГД, установленный методом стандартной бесконтактной тонометрии, составил 27 мм рт. ст. в правом глазу (20,5% от исходного) и 28 мм рт. ст. – в левом (26,3% от исходного).
На основании результатов обследования пациентке был выставлен диагноз: врожденная патология органа зрения, колобома радужной оболочки, вторичная некомпенсированная глаукома, колобома сосудистой оболочки, гиперметропия слабой степени, сложный гиперметропический астигматизм, субклинический кератоконус обоих глаз, периферический ретиношизис правого глаза.
В качестве медикаментозной терапии выбрана фиксированная комбинация бримонидина 0,2% и тимолола 0,5% по одной капле два раза в сутки в оба глаза. Рекомендован контроль офтальмотонуса через семь дней для оценки гипотензивного эффекта.
Обсуждение
Данный клинический случай интересен тем, что верификация врожденной патологии органа зрения описана лишь в возрасте 50 лет. Это демонстрирует низкую мотивацию пациентов к диагностике и лечению. Данная проблема достаточно изучена и описана в зарубежных и отечественных работах [5, 6]. Авторы среди многих причин выделяют низкий уровень информированности о заболевании (51,9%). Предложены модели терапевтического обучения, в частности проведение школ глаукомного пациента и санитарно-просветительская работа [7].
Согласно нашим данным, пациенты даже с установленным диагнозом глаукомы (48%) нерегулярно посещают офтальмолога [8].
ВГД можно отнести к единственному контролируемому фактору риска развития и прогрессирования глаукомы, но вопрос точности тонометрических методик остается дискутабельным. Известен ряд факторов, влияющих на тонометрическое значение, в частности ЦТР и биомеханические свойства фиброзной оболочки [9]. В представленном случае обращает на себя внимание сложность интерпретации данных тонометрии из-за «толстой» ЦТР. Трудности проведения стандартных методик тонометрии определяют в таких случаях использование методики Corvis ST для получения более точных результатов уровня ВГД с учетом погрешностей, вносимых ЦТР.
Кроме того, важно отметить роль ОКТ в раннем выявлении и контроле прогрессирования первичной глаукомы. Как показали проведенные ранее отечественные исследования, применение только статической автоматической периметрии не позволяет выявить прогрессирование глаукомной оптической нейропатии, а сочетание ОКТ и периметрии повышает вероятность выявления прогрессии в полтора раза по сравнению с изолированным применением ОКТ [10].
Выбор терапии обоснован тем, что бримонидин доказал свою эффективность как в монорежиме, так и в составе комбинированной терапии [11]. Эффективность бримонидина и его фиксированных комбинаций показана при различных формах глаукомы, в том числе вторичных [12]. Помимо снижения офтальмотонуса доказано влияние на стабилизацию светочувствительности сетчатки [13], венозную гемоциркуляцию [14]. Известно также о нейропротекторном эффекте комбинации, доказанном в исследованиях in vitro и in vivo. Фиксированная комбинация бримонидина и тимолола эффективна в качестве стартовой терапии у пациентов с первичной открытоугольной глаукомой [15] и офтальмогипертензией с невысоким исходным уровнем ВГД [16].
Прозрачность финансовой деятельности: исследование выполнено при поддержке гранта Минобрнауки России ФГБОУ ВО «МГТУ», приказ от 07.02.2014 № 66 (№ НП123-2024).
Конфликт интересов: отсутствует.
A.V. Malyshev, PhD. Prof., A.S. Apostolova, PhD, A.A. Sergienko, PhD, A.F. Teshev, G.Yu. Karapetov, PhD, M.K. Ashkhamakhova, B.N. Khatsukova
Maykop State Technological University
Scientific Research Institution – S.V. Ochapovsky Regional Clinic Hospital № 1, Krasnodar
Vision Care Clinic ‘3Z’, Krasnodar
Children's Regional Clinical Hospital, Krasnodar
Adygean Republican Clinical Hospital
Contact person: Anastasia S. Apostolova, apostolovan@mail.ru
A clinical case of diagnosis of newly diagnosed secondary glaucoma against the background of congenital pathology of the organ of vision in a patient aged 50 years is presented. This case is interesting because, despite the structural defects of the anterior segment of the eye, the congenital disease was detected at the age of 50 years. The patient at the age of 50 turned to an ophthalmologist for the first time after detecting an increased level of intraocular pressure (IOP) during a preventive examination. It was found out from the anamnesis that vision has been reduced since childhood, she did not use correction, she was not observed by an ophthalmologist. In this case, there were difficulties in interpreting the results of tonometry, since the patient had a ‘thick’ central thickness of the cornea. Oculus CorVis ST technology was used to assess ophthalmotonus, which allows to establish a biomechanically adjusted IOP level. Based on the results of the examination, the patient was diagnosed with congenital pathology of the visual organ, iris coloboma, secondary uncompensated glaucoma, vascular coloboma, mild hypermetropia, complex hypermetropic astigmatism, subclinical keratoconus of both eyes, peripheral retinoschisis of the right eye.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.