Вульвовагинальные инфекции: почему специалисты выбирают комбинированные препараты?
- Аннотация
- Статья
- Ссылки
Заседание «Как предупредить рецидивы урогенитальной инфекции? От лечения к профилактике через предикцию» состоялось в рамках ХVI Общероссийского семинара «Репродуктивный потенциал России: версии и контраверсии» и вызвало большой интерес участников.
Заседание «Как предупредить рецидивы урогенитальной инфекции? От лечения к профилактике через предикцию» состоялось в рамках ХVI Общероссийского семинара «Репродуктивный потенциал России: версии и контраверсии» и вызвало большой интерес участников.







Модератор секции Е.В. Радзинский, д.м.н., профессор, член-корр. РАН, заведующий кафедрой акушерства и гинекологии с курсом перинатологии РУДН, вице-президент Российского общества акушеров-гинекологов, обозначил главные проблемы и вызовы для специалистов в области гинекологии и репродуктологии: «В последние 35–40 лет в Москве и, в меньшей степени, в регионах началось «расслоение» профессии акушера-гинеколога на акушера и гинеколога. Врачи женских консультаций перестали дежурить в стационарах. В России приблизительно 35 тысяч акушеров-гинекологов, из них около 24 тысяч – сотрудники амбулаторных лечебных учреждений, остальные неравномерно распределены по гинекологическим и родильным стационарам. Изменить ситуацию мы не можем».
Основным поводом, по которому пациентки обращаются к амбулаторному специалисту, являются патологические влагалищные выделения. Ряд многоцентровых исследований показал, что в России женщина, страдающая патологическими белями, проходит 4–5 врачей.
Доклад «Рецидивы вагинитов и вагинозов: как покорить дистанцию» представила профессор Е.Н. Андреева, д.м.н., заместитель директора Национального медицинского исследовательского центра эндокринологии, директор Института репродуктивной медицины, заведующая отделением эндокринной гинекологии.
Елена Николаевна напомнила, что многообразие микроорганизмов во влагалищной микробиоте зависит от ряда факторов, например, от национальности / этнической группы, биогеографического местоположения, особенностей образа жизни, эпигенетики [1]. Афроамериканки и латиноамериканки, например, имеют более высокий рН влагалища, независимо от наличия или отсутствия клинической инфекции.
«Как акушер-гинеколог, эндокринолог, я подчеркну, что состав микробиоты влагалища динамичен и претерпевает изменения, соответствующие гормональным колебаниям в течение всей жизни женщины: от полового созревания до менопаузы и во время беременности. В препубертатном микробиоме влагалища преобладают анаэробы, кишечная палочка, дифтероиды и коагулазонегативные стафилококки, для которых комфортным является низкий уровень гликогена», – сообщила эксперт. В период полового созревания увеличение уровня эстрогена способствует пролиферации и накоплению гликогена в эпителиальных клетках влагалища. Lactobacillus запускают синтез гликогена, он метаболизируется человеческой α-амилазой в мальтозу, мальтотриозу и α-декстрины, которые преобразуются в молочную кислоту (D- и L-виды) [2]. Это создает кислую среду (рН 3,5–4,5), способствующую росту лактобацилл за счет других видов анаэробных бактерий. Доминирование лактобацилл уменьшается по мере снижения уровня эстрогена после менопаузы [2].
Е.Н. Андреева отметила, что влагалищная молочная кислота имеет преимущественно бактериальное происхождение. В частности, лактобациллы продуцируют до 15% L- и D-молочной кислоты [3]. «Важно помнить, что D-молочная кислота предотвращает инфекцию верхних половых путей путем модулирования L-молочной кислотой индукции металлопротеиназы внеклеточного матрикса из эпителиальных клеток влагалища».
Докладчик перечислила факторы риска нарушений микробиоты влагалища: стресс, прием антибиотиков, гормональная терапия, эндокринные нарушения, аллергические заболевания, снижение иммунной защиты организма, хронические запоры, инфекции мочевых путей, спринцевания, половой акт, частая смена половых партнеров, аногенитальные контакты, длительные маточные кровотечения, инородные тела во влагалище (тампоны, пессарии) [4]. Стресс активирует ось гипоталамус – гипофиз – надпочечник, начинается секреция кортикотропин-рилизинг-гормона из гипоталамуса, высвобождение кортизола из коры надпочечников и норадреналина из симпатических нервных окончаний. Кортизол ингибирует связанное с эстрогеном созревание эпителия влагалища и накопление гликогена, что снижает доминирование лактобацилл, норадреналин действует синергически с иммунными медиаторами, усиливая высвобождение цитокинов [5]. Индуцированное стрессом повышение уровня кортизола и дезоксикортикостерона и связанное с этим уменьшение количества лактобацилл могут ухудшить вульвовагинальные симптомы инфекции. «В ситуации хронического стресса терапия может быть неэффективной», – резюмировала специалист.
Далее на примере нескольких клинических случаев профессор продемонстрировала использование такого подхода в практике. Например, пациентка 34 лет обратилась с жалобами на постоянный зуд во влагалище, периодические творожистые выделения, нарушения сна. В анамнезе у нее одна беременность, один аборт, половую жизнь отрицает. Пациентка рассказала, что испытывает постоянный стресс. При обследовании в мазке были обнаружены С. albicans 105 КОЕ/мл, пациентка получала местную и пероральную терапию антимикотиками, эффект был временным, через некоторое время возникали рецидивы. Больной поставили диагноз «рецидивирующий вульвовагинальный кандидоз» (ВВК), назначен препарат Ломексин (фентиконазол) в дозе 1000 мг во влагалище на ночь, рекомендована консультация психотерапевта.
Профессор Е.Н. Андреева объяснила выбор препарата: «В последние годы отмечается снижение чувствительности Candida spp. к флуконазолу, клотримазолу и повышение эффективности терапии фентиконазолом. Ломексин, в отличие от аналогов, активен в отношении C. albicans, C. glabrata, C. parapsilosis и C. krusei, а также бактерий, с которыми кандида образует ассоциации, вырабатывая защиту против лекарственных агентов». Спектр действия основных препаратов-антимикотиков представлен в таблице 1.
Благодаря широкому спектру активности Ломексин широко используется для лечения вагинального кандидоза, включен в клинические рекомендации большинства профессиональных медицинских обществ, в том числе Национального института здравоохранения и повышения квалификации Великобритании (NICE) [6].
Большинство возбудителей вульвовагинальных инфекций существуют в организме в составе биопленок. Существование ассоциаций грибов и бактерий в биопленках – один из возможных механизмов рецидивирующего ВВК [7]. Ломексин применяется для его лечения вследствие доказанной эффективности в отношении кандид, частых возбудителей суперинфекций и рецидивов, Trichomonas vaginalis [8]. Основным критерием эффективности лечения BBK является отсутствие рецидивов. После лечения препаратом Ломексин рецидивы отсутствовали у 83,6% женщин, клотримазолом – только у 69,2% [9].
Докладчик обратила внимание на связь стресса, гормональных изменений с воспалительными процессами во влагалище. Было показано, что воспаление и иммунитет женской половой системы гормонозависимы и связаны с фазами менструального цикла [10]. Также доказано, что высокий индекс массы тела увеличивает вероятность рецидивирования вагинита [10].
Профессор Е.Н. Андреева привела пример пациентки 23 лет с жалобами на частые обострения кольпита, нерегулярные менструации, мажущие кровянистые выделения в дни предполагаемой менструации, рост волос вдоль белой линии живота. В 17 лет у нее диагностировали повышение уровня тестостерона и снижение уровня глобулина, связывающего половые гормоны. Она получала витаминотерапию, дидрогестерон без эффекта. Половую жизнь ведет с 22 лет, беременности не было. Предварительно ей диагностировали синдром поликистозных яичников, хронический вагинит, цервицит, ожирение I стадии. По данным обследования были обнаружены нарушенная толерантность к глюкозе, в мазках флоры влагалища – лейкоциты 30–40 в поле зрения, кокки. Пациентке рекомендованы: прием метформина, в качестве местной терапии неспецифического кольпита – препарат Тержинан по 1 таблетке во влагалище на ночь в течение 10 дней. Также ей была назначена консультация диетолога, чтобы добиться снижения веса на 10% от исходного. Докладчик подчеркнула, что «в данном клиническом случае сочетаются ожирение и нарушение углеводного обмена, что является фактором риска развития рецидивирующих неспецифичных вагинитов. У женщин с ожирением «особенный» бактериальный вагиноз (БВ)». Чем выше балл по индексу НОМА (Homeostatis model assessment – метод оценки гомеостатической модели), тем выше риск дисбиоза во влагалище, первичного и рецидивирующего ВВК. Изменения во влагалищной флоре из-за снижения уровня эстрогена (по разным причинам) могут привести к колонизации грамотрицательными палочками, которые, в свою очередь, провоцируют развитие симптомов раздражения [11].
У третьей пациентки, о которой рассказала профессор Е.Н. Андреева, были жалобы на желтоватые выделения из половых путей с неприятным запахом, периодическую диспареунию. Она получала дидрогестерон по поводу нерегулярных менструаций, цикл восстановился. Пациентка планировала беременность, вела половую жизнь без предохранения в течение 4 мес. В анамнезе узловой зоб, эутиреоз. В мазке на флору было обнаружено 20–30 лейкоцитов, скудное количество палочек, единичные кокки. Гонококки, трихомонады, ключевые клетки не были обнаружены. Прошла курс терапии метронидазолом и миконазолом с временным эффектом, обратилась повторно в связи с рецидивом. Ей был поставлен диагноз «хронический вагинит, цервицит», выполнено ПЦР-исследование на наличие хламидий, генитальной микоплазмы, трихомонад, гонококков. До получения результатов ей назначили 10-дневный курс лечения препаратом Тержинан по 1 таблетке на ночь. У пациентки были обнаружены хламидии и трихомонады, назначено дообследование, прием Джозамицина, продолжен прием препарата Тержинан.
Специалист подчеркнула, что нельзя рассматривать проблему нормализации влагалищного статуса без оценки качества жизни женщины, соматического анамнеза и сексуального здоровья пары. Наиболее предпочтительным для терапии является препарат с широким спектром действия и отсутствием системного влияния – например, Тержинан. А.М. Савичева, Е.В. Спасибова провели оценку чувствительности 516 штаммов, выделенных из влагалища женщин репродуктивного возраста, к препарату Тержинан. Большинство изолятов G. vaginalis и А. vaginae оказались к нему чувствительны, что коррелирует с данными о высокой эффективности лечения препаратом Тержинан баквагиноза (БВ). Candida albicans также была чувствительна к препарату как в цельном виде, так и в разведениях в 10 и 100 раз. Был зафиксирован 100% эффект в отношении всех тестированных грамотрицательных микроорганизмов, включая бактерии семейства Enterobacteriaceae [12]. Отмечалась также высокая чувствительность стафилококков, в том числе и Staphylococcus aureus, и Actinomyces urogenitalis.
Профессор Е.Н. Андреева перечислила преимущества местной терапии: минимальный риск побочных реакций, простота и удобство применения, отсутствие противопоказаний (кроме индивидуальной непереносимости). Местная терапия предпочтительна при банальной неспецифической инфекции, сочетании с грибковой инфекцией или БВ.
Присутствие стероидов в вагинальных таблетках повышает эффективность терапии. Этим обусловлено присутствие в комбинированном препарате Тержинан преднизолона натрия метасульфобензоата. Этот компонент характеризуется отсутствием системного эффекта (что обеспечивает высокий профиль безопасности), является субстратом для синтеза эндогенного эстрогена, нормализует секрецию IgA, улучшает местный гуморальный иммунитет, микроциркуляцию в слизистой оболочке влагалища, уменьшает экссудацию и улучшает проникновение в ткани антибактериальных компонентов [13]. Другой входящий в состав препарата компонент – нистатин улучшает ультраморфологию слизистой влагалища, играет важную роль в защите от С. albicans путем усиления регуляции клеточного ответа, связанного с IFN-ү, сигнального пути IL-17 и, возможно, посредством усиления иммунитета [14].
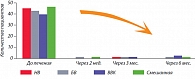
В исследовании В.Н. Прилепской были изучены отдаленные результаты лечения различных вагинальных инфекций препаратом Тержинан. Более чем у 97% пациенток через 6 мес. после лечения не было рецидивов (рис. 1) [15].
В заключение Е.Н. Андреева подчеркнула, что у пациенток с выделениями из половых путей «в первую очередь необходимо выявить возбудитель и подобрать рациональное лечение. Также важно учитывать вероятность коморбидной патологии и психологический статус пациентки. Только так мы сможем предупредить рецидивы заболевания».
Доклад «Альянс клинициста и микробиолога в решении практических клинических задач: вагинит и вагиноз. Периоды повышенного риска: беременность, бесплодие, оперативное лечение» представили А.М. Савичева, д.м.н., профессор, заведующая кафедрой клинической лабораторной диагностики ФП и ДПО Санкт-Петербургского государственного педиатрического медицинского университета, и Н.И. Тапильская, д.м.н., профессор Санкт-Петербургского государственного педиатрического медицинского университета, НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта (Санкт-Петербург).
Профессор Тапильская начала с сообщения о том, что в настоящее время считается, что БВ, эндометрит, воспалительные заболевания органов малого таза и бесплодие имеют общие патогенетические механизмы развития патологического процесса.
Цервикальная микробиота, воспаление, особенность иммунного ответа и, как следствие, фиброз тканей эндометрия способствуют бесплодию. Необходимо лечить симптомный БB и, возможно, бессимптомный, чтобы предотвратить его последствия, повышающие риск бесплодия [17].
БВ встречается у 29% женщин 14–49 лет. Главным отличием БB от аэробного вагинита является отсутствие воспаления. Существенную роль в эпидемиологии БВ играют возраст, половые контакты, этническая принадлежность [18].
Н.И. Тапильская поделилась данными, что у 58% женщин с эпизодом БВ отмечается рецидив данного заболевания в течение года. Среднее время до рецидива БВ в течение жизни составляет 6,9 года [19]. Есть данные о том, что БВ увеличивает риск цервикальной интраэпителиальной неоплазии (CIN) и способствует персистенции ВПЧ, может быть фактором риска ВИЧ-инфицирования [20].
Профессор А.М. Савичева, говоря о диагностике БВ, призвала акушеров-гинекологов начинать исследование на инфекции урогенитального тракта с определения кислотности, оценки микробиоценоза влагалища, цервикального канала и уретры. Отделяемое влагалища нужно исследовать на наличие лактобацилл, ключевых клеток, дрожжеподобных грибов, трихомонад, изучить соотношение лейкоцитов и клеток эпителия. Врачи-лаборанты должны уметь отличать ключевые клетки от ложноключевых. В норме в цервикальном канале и уретре должно быть менее 10 лейкоцитов в поле зрения.
При БВ наиболее часто встречающимся (в 60–90% случаев) условным патогеном является Gardnerella vaginalis. В настоящее время описано 2 типа этой бактерии: рассеянная форма, рассредоточенная среди другой микрофлоры, и сцепленная форма, адгезированная на клетках эпителия (ключевые клетки). Последняя образует на поверхности эпителия влагалища биопленки, хорошо защищающие бактерии от неблагоприятных факторов, обеспечивающие антибактериальную устойчивость, сложность эрадикации и возможности для рецидивов заболевания [21]. В 2019 г. предложена новая таксономическая классификация, устанавливающая, что род Gardnerella включает минимум 13 отдельных видов [22].
Профессор А.М. Савичева подчеркнула, что при БВ крайне важно разрушить биопленку, чтобы избежать рецидивирования заболевания. По данным C.S. Bradshaw, БВ рецидивирует в 30% случаев после терапии в течение 3 мес. и в 50% случаев спустя 12 мес. [24]. В литературе рецидив БВ определяется следующим образом: «По крайней мере три посещения клиники в течение предыдущих двух лет, которые позволяют установить диагноз рецидивирующего БB».
Н.И. Тапильская отметила, что есть данные, подтверждающие, что БВ – сексуально ассоциированное заболевание и для излечения может дополнительно проводиться лечение полового партнера. Проспективное клиническое исследование с участием 259 мужчин показало, что 39 пациентов имели БB-ассоциированную микробиоту, которая являлась этиологическим фактором неспецифических уретритов. Leptotrichia/Sneathia spp. были идентифицированы в 24 случаях [25]. «Исходя из этих данных, можно сделать вывод, что помимо несоблюдения режима лечения, потенциальной устойчивости к противомикробным препаратам, наличия стойкой цепкой биопленки, использования барьерной контрацепции во время лечения причинами рецидивирующего течения заболевания также могут быть особенности микробиоты партнера и параллельные половые связи», – отметила профессор Тапильская. В проспективном двойном слепом плацебо-контролируемом исследовании женщины, чьи партнеры принимали исследуемые препараты, имели риск рецидива БВ на 15% меньше [26].
Н.И. Тапильская и А.М. Савичева объяснили, почему обоснована эмпирическая терапия вагинита и как подобрать лечение до получения результатов лабораторного исследования. «80% женщин с вагинитами имеют смешанную микрофлору, даже если в анализах выявлен только один возбудитель. Поэтому препарат для лечения вагинита должен обладать максимальным спектром активности», – подчеркнула профессор Савичева.
Профессор Н.И. Тапильская напомнила, что эмпирическая терапия вагинита рекомендована клиническими рекомендациями «Воспалительные болезни шейки матки, влагалища и вульвы». Эффективность эмпирической терапии препаратом Тержинан подтверждена клинически: у принимавших его женщин снижалось количество лейкоцитов, увеличивалось количество лактобактерий. Большинство пациенток отметили снижение дискомфорта, прекращение зуда и жжения, все сообщили об устранении неприятного запаха [27].
Изучалось количество лактобацилл после курса приема Тержинана или антисептика беременными женщинами. После терапии Тержинаном через 30 дней количество лактобацилл увеличилось более чем в 10 раз, у 60% наблюдался рост L. crispatus. После терапии антисептиком у 35% не было роста лактобацилл или их количество оставалось низким [29].
Согласно российским клиническим рекомендациям 2020 г. Тержинан рекомендован к применению при БВ, ВВК и вульвовагинитах.
Также докладчики затронули тему лечения урогенитальных инфекций у беременных. «Поскольку бактериальный вагиноз – причина патологии беременности даже при отсутствии симптомов, увеличивает риск кровотечений, спонтанного невынашивания, преждевременных родов, преждевременного излития околоплодных вод, патологии в дыхательной и нервной системе, задержке развития плода, то необходимо назначать лечение как можно раньше», – подчеркнула профессор Тапильская.
Метаанализ исследований с участием 4155 женщин при сроке менее 20 нед. показал, что раннее лечение БВ способствует улучшению перинатальных исходов. У женщин, получавших лечение, частота преждевременных родов с низким (2500 г) и очень низким (1500 г) весом детей была ниже (3% против 5%) [30].
Наталья Игоревна привела данные, свидетельствующие, что комбинированные антибактериальные средства способствуют более стойкому эффекту по сравнению с антисептиками: у женщин с БВ в I триместре беременности через 10 дней после лечения препаратом Тержинан наблюдался стойкий терапевтический эффект, который усиливался через 30 дней после терапии. В то время как после лечения антисептиком почти у половины пациенток через 30 дней развивался рецидив [29].
Н.И. Тапильская напомнила, что оперативные вмешательства повышают инфекционные риски. Даже при условно-чистых оперативных вмешательствах возможны инфекционно-воспалительные осложнения. Они возникают в 5–25% случаев после хирургического аборта, в 7% случаев – после лапароскопических вмешательств, в 6–23% случаев – при экстирпации и надвлагалищной ампутации матки (условно-чистые операции) [31]. Снизить риск осложнений после гинекологических вмешательств помогает санация половых путей [32]. В качестве профилактики перед гинекологическими вмешательствами докладчики предложили использовать препарат Тержинан № 6. Он обеспечивает максимальный спектр активности против основных возбудителей и противовоспалительное действие.
Н.И. Тапильская и А.М. Савичева перечислили показания к применению препарата Тержинан: лечение вагинитов, вызванных чувствительными к препарату микроорганизмами, в том числе: БВ, трихомониаз влагалища, вагинит, вызванный грибами рода Candida, смешанный вагинит; профилактика урогенитальных инфекций/вагинитов, в том числе перед гинекологическими операциями, родами и абортами, до и после установки внутриматочных средств, до и после диатермокоагуляции шейки матки, перед гистерографией.
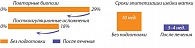
Применение Тержинана перед биопсией шейки матки способствует снижению риска посткоагуляционных осложнений с 18% до 0%, необходимости повторной биопсии с 29% до 0% и сокращает сроки эпителизации с 10 до 3–4 нед. (рис. 2).
У женщин после профилактической санации препаратом Тержинан уровень провоспалительных цитокинов снижался и оставался в этих же пределах через 3 нед. после биопсии, что способствовало более высокой скорости регенерации тканей и полноценной эпителизации шейки матки [33].
Далее с докладом «Кандидоз вульвы и влагалища с исходом в вульводинию. Не упустить!» выступил М.Р. Оразов, д.м.н., профессор кафедры акушерства и гинекологии с курсом перинатологии медицинского института РУДН. Он привел определение вульводинии: «Вульводиния – это клинический синдром мультифакториальной природы, характеризующийся дискомфортом в области вульвы в виде жгучей боли постоянного характера при отсутствии видимых изменений или клинически значимых неврологических нарушений».
Специалисты Международного общества по изучению боли в области малого таза (International Pelvic Pain Society, IPPS) придерживаются позиции, что вульводиния – ключевой фенотип хронической тазовой боли [34].
Вульводиния диагностируется после исключения других возможных причин болевого синдрома. IPPS в 2021 г. предложило несколько классификаций вульводинии по различным признакам. Например, по источнику возникновения выделяют: локализованную в области клитора, в преддверии влагалища, в области вульвы, смешанную; по происхождению: первичную, вторичную; по характеру течения: прерывистую, персистирующую, стойкую, немедленную, отложенную; по наличию провоцирующего фактора: провоцируемую, спонтанную (непровоцируемую), смешанную [34].
Наиболее распространенным видом вульводинии является спровоцированная боль, локализованная в области преддверия влагалища. Персистирующая боль в области вульвы может быть вызвана различными специфическими заболеваниями: инфекционными (рецидивирующий BBK, герпес); воспалительными (склерозирующий и красный плоский лишай); неопластическими (болезнь Педжета, плоскоклеточная карцинома); неврологическими (постгерпетическая невралгия, компрессия или повреждение нерва, неврома); травмой (акушерская травма промежности); ятрогенными причинами (послеоперационные осложнения, химиотерапия, радиация); гормональными нарушениями (генитоуринарный менопаузальный синдром, вульвовагинальная атрофия; лактационная аменорея и т. д.) [34].
С вульводинией могут быть связаны сопутствующие заболевания и другие болевые синдромы (синдром болезненного мочевого пузыря, фибромиалгия, синдром раздраженного кишечника, височно-нижнечелюстное расстройство), генетические детерминанты, гормональные факторы, заболевания скелетно-мышечной системы (гиперактивность мышц тазового дна). Вульводиния встречается у женщин с первичным ментальным дистрессом, тревожно-фобическими расстройствами и клинической депрессией [35].
Рецидивирующий ВBK является доказанным триггером развития вульводинии и сексуальных дисфункций. Данные исследований показывают, что у женщин, страдающих ВВК, достоверно выше частота сексуальных дисфункций, расстройств оргазма и депрессивных расстройств по сравнению со здоровыми женщинами [36]. «Поэтому нужно обращать внимание не только на вульвовагинальные симптомы, но и на сексуальную функцию и психическое здоровье пациенток с патологическими выделениями из половых путей, необходим комплексный подход к лечению», – сделал вывод специалист.
Было доказано, что кандидоз вульвы и влагалища – независимый предиктор сексуальных дисфункций у женщин репродуктивного возраста [37].
Профессор М.Р. Оразов привел клинический случай своей пациентки с жалобами на обильные выделения из половых путей, частыми обострениями – более 8 раз в год, снижением качества половой жизни, болями при половых контактах. В течение 2 лет она получала местную терапию антимикотическими средствами, 4 курса иммуномодулирующей терапии индукторами интерферона. Ей был поставлен диагноз «осложненный рецидивирующий кандидоз вульвы и вагины, диспареуния», рекомендован прием флуконазола 150 мг перорально 3 дозы с интервалом 72 ч (1, 4 и 7-й дни), далее для профилактики рецидивов прием флуконазола 1 раз в неделю в течение 6 мес., а также однократное введение вагинальной капсулы препарата Ломексин (фентиконазол) 1000 мг.
Профессор объяснил, что при осложненных формах ВВК, диспареунии требуется системная и местная терапия. Препаратом выбора является Ломексин, поскольку он обладает фунгицидным, фунгистатическим, противовоспалительным и антибактериальным эффектами, быстро и эффективно купирует симптомы ВВК. Достаточно однократного введения, так как препарат длительно сохраняется в области нанесения (даже через 72 ч концентрации достаточно для подавления инфекции) [38].
Для лечения ВВК достаточно 1 вагинальной капсулы препарата Ломексин1000 мг. При частых рецидивах используется упаковка с 2 капсулами по 600 мг. Также Ломексин выпускается в форме крема для вагинального и наружного использования и для полового партнера. Фентиконазол – действующее вещество крема Ломексин, обладает максимальной активностью в отношении Candida albicans по сравнению с миконазолом и клотримазолом [39].
Докладчик подробно рассказал о тактике лечения вульводинии: есть медикаментозные и немедикаментозные методы. К последним относится физиотерапия тазового дна. Она направлена на восстановление нормальной функции мускулатуры за счет усиления проприоцепции мышц, их релаксации, повышения эластичности и снижения чувствительности ноцицепторов. В качестве медикаментозного лечения при вульводинии нейропатического генеза могут быть назначены трициклические антидепрессанты, прегабалины, антиконвульсанты[40].
При вульводинии нейропатического генеза можно использовать комбинированную терапию, включающую аутоплазменную, лазерную ремодулирующую терапию, инъекции ботулинического токсина А, электрическую стимуляцию нервов, когнитивно-поведенческую терапию. Вариантами лечения могут быть: использование локальных анестетиков (2–5% раствора лидокаина), кремов с эстрогенами, инъекции в триггерные точки комбинации метилпреднизолона и бупивакаина [40]. Доказано, что инъекции 100 ЕД ботулинического токсина А (БТА) представляют собой эффективный метод лечения вестибулодинии с сохранением положительного результата в течение 2 лет. Введение БТА значительно уменьшает боль и оказывает благоприятное влияние на качество жизни и сексуальную функцию пациенток [40].
Женщинам с резистентностью к консервативной терапии вульводинии может принести пользу хирургическое вмешательство. В настоящее время эффективным способом лечения является локальное иссечение тканей вульвы (вестибулэктомия). Однако этот метод, как правило, используется в крайних случаях из-за его инвазивности и высокого риска развития осложнений. Сопоставимые по эффективности результаты показала и лазерная терапия.
Резюмируя, профессор М.Р. Оразов подчеркнул: «Лечение женщин с вульводинией должно быть индивидуализированным и мультидисциплинарным, включать не только медикаментозную терапию, но и различные методики ментальной коррекции. Пациенткам, страдающим патологическими выделениями из половых путей, необходимо проводить клинико-сексологическое тестирование с целью раннего выявления сексуальных дисфункций».
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.