количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Гиперадренергия как фактор риска неблагоприятных перинатальных исходов у беременных с нарушением жирового обмена
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №6
- Аннотация
- Статья
- Ссылки
Изучено течение беременности и перинатальных исходов у 100 женщин с нарушением жирового обмена и различной активностью симпатико-адреналовой системы в сравнении с практически здоровыми беременными женщинами с ИМТ < 27 кг/м2 (n = 20).
Показано, что чрезмерная активация симпатико-адреналовой системы у женщин основной группы (величина бета-адренорецепции мембран ≥ 70 усл. ед.) является одним из патологических факторов нарушения репродуктивной функции – у них бесплодие встречалось в 1,6 раза чаще, чем в группе контроля.
Нарушение жирового обмена и выраженная гиперсимпатикотония у беременных с ожирением являются неблагоприятными прогностическими факторами развития акушерских осложнений (у 95,6% женщин основной группы) и неблагоприятных перинатальных исходов (в 16,7% случаев).
Изучено течение беременности и перинатальных исходов у 100 женщин с нарушением жирового обмена и различной активностью симпатико-адреналовой системы в сравнении с практически здоровыми беременными женщинами с ИМТ < 27 кг/м2 (n = 20).
Показано, что чрезмерная активация симпатико-адреналовой системы у женщин основной группы (величина бета-адренорецепции мембран ≥ 70 усл. ед.) является одним из патологических факторов нарушения репродуктивной функции – у них бесплодие встречалось в 1,6 раза чаще, чем в группе контроля.
Нарушение жирового обмена и выраженная гиперсимпатикотония у беременных с ожирением являются неблагоприятными прогностическими факторами развития акушерских осложнений (у 95,6% женщин основной группы) и неблагоприятных перинатальных исходов (в 16,7% случаев).
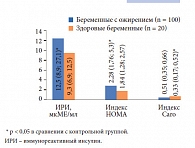
Рис. 1. Показатели инсулинорезистентности у беременных основной и контрольной групп (Ме (25%; 75%))
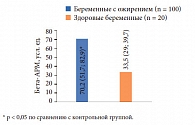
Рис. 2. Средние значения бета-АРМ в обследуемых группах (Ме (25%; 75%))
Ожирение является одной из самых распространенных форм нарушений жирового обмена и имеет неуклонную тенденцию к росту, в том числе у беременных. Так, по различным данным, частота ожирения у беременных составляет 15–38% [1]. Ожирение входит в качестве обязательного компонента в симптомокомплекс, называемый метаболическим синдромом, в основе которого лежат инсулинорезистентность и компенсаторная гиперинсулинемия, напрямую связанные с повышением функциональной активности симпатико-адреналовой системы (САС) [2–4]. Жировая ткань относится к инсулинчувствительным тканям и является одной из главных участниц процессов реализации функциональной активности многих гормонов [5, 6]. Адипоциты жировой ткани имеют на плазматической мембране b3-адренорецепторы.
Исследования, определившие фармакологические свойства данного типа мембранных рецепторов, рассматривают теорию о взаимосвязи между некоторыми гормонами и биогенными катехоламинами, участвующими в регуляции как нервной, так и эндокринной функций организма [7, 8]. Высокая плотность b3-адренорецепторов и низкая плотность инсулиновых рецепторов на поверхности адипоцитов висцеральной жировой ткани обусловливают выраженную активность липолитических процессов в ней. Периферическая гиперсимпатикотония, сопровождающая активацию центральных отделов САС, приводит, в свою очередь, к активации b-рецепторов юкстагломерулярного аппарата и повышенной выработке ренина. Постоянная гиперсимпатикотония способствует задержке натрия и жидкости, нарушению микроциркуляторного русла в скелетных мышцах и сердце в виде снижения количества функционирующих капилляров. Уменьшение же числа адекватно кровоснабжаемых миоцитов, участвующих в утилизации глюкозы в организме, ведет к нарастанию инсулинорезистентности и гиперинсулинемии, что замыкает порочный круг.
Согласно гипотезе L. Landsberg (1999), активность САС регулируется инсулинконтролируемым захватом глюкозы в нейронах вентромедиальных ядер гипоталамуса, что уменьшает их тормозное влияние на центры симпатической нервной системы ствола мозга [9]. В физиологических условиях этот механизм является регуляторным, но при гиперинсулинемии, обусловленной ожирением, способствует стойкой активации САС. Ожирение и гиперактивация САС негативно отражаются на функции различных органов и систем организма, способствуя развитию экстрагенитальных заболеваний и снижению активности иммунной системы, что повышает риск патологического течения беременности, осложнений в родах и послеродовом периоде и неблагоприятных перинатальных исходов [10]. Целью настоящего исследования явилась оценка течения беременности и перинатальных исходов у женщин с нарушением жирового обмена и различной активностью симпатико-адреналовой системы.
Материал и методы
В исследование включено 120 беременных (средний возраст 30 (26; 34) лет) в сроки 16–24 недели беременности, подписавших информированное согласие. Из них 100 пациенток были с нарушением жирового обмена (до беременности индекс массы тела (ИМТ) ≥ 27 кг/м2), которые составили основную группу, и 20 практически здоровых беременных с ИМТ < 27 кг/м2, вошедших в контрольную группу. Из 120 женщин 20 пациенток группы контроля и 72 беременные основной группы наблюдались в динамике с момента включения в исследование до родов. Адренореактивность организма исследовали по величине бета-адренорецепции мембран (бета-АРМ) методом, основанным на изменении степени гипоосмотического гемолиза эритроцитов в присутствии адреноактивного вещества, набором реагентов АРМ-АГАТ (ООО «Агат-Мед», Москва) [11]. В качестве параметров, характеризующих инсулинорезистентность, определяли индекс HOMA (Homeostasis Model Assessment of Insulin Resistance – математическая гомеостатическая модель для оценки резистентности к инсулину) и индекс Caro.
Все женщины находились под динамическим наблюдением акушера-гинеколога, были родоразрешены в большинстве случаев в специализированном родильном доме для беременных с кардиоваскулярной патологией. Проводили анализ течения беременности, родов, послеродового периода, оценивали состояние новорожденных по шкале Апгар на 5-й минуте жизни и их антропометрические данные. Статистическую обработку полученных данных осуществляли с помощью пакета Statistica 6.0 (StatSoft Inc., США). Для сравнения результатов трех или более независимых групп при непараметрическом распределении использовали метод Краскела – Уоллиса, при p < 0,05 использовали тест Манна – Уитни. Оценку достоверности значений для трех зависимых групп проводили с помощью непараметрического метода Фридмана, при p < 0,05 использовали тест Вилкоксона. Оценка межгрупповых различий по качественным порядковым и бинарным признакам проводилась с использованием критерия χ2 или точного одностороннего критерия Фишера. Для анализа корреляции двух признаков при непараметрическом распределении использовали метод Спирмена (О.Ю. Реброва, 2002). Для всех видов анализа статистически достоверными считались значения при p < 0,05 для двусторонних критериев.
Результаты и их обсуждение
Антропометрические данные наблюдаемых пациенток полностью соответствовали критериям включения: в основной группе вес женщин до беременности составил 95,22 ± 1,68 кг и ИМТ 34,1 ± 0,7 кг/м2, в контрольной – 58,60 ± 1,23 кг и 21,8 ± 0,3 кг/м2 соответственно (p < 0,001). По данным акушерского анамнеза, большинство женщин основной группы были повторнобеременными (61 чел.; 61%). Отягощенный акушерский анамнез чаще наблюдался в основной группе (48 чел.; 48%): самопроизвольное прерывание беременности в разные сроки было у 16,4% женщин (10 чел.) и практически в одинаковом проценте случаев в основной и контрольной группах (в 1-й группе – у 6 женщин; 18% и во 2-й группе – у 4 женщин; 15%). У 3 (5%) пациенток основной группы беременность завершалась выкидышем (дважды), из них у 1 женщины – после экстракорпорального оплодотворения. Неразвивающаяся беременность была у 5 (8%) женщин, из них в сроки 21–28 недель гестации – у 3% (2 женщины из 2-й группы) и в сроке до 8 недель гестации – у 3 женщин (5%), у одной из них дважды. Отметим, что среди повторнородящих женщин с ожирением (42 чел.) осложнения во время беременности и/или родов встречались у 91% (38 чел.).
У подавляющего числа беременных с ожирением была выявлена отягощенная наследственность по сердечно-сосудистым заболеваниям и метаболическим нарушениям: артериальная гипертония (АГ) у одного или обоих родителей встречалась в 77% случаях (77 чел.), нарушение мозгового кровообращения – в 3% (3 чел.), ожирение – в 83% (83 чел.), сахарный диабет – в 34% (34 чел.), другая эндокринная патология – в 17% (17 чел.). Среди сопутствующей патологии стоит отметить большой процент случаев АГ (64 жен., 64%), при этом у 19 женщин (19%) впервые повышение артериального давления было выявлено в детском или подростковом возрасте, у 45 пациенток (45%) – в возрасте старше 18 лет, и, что важно отметить, у 18 женщин (18%) АГ была диагностирована во время предыдущей беременности. Наличие АГ является неотъемлемой частью метаболического синдрома. АГ может дебютировать на различных этапах его развития, но основной патогенетический механизм этих процессов един – инсулинорезистентность, что в нашем исследовании подтвердилось показателями инсулинорезистентности: индексы HOMA и Caro у женщин с ожирением были достоверно повышенными в сравнении с контрольной группой весь период наблюдения (рис. 1).
Экстрагенитальные заболевания у женщин с ожирением, по статистическим данным, встречаются гораздо чаще, чем в здоровой популяции, что подтвердилось результатами и нашего исследования. Так, патология шейки матки, воспалительные гинекологические заболевания, нарушение репродуктивной функции превалировали в группе беременных с ожирением, дисфункция яичников имела место у 50%. Исследование адренореактивности организма как одного из параметров функционального состояния САС показало, что индивидуальные значения величины бета-АРМ у пациенток обеих групп находились в широком диапазоне – от 21 до 90 усл. ед., вместе с тем у беременных с ожирением средние значения величины бета-АРМ превышали в 2 раза этот показатель группы контроля (рис. 2).
Отметим, что в группе женщин с величинами бета-АРМ ≥ 70 усл. ед., что отражало выраженную десенситизацию адренорецепторов в условиях чрезмерной активации САС, бесплодие встречалось в 1,6 раза чаще, чем в группе беременных c бета-АРМ < 70 усл. ед. (χ2 = 4,21, p = 0,040). На наш взгляд, на основании этого наблюдения можно сделать чрезвычайно важные с практической точки зрения выводы, основанные на том, что чрезмерная активация САС является одним из патологических факторов нарушения репродуктивной функции. Анализ течения беременности, родов и перинатальных исходов проведен у 78 пациенток с ожирением и у 20 практически здоровых беременных. Так, в основной группе из 65,5% завершившихся беременностей было 5,5% прерванных беременностей (2 самопроизвольных выкидыша на сроке 21–22 недели и 1 замершая беременность). Из 52 родов в этой группе имело место 2 неблагоприятных исхода (3,8%): 1 случай внутриутробной гибели плода на 37-й неделе, 1 экстренное родоразрешение на сроке 26 недель в связи с внутриутробным инфицированием с перинатальной гибелью плода на 21-е сутки.
В группе контроля из 10 родов (71% завершившихся беременностей) только один неблагоприятный исход – экстренное оперативное родоразрешение на сроке 22 недели с перинатальной гибелью на 5-е сутки. У женщин с ожирением родоразрешение произошло раньше в среднем на 2,3 недели, а в группе с уровнем бета-АРМ ≥ 70 усл. ед. – на 2,8 недели, чем у практически здоровых женщин. Следует подчеркнуть, что у беременных с ожирением достоверно чаще наблюдались преждевременные роды (21,8% против 0%) и оперативное родоразрешение (43,6% против 5%), среди показаний к которому в группе беременных с уровнем бета-АРМ ≥ 70 усл. ед. превалировало наряду с АГ наличие акушерских осложнений. Кроме того, в основной группе чаще имело место нарушение маточно-плодово-плацентарного кровотока (у 44%) и плацентации (31%), преждевременное старение плаценты (8%), повышенный тонус матки (41%). Отслойка нормально расположенной плаценты возникла у 13 женщин с ожирением (13%), что привело к неблагоприятным исходам 3 беременностей (23%) из 13 случаев. При этом в группе беременных с уровнем бета-АРМ ≥ 70 усл. ед. частота нарушений плацентации наблюдалась в 2 раза выше (χ2 = 6,91; p = 0,009). У беременных с уровнем бета-АРМ ≥ 70 усл. ед. в 2 раза чаще отмечалось наличие тазового предлежания плода и в 4 раза – синдром внутриутробной задержки развития плода.
Интересные данные, соответствующие и другим анализируемым параметрам, были получены при оценке перинатальных исходов. По срокам родоразрешения в группе контроля было 17,3% недоношенных беременностей, 63,5% – доношенных и 19,2% – переношенных, в основной – количество недоношенных беременностей было достоверно выше – 30%, переношенных беременностей не зафиксировано. В целом у женщин с ожирением количество недоношенных детей в сравнении с группой контроля было выше в 1,9 раза. Антропометрические данные новорожденных, как и ожидалось, оказались выше в группе контроля: средний вес 3044 г против 2721 г, средний рост 52 см против 48 см основной группы.
Таким образом, нарушение жирового обмена и выраженная гиперсимпатикотония (бета-АРМ ≥ 70 усл. ед.) у беременных с ожирением являются неблагоприятными прогностическими факторами развития акушерских осложнений, которые выявлены у 95,6%, в том числе у 78,4% в родах (нарушение плацентации – 44%, отслойка нормально расположенной плаценты – 13%, внутриутробная задержка развития плода – 9%, преждевременные роды – 25%) и неблагоприятных перинатальных исходов у 16,7% (5,6% – антенатальная и 2,8% – неонатальная гибель плода, 8,3% – пороки развития). Резюмируя вышесказанное, следует признать существование тесной зависимости между гиперадренергическим состоянием беременных, степенью выраженности ожирения и их влиянием на течение беременности. Все вышеизложенное диктует необходимость тщательного мониторинга клинического состояния и течения беременности у женщин с ожирением и чрезмерной активацией САС с целью своевременного вмешательства для предупреждения неблагоприятных осложнений как со стороны женщины, так и со стороны плода и новорожденного.
1. Wolf M., Sandler L., Muñoz K. et al. First trimester insulin resistance and subsequent preeclampsia: a prospective study // J. Clin. Endocrinol. Metab. 2002. Vol. 87. № 4. P. 1563–1568.
2. Reaven G.M. Banting lecture 1988. Role of insulin resistance in human disease // Diabetes. 1988. Vol. 37. № 12. P. 1595–1607.
3. Алмазов В.А., Благосклонная Я.В., Шляхто Е.В. и др. Метаболический сердечно-сосудистый синдром. СПб: Издательство СПбГМУ, 1999.
4. Isomaa B., Almgren P., Tuomi T. et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome // Diabetes Care. 2001. Vol. 24. № 4. P. 683–689.
5. Ferrannini E., Buzzigoli G., Bonadonna R. et al. Insulin resistance in essential hypertension // N. Engl. J. Med. 1987. Vol. 317. № 6. P. 350–357.
6. Ferrannini E., De Fronzo R.A. The association of hypertension, diabetes and obesity: a review // J. Nephrol. 1989. № 1. P. 3–15.
7. Díez J.J., Iglesias P. The role of the novel adipocyte-derived hormone adiponectin in human disease // Eur. J. Endocrinol. 2003. Vol. 148. № 3. P. 293–300.
8. López-Bermejo A., Botas P., Funahashi T. et al. Adiponectin, hepatocellular dysfunction and insulin sensitivity // Clin. Endocrinol. (Oxf.). 2004. Vol. 60. № 2. P. 256–263.
9. Landsberg L. Role of the sympathetic adrenal system in the pathogenesis of the insulin resistance syndrome // Ann. N.Y. Acad. Sci. 1999. Vol. 892. P. 84–90.
10. Луценко Н.С. Беременность и роды у женщин с ожирением. Киев: Здоровья, 1986. 285 с.
11. Стрюк Р.И., Длусская И.Г. Адренореактивность и сердечно-сосудистая система. М.: Медицина, 2003. 160 с.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Изучено течение беременности и перинатальных исходов у 100 женщин с нарушением жирового обмена и различной активностью симпатико-адреналовой системы в сравнении с практически здоровыми беременными женщинами с ИМТ < 27 кг/м2 (n = 20).
Показано, что чрезмерная активация симпатико-адреналовой системы у женщин основной группы (величина бета-адренорецепции мембран ≥ 70 усл. ед.) является одним из патологических факторов нарушения репродуктивной функции – у них бесплодие встречалось в 1,6 раза чаще, чем в группе контроля. Нарушение жирового обмена и выраженная гиперсимпатикотония у беременных с ожирением являются неблагоприятными прогностическими факторами развития акушерских осложнений (у 95,6% женщин основной группы) и неблагоприятных перинатальных исходов (в 16,7% случаев).
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
