Метаболический синдром: конфликт провоспалительных цитокинов
- Аннотация
- Статья
- Ссылки
В статье описаны патогенетические механизмы развития сахарного диабета (СД) 2 типа у пациентов с метаболическим синдромом (МС). Показаны причинно-следственные связи МС с инсулинорезистентностью, воспалением и ишемической болезнью сердца.
Приведены данные исследований применения метформина при лечении пациентов с МС и СД 2 типа. Рассмотрены преимущества новой пролонгированной формы метформина Глюкофаж Лонг, позволяющей повысить приверженность больных лечению.
В статье описаны патогенетические механизмы развития сахарного диабета (СД) 2 типа у пациентов с метаболическим синдромом (МС). Показаны причинно-следственные связи МС с инсулинорезистентностью, воспалением и ишемической болезнью сердца.
Приведены данные исследований применения метформина при лечении пациентов с МС и СД 2 типа. Рассмотрены преимущества новой пролонгированной формы метформина Глюкофаж Лонг, позволяющей повысить приверженность больных лечению.
В настоящее время метаболический синдром (МС) – одна из самых актуальных и часто обсуждаемых в научных медицинских кругах проблем. Тем не менее следует отметить, что подобной патологии в действующей Международной классификации болезней (МКБ-10) не существует. Метаболический синдром является собирательным понятием, которое объединяет группу заболеваний или патологических состояний, имеющих в основе своего развития общую причину. На этот счет можно дискутировать, поскольку существуют синдромы, включающие такие отдельно признаваемые нозологии, как артериальная гипертензия, мочекаменная болезнь, синдром поликистозных яичников, язвенная болезнь желудка. Однако если основным общим этиологическим фактором всех вышеперечисленных патологических состояний является избыток гормона коры надпочечников кортизола, то в данном случае диагностируется синдром Иценко – Кушинга, входящий в МКБ-10, и т.п.
МС представляют как совокупность заболеваний, имеющих в своей основе инсулинорезистентность (ИР), вследствие чего понятия «синдром инсулинорезистентности» и «метаболический синдром» вполне можно отождествить. Основным диагностическим маркером МС, как и ИР, является висцеральное ожирение, определяемое показателем окружности талии – более 80 см у женщин и более 94 см у мужчин. Гиперинсулинемия как проявление ИР способствует ожирению, и не случайно больные СД 2 типа имеют избыточную массу тела. Да и само ожирение – существенный фактор формирования ИР. Таким образом, налицо порочный круг.
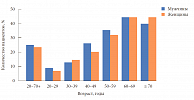
В 2005 г. Американская диабетологическая ассоциация (АDА) и Европейская ассоциация по изучению диабета (EASD) сделали следующее совместное заявление: «Проведенный нами анализ показывает, что в настоящее время не хватает слишком большого количества важной информации, чтобы называть это синдромом» [1]. За прошедшие после данного заявления годы было получено достаточно большое количество доказательств, позволяющих квалифицировать эту патологию как самостоятельный синдром. Особый интерес МС представляет для эндокринологов и кардиологов, так как нарушение углеводного обмена, ИР, артериальная гипертензия и дислипидемия при МС играют существенную роль в преждевременном развитии сердечно-сосудистых заболеваний и ассоциируются со значимым повышением риска ишемической болезни сердца (ИБС) [2]. Распространенность МС неоднородна у пациентов различных возрастных категорий (рис. 1) [3].
Актуальность детального изучения этой патологии и разработки методов ее эффективного лечения объясняется, в первую очередь, высокой распространенностью МС и связанным с ним риском ИБС. В последнее десятилетие активно изучается роль ИР в развитии воспаления. Одна из возможных причин взаимосвязи МС, ИР и воспалительного процесса – способность жировой ткани вырабатывать провоспалительные молекулы (цитокины). Они представляют собой гормоноподобные молекулы, секретируемые адипоцитами, в частности, фактор некроза опухоли альфа (ФНО-альфа), интерлейкин-6 (ИЛ-6) и интерлейкин-1 (ИЛ-1). Их источниками также могут быть макрофаги, мигрирующие в жировую ткань. Действие цитокинов на клетку-мишень опосредуется высокоспецифичными, высокоаффинными мембранными рецепторами. Цитокины определяют выживаемость клеток, стимуляцию или ингибирование их роста, дифференцировку, функциональную активность и апоптоз. После взаимодействия цитокинов с комплементарными рецепторами сигнал с поверхности клеток через элементы внутриклеточной трансдукции передается в их ядро, где активируются соответствующие гены.
Характерное для МС повышение показателей ингибитора активатора плазминогена-1 (ИАП-1), ФНО-альфа, ангиотензиногена, ИЛ-6 способствует развитию эндотелиальной дисфункции, вызывает системный оксидативный стресс. Так, ИАП-1 является главным циркулирующим ингибитором активатора тканевого плазминогена и урокиназы. Увеличение его содержания в плазме крови приводит к угнетению фибринолиза, повышению риска тромбоза, особенно коронарных артерий, нарушению функции эндотелия. Стоит отметить, что этот показатель является независимым предиктором инфаркта миокарда у мужчин.
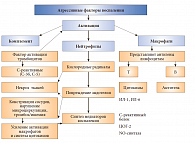
ФНО-альфа активирует JNK-киназу, которая, в свою очередь, фосфорилирует сериновые остатки в субстрате рецептора инсулина (IRS-1), подавляет фосфорилирование тирозина и тем самым тормозит инсулиновый сигнал. Повышение содержания ФНО-альфа в сыворотке крови, как правило, сочетается с наличием ожирения, ИР, увеличением концентрации С-реактивного белка и ИЛ-6, а также ускорением апоптоза клеток. Ген ФНО-альфа экспрессируется как в иммунных, так и в неиммунных клетках [4]. Хроническая гипергликемия активирует перекисное окисление липидов и способствует накоплению свободных радикалов, что приводит к поражению эндотелия сосудов. В крови появляются маркеры воспаления – С-реактивный белок, ФНО-альфа, увеличивается активность макрофагов. Перечисленные нарушения оказывают существенное влияние на возникновение и прогрессирование атеросклеротического процесса у больных с МС (рис. 2).
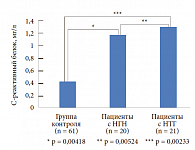
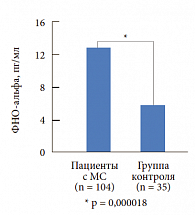
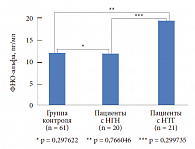
Нами была изучена концентрация С-реактивного белка в крови больных с МС с различными типами нарушения углеводного обмена. Исследуемые были разделены на 3 группы: в первую группу (контрольную) были включены здоровые лица без МС (61 чел.), во вторую группу – пациенты с нарушением гликемии натощак (НГН) (20 чел.), в третью группу – больные с нарушением толерантности к глюкозе (НТГ) (21 чел.). В результате исследования выявлена статистически достоверная зависимость между степенью нарушения углеводного обмена и концентрацией С-реактивного белка (рис. 3). Подобная зависимость была отмечена при изучении концентрации ФНО-альфа у тех же групп больных (рис. 4 и 5). У больных с МС по сравнению с контрольной группой отмечается статистически достоверное повышение ФНО-альфа (p < 0,00001). Изучение концентрации ФНО-альфа в зависимости от типа нарушения углеводного обмена (рис. 5) продемонстрировало повышение провоспалительного цитокина в 3-й группе. Традиционный подход к лечению МС включает мероприятия по снижению массы тела, в том числе изменение стереотипов питания, повышение физической активности.
При наличии у больных с МС клинически и лабораторно подтвержденного сахарного диабета рекомендуется медикаментозная терапия. В настоящее время препаратом выбора у таких пациентов является метформин (Глюкофаж), который не только воздействует непосредственно на ИР, но и имеет несколько положительных кардиоваскулярных и метаболических эффектов. Недавно полученные результаты на моделях in vitro и in vivo показали, что метформин обладает плейотропным действием и может применяться не только при СД, но и при других патологических состояниях: аутоиммунных, онкологических, сердечно-сосудистых заболеваниях [5–9]. Метформин обладает способностью активировать АМФ-активированную протеинкиназу макрофагов, что приводит к ингибированию синтеза фосфолипидов и снижению экспрессии провоспалительных цитокинов, таких как нейрональная NO-синтаза, циклооксигеназа-2 (ЦОГ-2), и медиаторов – оксида азота, простагландина Е2 (PGE2). Показано, что метформин в экспериментальной модели летальной эндотоксемии на культуре клеток и у крыс (введение липополисахарида) снижал концентрацию уровня ФНО-альфа и ИЛ-1-бета в сыворотке крови, а также увеличивал выживаемость животных в течение 2 недель [10]. Достоверно снижались уровни ИЛ-6 и С-реактивного белка [11].
Доказано, что уменьшение уровня ИЛ-6 сопровождается снижением ИР и веса пациентов, а также риска развития СД и инфаркта миокарда. Снижение концентрации С-реактивного белка способствует уменьшению риска развития ИБС, атеросклероза и прогрессирования СД 2 типа. Так, у пациенток с синдромом поликистозных яичников в группе терапии метформином в течение 6 недель отмечено значительное снижение индекса массы тела (ИМТ) и уровня С-реактивного белка [12].
Первичный антигипергликемический эффект метформина (Глюкофажа) вызван снижением продукции глюкозы клетками печени (глюконеогенез), угнетением процессов окисления жира, ингибированием выработки свободных жирных кислот (СЖК) и, частично, усилением захвата глюкозы периферическими тканями. Антигипергликемические эффекты препарата – результат его воздействия на чувствительность к инсулину клеток печени, мышечной и жировой ткани. Кроме того, метформин (Глюкофаж) обладает ангиопротекторным действием за счет улучшения реологических свойств крови (активация фибринолиза, торможение агрегации тромбоцитов, снижение вязкости крови). К дополнительным важным эффектам препарата следует отнести его свойство способствовать уменьшению массы тела, снижению артериального давления, а также положительное влияние на липидный обмен. Необходимо отметить, что абсолютная биодоступность метформина при пероральном приеме cоставляет 50–60%. При поступлении в кровоток препарат всасывается в верхних отделах желудочно-кишечного тракта и лишь незначительная его часть – в дистальных отделах пищеварительной системы. Всасывание метформина в тонком кишечнике является «насыщающимся», то есть при увеличении его концентрации в просвете кишечника выше определенного порогового уровня происходит так называемое насыщение всасывания и значительная часть препарата не абсорбируется вовсе. Таким образом, уровень всасывания метформина зависит от скорости его эвакуации из желудка.
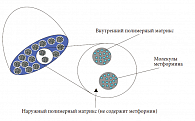
Вышеуказанные особенности определили необходимость разработки таблетированных форм метформина с замедленным высвобождением действующего вещества для однократного суточного приема. Традиционно используемые с подобной целью лекарственные формы обеспечивают замедление высвобождения активного вещества из таблетки, при этом его всасывание происходит на всем протяжении кишечника. Но даже в этом случае часто имеет место период относительно быстрого поступления препарата в кровоток вскоре после приема. Особая лекарственная форма метформина пролонгированного действия – Глюкофаж Лонг для однократного приема – позволяет обеспечить замедленное всасывание и поддержание системного действия препарата. Таблетки Глюкофаж Лонг созданы на основе уникальной технологии – гелевой диффузионной системы GelShield, представляющей собой матрицу из двух полимеров, которая обеспечивает постепенное и равномерное высвобождение метформина (рис. 6) [13].
В таблетке Глюкофаж Лонг внешний аморфный полимер, не содержащий метформин, окружает расположенные в нем гранулы внутреннего полимера, содержащие 500 мг метформина (система «гель внутри геля»). В желудочно-кишечном тракте таблетка подвергается гидратации и набухает, после чего метформин начинает постепенно высвобождаться из нее посредством диффузии. Время достижения максимальной концентрации в плазме (Tmax) метформина после приема таблетки Глюкофаж Лонг составляет 7 часов, что на 4 часа дольше, чем после приема традиционного препарата с немедленным высвобождением метформина [13].
На сегодняшний день одной из серьезных проблем в лечении пациентов с СД 2 типа остается полипрагмазия. Данные исследований ACCORD, ADVANCE, PROactive и RECORD показали, что 60–75% пациентов с СД 2 типа принимают до 5 препаратов одновременно с целью снижения кардиоваскулярного риска. Однократный прием препарата в сутки, безусловно, удобнее для пациента с МС и СД. В клинической практике перевод пациента на Глюкофаж Лонг способствует повышению комплаентности. Согласно результатам ретроспективного исследования по оценке приверженности пациентов терапии различными формами метформина (обычной и пролонгированной), при переходе на Глюкофаж Лонг соблюдение схемы лечения повысилось с 62 до 81% [14]. Таким образом, улучшение терапевтического действия препарата Глюкофаж Лонг обусловлено применением специально разработанной диффузионной системы GelShield: длительное постепенное поступление метформина из таблетки Глюкофаж Лонг улучшает переносимость препарата, а удобная схема приема позволяет существенно повысить приверженность больного лечению.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.