Адъювантная терапия лигнаном 7-гидроксиматаирезинолом как метод повышения онкологической безопасности приема эстрогенов
- Аннотация
- Статья
- Ссылки
- English


Введение
Лигнан 7-гидроксиматаирезинол (7-hydroxymatairesinol – 7-HMR), получаемый из сучков ели европейской (Picea abies), проявляет антиоксидантные, противовоспалительные, противомикробные и противоопухолевые свойства. Систематический анализ исследований указал на высокую биоусвояемость (более 50%) и низкую токсичность молекулы 7-HMR. Установлены противовоспалительные свойства 7-HMR, обусловленные ингибированием белка NF-κB (опосредующего провоспалительные эффекты цитокина фактора некроза опухоли альфа) и повышением экспрессии ферментов антиоксидантной защиты (супероксиддисмутазы, гемоксигеназы 1) [1].
В частности, особый интерес представляют противоопухолевые эффекты 7-HMR. Показано, что 7-HMR ингибирует рост гепатомы, опухолей молочной железы, матки, предстательной железы и толстого кишечника [1]. Хемореактомные оценки свойств 7-HMR позволили сформулировать молекулярные механизмы противоопухолевых эффектов молекулы (антиоксидантный эффект за счет ингибирования гемоксигеназ, циклинзависимых киназ 3 и 4, фактора роста эпидермиса и белка mTOR) [2].
В настоящей статье представлены результаты исследования влияния 7-HMR (Лигнариус) в дозах 60 и 120 мг/кг/сут на интенсивность роста злокачественной опухоли (солидной карциномы Эрлиха) – одной из стандартных моделей изучения противоопухолевых свойств веществ. Данная опухоль представляет собой спонтанный рак молочной железы у самок мышей [3].
Материал и методы
Лабораторные животные. Исследования проведены на 74 аутбредных мышах-самках. Животные были получены из питомника Научного центра биомедицинских технологий ФМБА России, имели ветеринарный сертификат и прошли 20-суточный карантин в виварии Медицинского радиологического научного центра им. А.Ф. Цыба. Животные содержались в соответствии с требованиями приказа МЗ РФ № 708н: в клетках Т-3 в условиях естественного освещения и принудительной 16-кратной вентиляции, при температуре 18–20 °C и относительной влажности воздуха 40–70%, на подстилке из простерилизованных древесных стружек, со свободным доступом к питьевой воде и стандартному брикетированному корму ПК-120-1 (ООО «Лабораторснаб», РФ). Все работы с лабораторными животными выполнены в соответствии с общепринятыми этическими нормами, на основе стандартных операционных процедур, которые приняты в Медицинском радиологическом научном центре им. А.Ф. Цыба и отвечают правилам Европейской конвенции по защите животных, используемых для научных целей (ETS 123).
Опухолевая модель. Исследования проведены на перевиваемой мышиной карциноме Эрлиха. Штамм поддерживался на аутбредных мышах-самках в виде асцитной карциномы. Трансплантацию солидной карциномы Эрлиха аутбредным мышам-самкам проводили подкожным введением 2,5 × 106 опухолевых клеток в 0,1 мл суспензии в область латеральной поверхности правого бедра, на которой предварительно депилировали шерстный покров.
Экспериментальные группы, способ введения и дозы препаратов. После трансплантации карциномы Эрлиха мышей-опухоленосителей распределили методом рандомизации в пять экспериментальных групп – одну контрольную и четыре подопытных, по 14–16 особей в каждой. Животных включали в опыт на пятые сутки после перевивки карциномы Эрлиха, когда опухолевый узел уже сформировался и достиг измеряемого размера практически у всех мышей.
Животные контрольной группы в дальнейшем не получали никаких воздействий. Животным первой опытной группы с седьмых по 21-е сутки роста солидной карциномы Эрлиха ежедневно однократно внутрижелудочно (в/ж) вводили 7-HMR в дозе 60 мг/кг/сут. Особям второй подопытной группы с седьмых по 21-е сутки роста опухоли ежедневно однократно в/ж вводили 7-HMR в дозе 120 мг/кг/сут. Животным третьей подопытной группы на пятые и шестые сутки роста карциномы Эрлиха однократно в/ж вводили эстрадиола валерат (0,51 мг/кг/сут) и далее с седьмых по 21-е сутки роста опухоли ежедневно в/ж вводили эстрадиола валерат и через 30 минут 7-HMR в дозе 120 мг/кг/сут. Животным четвертой подопытной группы с седьмых по 21-е сутки роста опухоли ежедневно однократно в/ж вводили эстрадиола валерат в дозе 0,51 мг/кг/сут. Рабочие растворы препаратов изготавливались непосредственно перед введением на 1%-ном крахмальном геле в концентрациях из расчета 0,1 мл на 10 г массы тела животных. Растворы эстрадиола валерата готовили с добавлением TWIN 80.
Оценка эффектов. Переносимость изучаемых препаратов оценивали по реакции животных на их введение и путем ежедневного осмотра и наблюдения за животными, в котором изучался неврологический статус по характеру спонтанной двигательной активности, общей возбудимости и реакции на тактильные и звуковые раздражители, а также по пищевой активности животных и динамике прироста их массы тела.
Влияние препаратов на опухолевый процесс изучали по динамике роста солидной карциномы Эрлиха. Для этого каждые три-четыре дня у всех животных измеряли калипером максимальный (L) и минимальный (W) диаметр опухолевых узлов и оценивали их объем в приближении V = (L × W2) × (π/6), которое надежно коррелирует с данными магнитно-резонансной томографии. Влияние на развитие карциномы Эрлиха оценивали путем статистического сравнения объема опухолевых узлов в контрольной и подопытных группах на различных сроках наблюдения, а также путем статистического сравнения диаграмм выживаемости Каплана – Мейера и средней продолжительности жизни животных.
Статистическая обработка. Статистическую оценку значимости межгрупповых различий объемов опухолевых узлов карциномы Эрлиха выполняли с использованием универсального метода непараметрической статистики – критерия Колмогорова – Смирнова. Статистическое сравнение диаграмм выживаемости проводили по F-критерию Кокса. Расчеты выполнены с помощью программного пакета Statistica 7.0 (StatSoft Inc., США).
Результаты и их обсуждение
Раздельное и комбинированное субхроническое в/ж введение растворов 7-HMR и эстрадиола валерата в использованных дозах животные переносили легко. Каких-либо проявлений интоксикации, изменений в поведении и двигательной активности подопытных мышей не наблюдалось. В течение всего эксперимента пищевая активность в подопытных группах не отличалась от пищевой активности контрольных животных. Масса тела животных в подопытных группах колебалась в пределах погрешности и статистически не отличалась от массы тела животных в контрольной группе (табл. 1).
В данной работе было проведено две серии экспериментов. В первой серии оценивалось влияние двух различных доз 7-HMR (60 и 120 мг/кг/сут) на интенсивность роста опухоли и выживаемость животных. Во второй серии изучалось воздействие 7-HMR на рост опухоли на фоне приема эстрадиола валерата.
Противоопухолевое действие 7-гидроксиматаирезинола
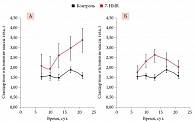
В то время как достоверных различий в динамике массы тела среди опытных и контрольных животных не наблюдалось (см. табл. 1), было установлено достоверное увеличение значений стандартного отклонения массы тела на фоне введения 7-HMR (рис. 1). Иначе говоря, у одних животных рост массы тела замедлялся, у других – ускорялся. Такой дифференцированный отклик косвенно свидетельствовал о противоопухолевом действии препарата.
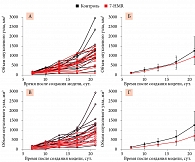
Согласно анализу динамики роста среднего объема опухолевого узла, применение 7-HMR тормозило интенсивность роста опухолей (рис. 2). Наиболее выраженный эффект отмечался при использовании 120 мг/кг/сут 7-HMR.
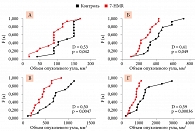
Анализ данных, проведенный с использованием теста Колмогорова – Смирнова, показал, что при введении 7-HMR в дозе в 60 мг/кг/сут достоверные различия в среднем объеме опухолей наблюдались только на 21-е сутки (см. рис. 2). Так, средний объем опухоли в группе 7-HMR 60 мг/кг/сут снижался на 407 мм3, что было достоверно ниже, чем в группе контроля (максимальное уклонение D = 0,39, число точек сравнения n = 11, p = 0,051).
При повышении дозы 7-HMR противоопухолевый эффект был более очевиден. Так, на фоне введения 7-HMR 120 мг/кг/сут средний объем опухоли был достоверно ниже, чем в группе контроля, уже на седьмые сутки. В дальнейшем разница между опытной и контрольной группами нарастала и была статистически достоверной на 13, 17 и 21-е сутки (рис. 3). Например, на 21-е сутки средний объем опухолевого узла в основной группе был на 620 мм3 меньше такового в группе контроля (максимальное уклонение D = 0,59, n = 11, p = 0,00036, см. рис. 3). Более того, на 21-е сутки ни у одного из животных, получавших 120 мг/кг/сут 7-HMR, не наблюдались значения объема опухоли более 1100 мм3, в то время как в группе контроля такие значения отмечались у половины животных (50%, n = 7).
Противоопухолевое действие 7-гидроксиматаирезинола на фоне приема эстрогенов
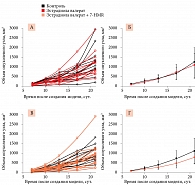
Прием эстрогенсодержащего препарата после создания опухоли приводил к некоторому увеличению интенсивности роста опухолевых узлов (рис. 4А, Б). Однако наблюдаемые различия не были достоверными (p > 0,25). 7-HMR в дозе 120 мг/кг/сут достоверно тормозил интенсивность роста опухолевых узлов на фоне введения эстрогенов (рис. 4В, Г). Различия были статистически достоверными на 10, 13, 17 и 21-е сутки. Наиболее выраженным был эффект на 21-е сутки: средний объем опухолевого узла уменьшился на 322 мм3, что достоверно ниже, чем в группе животных, получавших только эстрадиола валерат (D = 0,43, p = 0,007).
Анализ выживаемости животных при приеме 7-гидроксиматаирезинола
При анализе выживаемости животных обращало на себя внимание то, что у единичных (одной-двух) мышей в группах, получавших 7-HMR, отмечалось существенное увеличение продолжительности жизни, хотя при статистическом анализе эти эффекты оставались в пределах статистической погрешности (табл. 2). Две из 14 мышей, получавших 120 мг/кг/сут 7-HMR, и одна из 14 мышей, получавших 60 мг/кг/сут 7-HMR, были живы после трех с половиной месяцев от начала эксперимента. В контрольной группе к 60-му дню эксперимента все животные погибли. Таким образом, прием 7-HMR создавал прецеденты необычно продолжительного выживания животных в условиях роста солидной карциномы Эрлиха и, как было показано выше, существенно снижал интенсивность роста опухолей.
Результаты настоящей работы подтверждают противоопухолевые свойства 7-HMR и указывают на достоверное ингибирование роста опухолей модели рака молочной железы (солидная карцинома Эрлиха). Ранее было показано, что 7-HMR ингибирует рост модели опухоли молочной железы, индуцированной 7,12-диметилбензантраценом [4, 5]. При этом 7-HMR уменьшал образование полипов и предотвращал накопление бета-катенина в ядре (патофизиологическая метка образования полипов) [6].
В эксперименте 7-HMR и его метаболит энтеролактон уменьшают рост и метастазы клеток опухоли печени, привитых подкожно крысам (клеток гепатомы линии AH109A). 7-HMR подавлял пролиферацию клеток гепатомы, удлиняя время деления клеток гепатомы и увеличивая скорость апоптоза раковых клеток [7].
Показано, что 7-HMR позволяет осуществлять эффективную профилактику опухолей матки, вызванных однократным воздействием канцерогена N-этил-N'-нитро-N-нитрозогуанидина на крыс в 11-недельном возрасте. После воздействия канцерогена осуществлялись дотации весьма больших доз 7-HMR (200 или 600 мг/кг/сут в составе соевой диеты) до возраста 15 месяцев. Заболеваемость аденокарциномой матки была значительно снижена уже при приеме 200 мг/кг/сут 7-HMR (11%, контрольная группа – 50%, р < 0,05) [8].
Химиопрофилактическая активность 7-HMR также была показана на модели аденоматозной полипозной кишечной неоплазии у мышей. Среднее число аденом в тонком кишечнике при приеме 7-HMR было значительно ниже (26,6 ± 11,0, р < 0,05) по сравнению с плацебо (39,6 ± 8,9). Введение 7-HMR приводило к нормализации уровня бета-катенина в ткани аденомы, что указывает на то, что 7-HMR опосредует химиопрофилактический эффект через бета-катениновый сигнальный путь. Заметим, что использование 7-HMR позволило восстановить внутриядерный уровень бета-катенина в ткани аденомы (0,41 ± 0,25 у.е.) до уровня, обнаруженного в неизмененных клетках окружающей слизистой оболочки (0,36 ± 0,28 у.е.) [9].
Выводы
В работе иследовано влияние 7-HMR в дозах 60 и 120 мг/кг/сут на скорость роста опухолевых узлов солидной карциномы Эрлиха. Наиболее выраженный эффект отмечался при использовании 120 мг/кг/сут 7-HMR: на 21-е сутки средний объем опухоли достоверно снижался на 620 мм3 (разница с группой контроля достоверна, p = 0,00036 по тесту Колмогорова – Смирнова). Ни у одного из животных на фоне введения 120 мг/кг/сут 7-HMR не наблюдались значения объема опухоли более 1100 мм3, в то время как в группе контроля такие значения отмечались у 50% животных. 7-HMR в дозе 120 мг/кг/сут достоверно тормозил интенсивность роста опухолевых узлов на фоне введения эстрадиола валерата: средний объем опухолевого узла на 21-е сутки снижался на 322 мм3 (p = 0,007). При анализе выживаемости у малой части подопытных мышей-опухоленосителей, получавших 7-HMR в дозе 120 мг/кг/сут (14%), наблюдалось значительное увеличение продолжительности жизни (более трех месяцев). Таким образом, 7-HMR в дозах 60 и 120 мг/кг/сут оказывает достоверное противоопухолевое воздействие на рост солидной карциномы Эрлиха.
O.A. Gromova, A.N. Rubashkina, M.V. Filimonova, I.Yu. Torshin, N.K. Tetruashvili, N.P. Lapochkina
Federal Research Center ‘Computer Science and Control’ of Russian Academy of Sciences, Moscow
Ivanovo State Medical Academy
A. Tsyb Medical Radiological Research Center – Branch of the National Medical Research Radiological Center of the Ministry of Health of the Russian Federation, Obninsk
National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov, Moscow
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
The authors assessed the effect of 7-HMR, showing antitumor efficiency in doses of 60 and 120 mg/kg/day on the growth rate of solid Erlich carcinoma and survival of female mice. The antitumor effect was the most manifested in the case of 7-HMR using at a dose of 120 mg/kg/day: on the 21st day the average volume decreased by 620 mm3, which is significantly lower than in the control (p = 0.00036 for the Kolmogorov-Smirnov test). Application of 120 mg/kg/day of 7-HMR significantly inhibited the intensity of tumor growth on the background of estradiol valerate application: on the 21st day the average volume of the tumor node decreased by 322 mm3 (p = 0.007).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.