Актовегин в лечении неврологических осложнений сахарного диабета
- Аннотация
- Статья
- Ссылки

В работах П.Дж. Дика показано, что имеется корреляция между числом нервных волокон в периферическом нерве и толщиной стенки эндоневральных сосудов при СД. Таким образом, сосудистый компонент является одним из ведущих в развитии диабетической дистальной симметричной сенсорно-моторной полиневропатии (ДПН) [2]. Механизмы развития диабетической энцефалопатии также связаны с метаболическими нарушениями и вторичной сосудистой патологией, причем в этом случае большое значение имеет не только поражение микроциркуляторных сосудов, но и развитие из-за раннего атеросклеротического поражения страдания кровотока по крупным церебральным сосудам [4, 5]. Хороший контроль гликемии у больных СД с использованием для этой цели интенсивной инсулинотерапии способен уменьшить риск развития ДПН у больных с СД 1 типа, но мало влияет на развитие ДПН у пациентов с СД 2 типа [6, 7]. В связи с этим не вызывает сомнений необходимость лечения самих поздних неврологических осложнений СД для того, чтобы улучшить состояние больных и предотвратить быстрое прогрессирование ДПН и диабетической энцефалопатии. Для патогенетической терапии у больных с осложнениями CД используются антиоксидантные препараты и препараты тиамина, которые, нормализуя метаболические процессы, улучшают реологические свойства крови и кровоток в системе микроциркуляции [8, 9, 10]. Назначение этих препаратов является традиционным для современной медицины, и накоплен большой опыт их использования при ДПН. Возможности терапии диабетической энцефалопатии исследованы в гораздо меньшей степени.
В последние годы большой интерес вызывает использование Актовегина для лечения поздних осложнений СД. Препарат способен улучшать функциональное состояние периферической и центральной нервной системы, уменьшать выраженность оксидативного стресса, клеточной гипоксии и инсулинорезистентности (рис. 1). Механизм действия Актовегина у больных с различными неврологическими заболеваниями рассмотрен в целом ряде обзоров [11, 12]. Из экспериментальных работ известно, что воздействие Актовегина на обмен глюкозы начинается через 5 минут после внутривенного введения препарата и пик действия выявляется через 120 минут. В эксперименте на животных показано, что Актовегин обладает инсулиноподобной активностью [13]. Актовегин способствует увеличению скорости окислительно-восстановительных процессов в гепатоцитах, уменьшает ультраструктурные и функциональные повреждения митохондрий кардиомиоцитов, повышает сниженный уровень метаболизма глюкозы при хроническом алкоголизме. Улучшение энергетических возможностей клеток различных органов и тканей, включая нервную систему, связано со способностью препарата улучшать перенос глюкозы внутрь клетки путем активации ее транспортеров (GluT) и инсулиноподобного действия компонентов препарата – инозитолфосфоолигосахаридов. За счет того, что Актовегин модулирует активность внутриклеточного переноса глюкозы [14], происходит активизация липолиза. Рассматривается возможность применения Актовегина для лечения СД и метаболического синдрома [15, 16]. Одновременное назначение бета-блокатора (бисопролола) и Актовегина приводит к увеличению мозговой перфузии у больных с метаболическим синдромом.
Антигипоксантное действие Актовегина связано с тем, что он способствует поглощению кислорода тканями, что повышает устойчивость клеток к гипоксемии. Поступление кислорода в ткани содействует образованию маркроэргических фосфатов (АТФ, АДФ) и уменьшению энергетического клеточного дисбаланса. В результате более продуктивного поглощения кислорода сосудистой стенкой при введении Актовегина нормализуются эндотелий-зависимые реакции и снижается периферическое сосудистое сопротивление. Антиоксидантный эффект Актовегина обеспечивается наличием в составе препарата меди, активирующей супероксиддисмутазу, а также ионов магния, повышающих активность глутатионсинтетазы, осуществляющей перевод глутатиона в глутамин [17]. Недавно было доказано, что Актовегин дозозависимо уменьшает выраженность вызванного гидропироксидом оксидативного стресса в культуре нейрональных клеток [M. W. Elminger, личное сообщение].
Проведено большое число исследований по оценке эффективности Актовегина при ДПН [19, 20, 21], что предопределено механизмами фармакологического действия препарата. Согласно современным данным, развитие ДПН связано с оксидантным стрессом, возникающим в результате нарушений метаболизма глюкозы, а также слабости собственных антиоксидантных систем [3, 22]. Можно также согласиться с мнением, что «начинается диабет как болезнь обмена, а заканчивается – как сосудистая патология» [23]. Метаболические нарушения, вызывая изменение содержания в цитоплазме клеток фосфатных энергетических субстратов, приводят к развитию феномена «псевдогипоксии». Утолщение сосудистой стенки эндоневральных сосудов и изменение реологических свойств крови при СД приводят к развитию истинной гипоксии. Такое представление о метаболических и сосудистых процессах, лежащих в основе развития ДПН, делает целесообразным применение для лечения ДПН Актовегина, обладающего способностью воздействовать на процессы гипоксии и обмен глюкозы.
В исследовании W. Jansen и E. Beck улучшение состояния больных в группе лечения Актовегином отмечено у большинства пациентов через 8 недель после начала лечения, а оптимальный эффект достигался через 16 недель лечения [21]. Показано достоверное улучшение на фоне лечения Актовегином по сравнению с группой плацебо практически всех клинических показателей: расстояние ходьбы без боли, сухожильных рефлексов, поверхностной и глубокой чувствительности (р < 0,01). Скорость распространения возбуждения (СРВ) достоверно (p < 0,001) увеличивалась в группе лечения Актовегином по сравнению с группой плацебо, пациенты чувствовали себя лучше и предъявляли меньше жалоб на нарушение психоэмоционального состояния, что коррелировало с улучшением их физического состояния.
В работе В.А. Яворской с соавт. [20] в рамках открытого исследования применяли Актовегин для лечения ДПН у 24 больных с СД 1 и 2 типов в виде ежедневных инфузий в течение 20 дней. Критериями эффективности служили клинические показатели, данные исследования периферического кровотока и результаты ЭМГ-обследования. Отмечено улучшение клинического состояния больных в виде уменьшения болевого синдрома, повышения чувствительности и сухожильных рефлексов, увеличения силы мышц. Реовазография показала улучшение кровотока в ногах, а ЭМГ-обследование – увеличение амплитуды М-ответа и СРВ при стимуляции нервов ног.
Применение Актовегина в комплексном лечении 33 больных с синдромом диабетической стопы различной степени тяжести по классификации Вагнера показало, что присоединение препарата к традиционному лечению способствовало быстрому купированию болевого синдрома и ускорению процессов грануляции и эпителизации язвенных дефектов с их заживлением [24].
В исследовании Ф. Э. Моргоевой с соавт. изучена эффективность внутривенной монотерапии Актовегином больных с СД 2 типа [12]. В группу из 30 больных, получавших Актовегин один раз в сутки в течение 3 недель (15 инфузий) внутривенно капельно в дозе 400 мг, разведенном в 200,0 мл физиологического раствора, вошли пациенты с длительностью СД не менее 10 лет в возрасте 58,94 ± 1,29 лет (9 мужчин и 21 женщина). Наличие ДПН устанавливалось на основании неврологического осмотра, результатов ЭМГ, количественного сенсорного и автономного тестирования. В группу включались больные, имевшие 2а и 2b стадии ДПН по классификации P. J. Dyck и уровень HbA1c не более 10%. Оценка позитивной невропатической симптоматики (неприятные ощущения больных) проводилась с помощью шкалы TSS (Total Symptom Score – общий счет симптомов невропатии) с анализом выраженности боли, жжения, онемения и парестезий. Негативная невропатическая симптоматика (неврологический дефицит) оценивали по шкале NIS LL (Neuropathy Impairment Score Lower Limb – счет невропатических нарушений для ног) с тестированием силы мышц, состояния рефлексов и чувствительности различной модальности. Исследование функционального состояния периферических нервов ног проводилось методом стимуляционной ЭМГ с тестированием двигательного (n. peroneus) и чувствительного (n. suralis) нервов. Количественную оценку поверхностной и глубокой чувствительности, а также автономной кардиоиннервации проводили на приборе CASE-IV (Medical Electronics, США) с определением порогов холодовой, температурной, болевой и вибрационной чувствительности. Об уровне оксидантного стресса судили по содержанию малонового диальдегида в сыворотке крови и гемолизате эритроцитов. Состояние микроциркуляции изучали в ногтевом ложе второго пальца кисти на компьютерном капилляроскопе GY-0,04 фирмы «Центр анализа веществ» (Россия). Цифровой анализ изображения позволял определить скорость кровотока, количество «сладж- феноменов», величину периваскулярного отека. Обследование больных проводилось до и после курса лечения Актовегином. До лечения в группе больных СД с ДПН было отмечено достоверное повышение уровня перикисного окисления липидов в плазме и мембранах эритроцитов по сравнению с группой из 15 здоровых добровольцев того же возраста, что свидетельствовало о выраженности оксидантного стресса. Лечение Актовегином привело к снижению уровня малонового диальдегида в плазме и мембранах эритроцитов с его нормализацией. Таким образом, Актовегин оказывал несомненный антиоксидантный эффект, действуя на патогенетические механизмы развития ДПН. Состояние реологических свойств крови оценивали методом компьютерной капилляроскопии до и после лечения Актовегином. После лечения Актовегином отмечено достоверное улучшение основных характеристик капиллярного кровотока, причем отражающих не только реологические свойства крови, но и состояние проницаемости стенки капилляра.
Выраженность позитивной невропатической симптоматики до лечения по шкале TSS была значительной (7,79 баллов). После лечения отмечено достоверное уменьшение как суммы баллов по шкале TSS, так и баллов каждого из сенсорных симптомов в отдельности (p < 0,001). Уменьшение выраженности болезненных ощущений у больных после лечения Актовегином не было связано с психоэмоциональными нарушениями, так как не было отмечено динамики выраженности депрессии и тревожности после лечения. До начала лечения выраженность негативной невропатической симптоматики была незначительной (сумма баллов по шкале NISLL – 2,27 баллов), причем в основном выявлялись нарушения чувствительности и рефлексов. После лечения Актовегином отмечено достоверное уменьшение выраженности неврологического дефицита (p < 0,05), но не отдельных групп симптомов (сила мышц, рефлексы, чувствительность). При исследовании функционального состояния чувствительного нерва выявлено достоверное увеличение амплитуды сенсорного ответа (3,87 ± 2,43 мкВ до лечения и 6,19 ± 3,16 мкВ после лечения, p < 0,05). Исследование порогов температурной и болевой чувствительности методом количественного сенсорного тестирования показало, что после лечения Актовегином происходит уменьшение порогов чувствительности, связанной с состоянием тонких нервных волокон (р < 0,05). Вариабельность сердечного ритма по данным исследования R-R интервалов в покое и при пробе с глубоким дыханием достоверно не изменилась после лечения Актовегином, хотя отмечена тенденция к ее нормализации. Проведенное исследование показало, что лечение Актовегином, уменьшая выраженность оксидативного стресса и улучшая состояние системы микроциркуляции, приводит у больных СД 2 типа к регрессу клинических проявлений ДПН (позитивной и негативной невропатической симптоматики), что подтверждается улучшением объективных показателей функционального состояния периферических нервов (ЭМГ и количественное сенсорное тестирование).
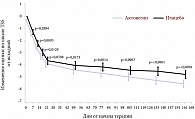
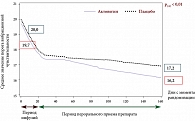
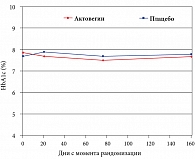
В 2009 г. были опубликованы результаты многоцентрового рандомизированного двойного слепого плацебоконтролируемого исследования лечения больных СД 2 типа с ДПН [25]. Основными критериями эффективности Актовегина и плацебо в этом исследовании были положительная невропатическая симптоматика, которая оценивалась по шкале TSS, и порог вибрационной чувствительности, который тестировался в нескольких точках на ногах (лодыжка, пальцы стопы) с помощью биотензиометра. Вторичными критериями эффективности служили отдельные показатели шкалы TSS, шкала NISLL и показатели качества жизни (краткая шкала – SF-36). Основные полученные в исследовании результаты представлены в табл. 1. Наилучшие результаты отмечены в отношении позитивной невропатической симптоматики, причем улучшение отмечалось как по суммарной оценке всех симптомов, так и в отношении каждого конкретного симптома (табл. 1, рис. 2). Выявлено достоверное уменьшение сенсорного неврологического дефицита, в отношении изменения рефлексов и силы мышц отмечена положительная тенденция к улучшению, не достигающая степени достоверности. Возможно, это связано с тем, что рефлексы и особенно сила мышц были изменены у относительно небольшого числа больных. Объективные показатели состояния проприоцептивных нервных волокон определялись с помощью оценки порогов вибрационной чувствительности. Уменьшение порога вибрационной чувствительности было достоверным при использовании Актовегина по сравнению с плацебо (рис. 3). В течение всего исследования проводилось определение уровня глюкозы натощак и показателя 2-месячной компенсации СД (HbA1c). Полученные результаты свидетельствуют о том, что эффективность Актовегина связана с действием препарата, а не с изменением контроля СД (рис. 4). В исследовании не было отмечено значимых побочных явлений.
Данное исследование, проведенное в рамках Good Clinical Practice, положительно ответило на вопрос об эффективности лечения и безопасности применения Актовегина при ДПН. Были сделаны выводы, что последовательная внутривенная, а затем пероральная терапия препаратом в течение 160 дней улучшила симптомы невропатии, снизила порог вибрационной чувствительности и улучшила сенсорную функцию у пациентов с СД 2 типа и ДПН. Показано значимое улучшение качества жизни (по шкале психического здоровья) в группе Актовегина по сравнению с плацебо. Отмечено, что группы пациентов, получавших Актовегин и плацебо, имели сравнимый профиль безопасности.
Американский фармкомитет (Food and Drug Administration) разработал определенные критерии для лекарственных средств, соответствуя которым они могут быть зарегистрированы как препараты для лечения ДПН: действие на патогенетические механизмы; уменьшение симптомов невропатии; улучшение функции нерва; отсутствие значительных побочных эффектов; уменьшение риска гибели нервных волокон. Проведенные исследования позволяют считать, что Актовегин соответствует большинству из этих критериев и может быть использован для лечения ДПН.
Сегодня Актовегин повсеместно используется для лечения сосудистых заболеваний головного мозга и когнитивных нарушений различной степени выраженности [26]. В исследовании эффективности влияния Актовегина на когнитивные функции у лиц пожилого и старческого возраста отмечено, что уже через 2 недели после начала терапии отмечалось статистически достоверное улучшение памяти, внимания и мышления. Клиническое улучшение состояния когнитивных функций по данным нейропсихологического тестирования сопровождалось нормализацией электроэнцефалограммы и увеличением амплитуды вызванного когнитивного потенциала Р300, причем даже разовое введение препарата приводило к улучшению электрофизиологических показателей функции головного мозга [27, 28]. В нескольких двойных слепых плацебоконтролируемых и рандомизированных исследованиях проверялась эффективность Актовегина при легкой или умеренной деменции, препарат назначался перорально или парентерально. У пациентов после перорального приема Актовегина в дозе 2 таблетки 3 раза в день в течение 8 недель достоверно возрастала скорость психических процессов [29]. Исследование на 120 пациентах с цереброваскулярной недостаточностью и когнитивным дефицитом показало, что при длительной терапии дисциркуляторной энцефалопатии с синдромом когнитивных нарушений предпочтение следует отдавать пероральному приему Актовегина [30]. При парентеральном введении Актовегина у этой группы больных показано улучшение когнитивных функций, в первую очередь памяти и внимания, уменьшение выраженности аффективных нарушений и улучшение социальной адаптации. Особо следует отметить, что эффективность препарата возрастала при увеличении времени курса инфузионной терапии, причем не только при сосудистой деменции, но и при болезни Альцгеймера [31, 32]. Курс инфузионной терапии Актовегином приводит к более выраженному и быстро наступающему улучшению состояния больных с когнитивными нарушениями, поэтому лечение рекомендуется начинать с парентеральной формы препарата, а затем переходить на прием таблеток [33]. Представляет большой интерес возможность использования Актовегина, учитывая его влияние на утилизацию глюкозы, у больных СД 2 типа с диабетической энцефалопатией для лечения когнитивных нарушений. При исследовании 60 больных СД 2 типа, имевших когнитивные нарушения различной степени выраженности, внутривенное введение 400 мг в течение 3 недель привело к улучшению суммы баллов по шкале MMSE (25,50 ± 2,52 балла до лечения и 26,47 ± 2,50 балла после лечения, p < 0,05), причем в наибольшей степени улучшалась память [19]. Улучшение когнитивных функций не сопровождалось достоверным уменьшением депрессии и тревожности, а также изменениями церебральной гемодинамики по данным дуплексного сканирования. Таким образом, можно предполагать, что клиническая эффективность Актовегина у больных СД 2 типа с когнитивными нарушениями обусловлена улучшением, в первую очередь, церебрального метаболизма.
Представляет большой интерес исследование В.В. Захарова и В.Б. Сосиной, которые использовали Актовегин для лечения умеренных когнитивных нарушений у 60 больных с СД 2 типа. Актовегин назначался перорально в дозе 1200 мг в сутки в течение 3 месяцев. Всем больным дважды проводили нейропсихологическое исследование с широким набором тестов и использованием качественной и количественной оценки результатов. Показано, что препарат в этой дозе хорошо переносился больными пожилого возраста и приводил к улучшению когнитивных функций преимущественно в сферах внимания и регуляции произвольной деятельности [34]. Таким образом, анализ данных литературы и собственных результатов позволяет сделать заключение о целесообразности применения препарата Актовегин для лечения неврологических осложнений СД (ДПН и диабетическая энцефалопатия).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.