Актуальные возможности вакцинопрофилактики ротавирусной инфекции. XVIII Cъезд педиатров России с международным участием «Актуальные проблемы педиатрии»
- Аннотация
- Статья
- Ссылки





Проблема внутрибольничной циркуляции ротавируса
В начале выступления д.м.н., профессор Владимир Кириллович ТАТОЧЕНКО (Научный центр здоровья детей) привел данные о распространенности нозокомиальных инфекций в России, сославшись на доклад д.м.н., профессора В.Г. Акимкина, прозвучавший в рамках Всероссийской научно-практической конференции с международным участием «Контроль и профилактика инфекций, связанных с оказанием медицинской помощи» в 2015 г. Согласно официальной статистике, распространенность нозокомиальных инфекций – 25–30 тыс. в год. Однако реальная ситуация иная – 2–2,5 млн случаев в год.
Сокрытие нозокомиальных ротавирусных инфекций (РВИ) – повсеместная практика, связанная с невыполнимыми требованиями СанПиН о выявлении вирусоносителей, изоляции контактов, реконвалесцентов, обследовании персонала детских учреждений и больниц. Подобные инфекции не регистрируются и диагностируются как острые респираторные вирусные инфекции (ОРВИ) с кишечным синдромом.
Следует отметить, что ротавирусы устойчивы к хлору, эфиру, хлороформу, детергентам, гипохлориту, ультразвуку и инактивируются только фенолами, крезолом, формалином.
Ротавирусы достаточно долго персистируют:
- в водопроводной воде – до 60 дней;
- во внешней среде – от десяти до 30 дней;
- в фекалиях – до семи месяцев;
- на фруктах – от пяти до 30 дней;
- шерстяных и хлопковых тканях – от 12 до 45 дней;
- различных поверхностях – до десяти дней.
Заражение РВИ происходит не только контактным путем, но и через загрязненные предметы и поверхности, а также воздушным путем (ротавирус обнаружен в воздухе больничных палат). К слову сказать, важный фактор распространения нозокомиальных РВИ внутри больничной палаты – медперсонал (несоблюдение гигиены, в частности мытья рук) и матери, остающиеся с больными детьми1.
Высокая температура тела, интоксикация, рвота в отсутствие диареи, характерные для начального этапа ротавирусного гастроэнтерита (РВГЭ), приводят к госпитализации в соматическое отделение. Такая картина наблюдается у 7% пациентов с РВГЭ, значительно чаще при ранней госпитализации.
Ротавирус – ведущий возбудитель нозокомиальных диарей в детской популяции. Например, в Европе им заражаются 5–27% госпитализированных детей в возрасте до двух лет.
Частота нозокомиальной РВИ в эпидемический сезон:
- в Европе: общая – 2,9 на 100 госпитализаций, в детской популяции (в возрасте до двух лет) – 8,1 на 100 госпитализаций2–4;
- Бразилии: 4,9 на 1000 койко-дней и 5,5 на 100 больных5;
- Канаде: 0,5 на 1000 койко-дней6.
Следует отметить, что РВИ удлиняет госпитализацию на три – пять дней и в половине случаев требует внутривенной регидратации.
Не последнюю роль в распространении ротавируса играет нозокомиальная РВИ. По данным разных авторов, доля полученных в больнице РВИ от всех пациентов с ротавирусом, находившихся в этой больнице на лечении, – 23,8–43,0%. В частности, в Польше данный показатель составляет 4,5–45,4%1, США – 25%7.
Из всех случаев ротавирусных диарей больничное происхождение имеют:
- в Австралии – 56,9%;
- Германии – 69,0%;
- Швейцарии – 48,6%;
- Польше – 72%8, 9.
Единственный метод контроля нозокомиальной инфекции – массовая вакцинация. Профессор В.К. Таточенко представил данные снижения частоты госпитализаций после вакцинации. Так, во Франции вакцинация (три дозы, охват – 47%), проводимая с 2008 г., позволила снизить частоту госпитализаций среди детей в возрасте до двух лет по поводу РВГЭ на 98% по сравнению с невакцинированными10. В Финляндии среди вакцинированных (три дозы ротавирусной вакцины, охват – 90%) не зафиксировано случаев РВГЭ11.
Наряду со снижением частоты госпитализаций массовая вакцинация позволила снизить частоту нозокомиальных РВГЭ: в Австрии и Германии – на 72%12, США (в первые два года) – на 60%13.
В заключение докладчик еще раз подчеркнул, что только массовая вакцинация способна противостоять ротавирусной инфекции.
Эпидемиология ротавирусной инфекции в России
По словам Александра Тихоновича ПОДКОЛЗИНА, к.м.н., заведующего лабораторией молекулярной диагностики и эпидемиологии кишечных инфекций Центрального научно-исследовательского института эпидемиологии, показатель заболеваемости РВИ в России не характеризует активность эпидемического процесса в популяции, а лишь отражает адекватность надзора за данной патологией.
К пятилетнему возрасту у детей во всем мире в анамнезе имеются случаи заболеваемости РВИ. Важно, что в детской популяции наиболее чувствителен возрастной критерий инфицирования как объективный показатель активности эпидемического процесса. По словам докладчика, показатель динамики накопительного процента инфицирования в российских регионах свидетельствует о наличии тенденции к некоторому «взрослению» заболеваемости РВИ среди детей. Только за 2016 г. показатель заболеваемости РВИ у детей первого года жизни снизился до 22,78%.
Эпидемиология РВИ имеет региональные особенности. В большинстве регионов, согласно объединенным данным по 61 субъекту РФ за 2008–2015 гг., пик заболеваемости РВИ приходится на холодные месяцы года (с декабря по май). Однако территории с субтропическим климатом, такие как Краснодарский край и Республика Крым, характеризуются атипичной сезонностью РВИ с пиком заболеваемости в летние месяцы, особенно в августе. Атипичный подъем РВИ на указанных территориях обусловлен не только особенностями климата, но и активной рекреацией людей из других регионов: количество отдыхающих в курортный сезон практически в три раза превышает численность постоянно проживающего населения. Аналогичная ситуация и на зарубежных курортах. Решить данную проблему только за счет увеличения объема противоэпидемических мероприятий в курортный сезон практически невозможно.
К сожалению, заболевания, связанные с РВИ у детей, способны приводить к летальным исходам. А.Т. Подколзин перечислил основные патологии, выявленные по результатам патологоанатомических и лабораторных исследований у 55 детей в возрасте до пяти лет с синдромом диареи и развитием летальных исходов за период 2011–2016 гг. В 20% случаев это были пневмонии без возбудителей острых кишечных инфекций (ОКИ), в 17% – пневмонии в сочетании с ОКИ, в 50% случаев – ОКИ.
В этиологической структуре основных возбудителей ОКИ доминировал ротавирус как по показателю клинически значимой концентрации в острой фазе заболевания (23,6%), так и по общей частоте выявления патогенов (30,9%). На долю аденовируса пришлось 1,8 и 10,9%, норовируса – 7,3 и 9,1%, сальмонеллы – 5,5 и 7,3% соответственно. В большинстве своем ротавирусы были представлены генотипами G4P[8], G9P[8], G1P[8], G3P[8] и G2P[4].
По мнению А.Т. Подколзина, защитить детей от ротавируса и обеспечить необходимый эпидемиологический эффект способна только широкомасштабная вакцинация. Однако, как показывает статистика, в 2016 г. охват вакцинацией пятивалентной ротавирусной вакциной (РВ5) на территории РФ был весьма незначительным – менее 1%. Лидерами по охвату вакцинацией детского населения стали Ненецкий автономный округ (47%), Сахалинская область (39%), Камчатский край (19%) и Московская область (18%).
Итоги вакцинации от ротавируса в мире и Российской Федерации: текущая ситуация
Как отметил Александр Васильевич ГОРЕЛОВ, д.м.н., профессор, академик РАН, руководитель клинического отдела инфекционной патологии Центрального научно-исследовательского института эпидемиологии, парадигма, долгое время определявшая РВИ исключительно как кишечную инфекцию, сегодня кардинально изменилась. Описаны случаи внекишечной локализации:
- неврологические осложнения: судороги, энцефалит, менингит, церебеллит;
- респираторные осложнения: средний отит, ларингит, фарингит, пневмония;
- поражения органов брюшной полости: гепатит, печеночный абсцесс, панкреатит, сахарный диабет, нефрит;
- прочие проявления: синдром Кавасаки, ДВС-синдром, гемофагоцитарный лимфогистиоцитоз, внезапная смерть ребенка грудного возраста во время сна14.
Согласно данным Всемирной организации здравоохранения (ВОЗ), пневмококк (32%) и ротавирус (30%) – основные причины детской смертности. Заболеваемость ОКИ сравнима с заболеваемостью ветряной оспой – 528,10 и 594,00 на 100 тыс. населения соответственно. Однако затраты на лечение ветряной оспы несопоставимы с затратами на лечение РВИ. Один случай госпитализации в 2010 г. при РВИ обходился в 20 300 руб. Сегодня это уже 27 000 руб. В 2015 г. доля РВИ в структуре заболеваемости ОКИ превысила 50%. Ущерб, нанесенный РВИ, сопоставим с ущербом от других более массовых заболеваний.
Единственный способ борьбы с РВИ – вакцинация. В Концепции и стратегии глобальной иммунизации ВОЗ предусмотрено, что ротавирусные вакцины должны быть включены во все национальные программы иммунизации. Применение таких вакцин должно стать частью комплексной стратегии борьбы с заболеваниями, сопровождающимися диареей, направленной на снижение детской смертности, прежде всего с помощью вакцинации против РВИ.
Вакцина против ротавирусов успешно используется уже на протяжении 20 лет. В 88 странах мира проводят ротавирусную вакцинацию.
Безопасность вакцины РотаТек изучали в трех плацебоконтролируемых клинических исследованиях с участием 71 725 детей в возрасте до года, а также в пост-регистрационный период среди 81 000 детей, получавших РВ5. Вакцина продемонстрировала хороший профиль безопасности в до- и пострегистрационный период15–18.
Абсолютно очевидна и эффективность вакцинации. В 2008 г. в США были получены первые положительные результаты вакцинации по поводу РВИ: количество идентифицированных случаев РВИ снизилось на 64%, количество госпитализаций – на 45%19. Согласно другим данным, внедрение вакцинации против РВИ позволило в два раза уменьшить число госпитализаций по поводу ОКИ любой этиологии среди детей младше трех лет (рис. 1)20.
Следует отметить, что, согласно европейским и американским стандартам, госпитализации подлежат дети в состоянии шока, с тяжелой дегидратацией (более 9% массы тела), неврологическими нарушениями (летаргия, судороги и т.д.), неукротимой рвотой, после хирургического вмешательства. То есть речь идет о крайне тяжелых ситуациях. Поэтому снижение частоты госпитализаций в два раза – экономически ощутимый результат.
В США было проведено постмаркетинговое обсервационное исследование эффективности вакцины РотаТек в отношении снижения уровня госпитализации, посещений отделений скорой помощи и обращений за амбулаторной медицинской помощью у пациентов с диагностированным РВГЭ. 33 140 детей первой группы получили три дозы вакцины РотаТек, 26 167 детей второй группы – АКДС. Последующий мониторинг проводился в течение двух ротавирусных сезонов и начинался через 14 дней после получения третьей дозы в обеих группах или в начале каждого сезона. Запланированное наблюдение продолжалось до конца каждого сезона.
Согласно полученным результатам, эффективность вакцины против РВГЭ достигла 100% (95%-ный доверительный интервал (ДИ) 87–100) при госпитализации и посещениях отделений скорой помощи и 96% (95% ДИ 76–100) – при обращениях за амбулаторной медицинской помощью. Эффективность вакцины (госпитализация и посещения отделений скорой помощи) против гастроэнтерита любого вида составила 59% (95% ДИ 47–68)21.
Интересные результаты были получены в исследовании B.A. Lopman и соавт. Внедрение в 2006 г. вакцинации против РВИ в Америке обеспечило популяционный эффект. В 2008 г. заболеваемость РВИ среди невакцинированных значительно снизилась в возрастных группах от ноля до четырех, от пяти до 14, от 15 до 24 лет. Кроме того, наблюдалось значительное уменьшение заболеваемости в марте (исторический пик РВИ) во всех возрастных группах. Частота РВГЭ среди невакцинированных лиц в возрасте от пяти до 14 лет уменьшилась на 71%. По оценкам, сумма предотвращенных расходов на лечение РВГЭ у лиц от пяти до 24 лет составила 204 млн долл.22
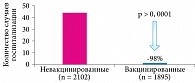
В Европе были получены аналогичные данные эффективности вакцины РотаТек. Так, во французском исследовании «случай – контроль», проведенном в 2008–2009 гг. в Бресте, оценивали частоту госпитализаций у детей младше двух лет по поводу ротавируса. В исследование были включены 2102 невакцинированных ребенка и 1895 вакцинированных детей, получивших три дозы вакцины РотаТек. Региональный проект внедрения вакцины РотаТек дал результат уже через год: число госпитализаций по поводу РВИ в группе вакцинированных детей снизилось на 98% (рис. 2)10.
По словам профессора А.В. Горелова, в развивающихся странах, как и в России, этиологическая расшифровка диарей и гастроэнтеритов не проводится. Согласно опубликованным данным, в Мексике и Бразилии результативность вакцинации была высокой и привела к снижению заболеваемости РВГЭ на 79–94%23–25. Внедрение вакцинации позволило снизить смертность от ОКИ. Показатели ее снижения коррелируют с долей РВИ: в Мексике – на 46%, Бразилии – на 22%26, 27.
В странах Европы проведение вакцинопрофилактики способствовало не только снижению риска госпитализаций, но и частоты обращений за врачебной помощью в поликлиники. На основании данных, опубликованных в 2015 г., вследствие применения вакцины РотаТек в 2006–2008 гг. (г. Темпере, Финляндия) частота госпитализаций и обращений в поликлиники в 2009–2011 гг. снизилась на 59% по поводу ОКИ, на 80% по поводу РВИ.
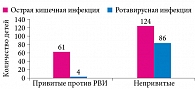
Первый положительный эффект вакцинации РВИ в нашей стране был продемонстрирован в Тюмени и Ачинске. По данным профессора О.А. Рачковой, вакцинация в Тюмени способствовала снижению заболеваемости ОКИ в группе привитых детей по сравнению с непривитыми в два раза (124 против 62) и РВИ в 21 раз (4 против 86) (рис. 3).
По данным профессора Г.П. Мартынова, в Ачинске вакцинация способствовала снижению госпитализаций по поводу ОКИ в 1,4 раза у детей до года и 2,4 раза – у детей от года до трех лет (рис. 4).
Сказанное подтверждает эффективность вакцинации.
В заключение профессор А.В. Горелов отметил, что в странах, внедривших вакцинацию против РВИ, на следующий год отмечается снижение:
- заболеваемости РВИ на 70–90%;
- частоты госпитализаций на 50% и смертности по поводу любых ОКИ на 20–40%;
- заболеваемости РВГЭ в возрастных группах, не подлежащих вакцинации, на 15–70%.
Вакцинация против ротавируса рекомендована для включения в национальный календарь прививок РФ и региональные программы иммунопрофилактики.
Заключение
Внедрение ротавирусной вакцинации позволяет уменьшить частоту заболеваемости и распространения возбудителя в детской популяции. Введение трех доз пятивалентной ротавирусной вакцины РотаТек предотвращает среднетяжелые и тяжелые формы РВИ у детей раннего возраста, снижает смертность от РВГЭ, потребность в экстренной медицинской помощи, частоту госпитализаций, амбулаторного приема, нозокомиальной инфекции, а также способствует снижению заболеваемости непривитых детей в коллективах за счет уменьшения циркуляции ротавируса. Для достижения необходимого результата важен массовый охват вакцинацией детского населения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.