Аллергический ринит и коморбидность c инфекциями
- Аннотация
- Статья
- Ссылки
- English




Введение
Согласно классификации Института гигиены детей и подростков Минздрава России, дети, подверженные частым респираторным инфекциям, или часто болеющие дети (ЧБД), относятся ко второй группе здоровья. Это дети с отягощенным биологическим анамнезом, функциональными и морфологическими особенностями, то есть с риском развития хронического заболевания. ЧБД составляют от 20 до 65% детской популяции [1, 2]. При этом среди них преобладают дети младшего возраста, то есть до семи лет.
В последние годы интенсивно изучается проблема сочетания аллергических заболеваний (АЗ) и инфекций, усугубляющих клинические проявления АЗ. Иммуноглобулин Е (IgE), участвующий в патогенезе АЗ, был открыт K. Ishizaka и T. Ishizaka в 1967 г. [3]. Fc-фрагмент IgE взаимодействует с высокоаффинным рецептором FcRI на поверхности базофилов, дендритных клеток, клеток Лангерганса или с рецептором FceRII на B-клетках, моноцитах и эозинофилах. Комплекс антиген-IgE активирует рецепторы FceRI на клетках, стимулирует синтез интерлейкина (ИЛ) 4 или 13, а далее – IgE [4].
Для профилактики АЗ и инфекций большое значение имеют персистирующая микробная флора и функциональная активность слизистых оболочек.
У пациентов с иммунодефицитными состояниями персистирующая патогенная инфекция наблюдается чаще: первичные и вторичные иммунодефициты, онкология, ВИЧ-инфекция, синдром Дауна [1, 5]. Инфекция верхних дыхательных путей может проявляться развитием симптомов риносинусита, назофарингита, ларингита, тонзиллита, трахеита [1, 5].
Микробиом начинает закладываться в трехлетнем возрасте. Этот период имеет ключевое значение для формирования микробиоты во взрослом возрасте [6]. Микробиота кишечника во многом зависит от типа родов, характера вскармливания, приема антибиотиков матерью или младенцем, периода окончания грудного вскармливания из-за изменения режима питания [7]. Микробиота кишечника оказывает влияние на микрофлору слизистых оболочек верхних дыхательных путей, поскольку слизистые оболочки являются единой системой, связанной через гормоны и цитокины. Дисбаланс и патология микробиоты кишечника в раннем детстве признаны факторами риска развития АЗ, сахарного диабета, ожирения и энтероколита [8]. Персистенция условно-патогенной и патогенной микрофлоры на слизистых оболочках контролируется врожденным иммунитетом, большое значение при этом отводится Toll-подобным рецепторам (TLR) [9]. Например, TLR2 и TLR6 распознают липотейхоевую кислоту грамположительных бактерий и активируют иммунокомпетентные клетки. Дисфункция TLR2 приводит к персистенции стафилококковой инфекции на коже и слизистых оболочках, нарушает синтез противомикробных пептидов [10].
По распространенности среди АЗ лидирует аллергический ринит (АР) – 10–24% [11]. Заболевание характеризуется IgE-опосредованным воспалением слизистых оболочек и развитием ринореи, чихания, зуда, заложенности носа. Чтобы заподозрить АР, достаточно наличия двух из четырех перечисленных выше симптомов.
К сожалению, к врачу обращаются только 45% больных на ранних стадиях АР. Большинство пациентов приходят уже со среднетяжелым или тяжелым АР [11]. Многие пациенты расценивают симптомы АР как острую респираторную вирусную инфекцию (ОРВИ), поэтому не получают необходимого лечения. У 30–50% больных диагностируется атопическая бронхиальная астма (БА). При БА в 55–85% случаев определяются клинические симптомы АР [12]. У детей с АР в 7–12 лет риск развития БА повышается в семь раз, в 12–20 лет – в четыре раза, в 20–44 года – в три раза [11]. Коморбидность АР с инфекциями изучена недостаточно, обострения воспалительных заболеваний верхних дыхательных путей при АР затрудняют проведение аллерген-специфической иммунотерапии. У детей АР может сочетаться с ОРВИ, гипертрофией аденоидов (ГА), тонзиллофарингитом. При этом сочетание АР с ГА чаще наблюдается в возрасте 3–15 лет [13–15]. В России распространенность АР составляет 10–24% [14]. Согласно данным L. Pereira и соавт., встречаемость ГА достигает 34,46% [16]. ГА связана с увеличением глоточной миндалины, что характерно для детей двух – семи лет [16, 17]. ГА может быть значительной, разграничивается по стадиям и сопровождается развитием воспаления, присоединением инфекций и обострением аденоидита [15, 17, 18]. В норме у детей к пяти – семи годам основные иммунологические показатели (Т- и В-клетки, иммуноглобулины) сопоставимы с таковыми у взрослых [1].
Нас интересовали изменения врожденного иммунитета у детей с повторными эпизодами ОРВИ и АР и возможность местного иммуномодулирующего влияния на слизистые оболочки верхних дыхательных путей. С этой целью был выбран Имунофан в виде спрея. Данный препарат хорошо зарекомендовал себя в комплексном лечении инфекций респираторного тракта [19].
Цель исследования
Цель настоящего исследования – оценить эффективность локального применения препарата Имунофан в комплексном лечении детей с повторными ОРВИ и АР.
Задачи
Для достижения цели нами были поставлены следующие задачи:
- оценить клинико-иммунологические особенности врожденного иммунитета у детей с повторными ОРВИ и аллергическим ринитом;
- проанализировать эффективность локального применения препарата Имунофан в комплексном лечении детей с повторными ОРВИ и аллергическим ринитом;
- разработать рекомендации по локальному применению препарата Имунофан в комплексном лечении детей с повторными ОРВИ и аллергическим ринитом.
Материал и методы
Имунофан в форме спрея предназначен для местного применения. В педиатрической практике он разрешен к применению с двух лет.
Имунофан – иммунотропный препарат, содержащий синтетический гексапептид с молекулярной массой 836 D, ближайшим аналогом которого является тимопентин (Timunox, Швейцария).
Применение Имунофана способствует преодолению резистентности к глюкокортикостероидам (ГКС). При этом возможно их совместное использование, что важно при лечении АР.
Имунофан стимулирует нарушенную продукцию тимических гормонов, в том числе сывороточного тимического фактора, а также ИЛ-2, интерферона (ИФН). Иммуномодулирующее действие спрея подтверждено повышением уровня IgA и сывороточного уровня IgA в назальных смывах при ГА [19, 20]. Однако в доступной литературе мы не нашли сообщений о возможности назначения Имунофана в виде спрея детям с повторными ОРВИ и интермиттирующим АР (ИАР).
Критерии включения в исследование:
- дети пяти – семи лет с повторными ОРВИ 6–12 раз в год;
- ИАР легкой степени продолжительностью не более года с момента установления диагноза;
- иммунодисрегуляция, снижение показателей иммунной системы;
- отсутствие противопоказаний к выбранным методам лечения.
Критерии исключения из исследования:
- тяжелые соматические заболевания в стадии суб- и декомпенсации (геморрагический синдром, диабет, заболевания печени, эндокринной системы, почек и других внутренних органов, аутоиммунные заболевания, активная и латентная формы туберкулеза);
- аллергические заболевания (бронхиальная астма, диффузный атопический дерматит, аллергический ринит тяжелой степени, поллиноз в период обострения, полипоз носа второй – четвертой степени);
- антенатальный герпес, активная вирусная инфекция, вызванная цитомегаловирусом и вирусом Эпштейна – Барр;
- непереносимость отобранных для лечения препаратов;
- получение иммуномодулирующих препаратов в течение шести предыдущих месяцев.
Были отобраны 50 детей, из них 30 мальчиков и 20 девочек, с повторными эпизодами ОРВИ и ИАР. Возраст детей составлял пять – семь лет (средний возраст – 5,7 ± 0,9 года). Для выработки алгоритма лечения пациенты были рандомизированы на две группы (группу Ia и группу Iб) по 25 человек в каждой. В обеих группах повторные эпизоды ОРВИ и ИАР легкой степени тяжести диагностированы у всех детей [14, 18].
Группы были сходны по полу, возрасту, выраженности клинических проявлений заболеваний и получали следующее лечение: туалет носа (водно-солевые промывания), левоцетиризин в каплях в дозе 1,25 мг два раза в день (первая ступень), по показаниям добавляли назальные ГКС (мометазон) в возрастных дозах под контролем симптомов АР (вторая ступень). Группе Iб вне острого периода ОРВИ и ИАР дополнительно был назначен Имунофан в виде спрея интраназально в дозе 50 мкг в каждую ноздрю два раза в сутки в течение 15 дней, всего три курса в год с интервалом три месяца вне острого периода OРВИ и ИАР.
Длительность наблюдения составила 12 месяцев.
На начало исследования дети наблюдались у педиатра по месту жительства, были проконсультированы лор-врачом для исключения патологии гортани и трахеи. Лечились эпизодически с кратковременным эффектом. Применялись местные антисептики и антибиотики при наличии показаний [18]. Для орошения слизистой оболочки небных миндалин и глотки назначали антисептический препарат гексэтидин в виде полосканий или орошения ротоглотки два раза в сутки на протяжении десяти дней по показаниям. Антибиотики с учетом чувствительности применяли в период обострения при высевании из зева, носа или миндалин Streptococcus haemolyticus, Streptocоccus pneumoniae, Klebsiella pneumoniae, Haemophilus influenzae.
Обследование включало лабораторные и инструментальные методы: клинический анализ крови, биохимический анализ крови (по показаниям), общий анализ мочи, бактериологические посевы на микрофлору и чувствительность микроорганизмов к антибиотикам со слизистой оболочки зева, миндалин.
Концентрацию сывороточного IgА и IgG определяли методом радиальной иммунодиффузии в геле по методу Манчини [21].
Интерфероновый статус оценивали с помощью иммуноферментного анализа (ИФА) по стандартной методике с применением тест-систем «Гамма-интерферон-ИФА-БЕСТ» и «Альфа-интерферон-ИФА-БЕСТ» (Россия).
Аллергологическое обследование включало сбор аллергологического анамнеза, кожное тестирование с аллергенами при помощи prick-тестов, определение уровня общего и специфических IgE. Рrick-тесты со стандартными аллергенами проводили при наличии аллергологического анамнеза (риносинусопатии, аллергического ринита, кожных высыпаний и т.д.) и при повышении уровня общего IgE.
Уровень общего IgE в сыворотке крови определяли стандартным методом ИФА с использованием тест-систем ХЕМА (Россия). Для определения уровня специфических IgE методом ИФА применяли тест-системы ImmunoCAP (HVD) согласно инструкции.
Риноцитограмму и переднюю риноскопию у детей с АР проводили в начале наблюдения, далее – по показаниям.
Клинический анализ крови, исследование уровня общего и специфических IgE осуществляли на начало наблюдения и через 12 месяцев для контроля состояния.
Статистическая обработка результатов выполнена с помощью программы Standart с использованием пакета программ Statistica 6.0. Использованы вариационный, одно- и многофакторный корреляционный виды статистического анализа с определением достоверности по критериям Стьюдента и интервальной оценки квадратичного отклонения и дисперсии нормального распределения по критерию χ2, U-критерию Манна – Уитни. Различия считали статистически значимыми при р < 0,05.
Результаты и их обсуждение
На начало наблюдения при анализе результатов клинического и биохимического анализа крови (общий билирубин, аланинаминотрансфераза, аспартатаминотрансфераза), общего анализа мочи патологии не выявлено.
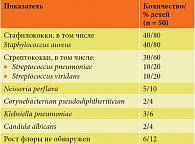
Персистенция инфекции у детей с повторными эпизодами ОРВИ и ИАР обычно наблюдается в верхних отделах респираторного тракта, что подтверждено данными анализа мазков на микрофлору со слизистых оболочек зева (табл. 1).
Монокультура выделена у 46% детей, два и более возбудителя – у 40%, Candida albicans – у 4% детей. У 12% детей роста бактериальной флоры не обнаружено. Количественные показатели колебались от 4 × 104 до 5 × 106 КОЕ/мл. Полученные результаты указывают на персистенцию инфекции на слизистой оболочке зева. Частые ОРВИ вызываются вирусами и являются триггерными факторами усиления аллергического воспаления и развития БА.
В таблице 2 отражены результаты оценки аллергической сенсибилизации у пациентов с повторными ОРВИ и ИАР. Причинно-значимым аллергеном признана пыльца деревьев. В период цветения наблюдались заложенность носа, ринорея и чихание. Сенсибилизация к другим аллергенам зафиксирована у небольшого количества пациентов. Эти аллергены не были признаны причинно-значимыми. Так, у пациентов не отмечалось клинических симптомов при цветении злаков и луговых трав (латентная сенсибилизация). Нужно отметить наличие полисенсибилизации к бытовым аллергенам (шерсти кошки, собаки, Dermatophagoides pteronyssinus, Dermatophagoides farinae).
Уровень специфических IgE у детей с повторными ОРВИ и ИАР представлен в табл. 3. Высокий уровень специфических IgE выявлен к пыльце деревьев – причинно-значимому аллергену. Сенсибилизация к другим аллергенам на начало наблюдения не сопровождалась выраженными клиническими симптомами.
В таблице 4 представлены данные о выраженности назальных симптомов и потребности в препаратах. Так, через год наблюдения в группе Iб по сравнению с группой Iа наблюдалось снижение выраженности чихания, заложенности носа и суммарного балла оценки симптомов (p < 0,05). Увеличение потребности в препаратах, переход на вторую ступень (назначение мометазона) отмечались у семи (28%) детей группы Iб и десяти (40%) детей группы Ia. Повышение потребности в медикаментах при оценке в баллах не было достоверным. Частота ОРВИ за год наблюдения оказалась ниже в группе Iб (p < 0,05).
В таблице 5 показана динамика иммунологических показателей у детей с повторными ОРВИ и ИАР через год наблюдения. В группе Iб показатель сывороточного IgA, уровень ИФН-α в крови и синтез клетками ИФН-α были выше, а частота ОРВИ ниже, чем в группе Iа (p < 0,05). Разница показателей сывороточного IgG и общего IgE не была достоверной. Количественные показатели высевания Staphylococcus aureus со слизистой оболочки зева на начало наблюдения колебались от 4 × 104 до 5 × 106 КОЕ/мл, а через год – от 3 × 103 до 4 × 104 КОЕ/мл в группе Iб и от 5 × 103 до 6 × 105 КОЕ/мл в группе Iа.
Известно, что при вирусных инфекциях воспаление сопровождается Th2-опосредованным локальным цитокиновым штормом (синтез ИЛ-4, ИЛ-5, ИЛ-13, ФНО-α, IgE, повышение экспрессии FceRI и FceRII), усилением сенсибилизации к аллергенам и формированием аллергического воспаления [22].
Ранее нами было обследовано 172 пациента с персистирующим аллергическим ринитом (ПАР) и хроническими заболеваниями рото- и носоглотки (хронический риносинусит, хронический тонзиллофарингит). Среди них было 128 (74,4%) женщин и 44 (25,6%) мужчины. Три четверти составили лица трудоспособного возраста – от 30 до 55 лет. Продолжительность заболевания колебалась от года до двух лет. Больные были проконсультированы аллергологом-иммунологом и оториноларингологом. ПАР легкой степени выявлен у 12,8%, средней степени – у 49,4%, тяжелой степени – у 37,8%. Причинно-значимыми аллергенами признаны Dermatophagoides pteronyssinus и farinae. Обострение очагов инфекции затрудняло проведение аллерген-специфической иммунотерапии [23]. Из-за риска развития БА разработка алгоритма лечения таких больных является актуальной и социально значимой [22, 24].
Результаты настоящего исследования свидетельствуют, что местное назначение Имунофана в виде спрея приводит к снижению частоты повторных ОРВИ в 1,8 раза, персистенции на слизистой оболочке зева Staphylococcus aureus и воспаления слизистых оболочек верхних дыхательных путей. Уменьшению воспаления способствует повышение врожденного иммунитета, а именно уровня ИФН-α и сывороточного уровня IgA. Известно, что антигены стафилококка являются супераллергенами, поэтому уменьшение персистенции на слизистых оболочках зева Staphylococcus aureus приводит к снижению аллергенной нагрузки и воспаления. Полученные результаты подтверждаются снижением выраженности симптомов АР (ринореи, чихания, заложенности носа).
Имунофан спрей безопасен. На фоне его применения побочных реакций не наблюдалось.
У детей с повторными ОРВИ диагностируются АЗ, при этом наиболее часто АР и БА [22].
Заключение
Назначение препарата Имунофан интраназально в комплексном лечении детей с повторными эпизодами ОРВИ и ИАР снижает частоту ОРВИ в 1,8 раза, персистенцию бактериальной микрофлоры на слизистых оболочках, а также риск присоединения инфекций и, как следствие, инфекционное воспаление. У обследованных детей отмечено повышение уровня ИФН-α и сывороточного уровня IgА. Такая терапия не ассоциировалась с повышением уровня IgE и развитием аллергических реакций.
T.P. Markova, MD, PhD, Prof., D.G. Chuvirov, PhD, L.G. Yarilina, PhD, A.G. Chuvirova, M.В. Shadyzheva, S.S. Arshinova, PhD
Academy of Postgraduate Education of the Federal Scientific and Clinical Center of Specialized types of Medical Care and Medical Technologies of the Federal Medical-Biological Agency
State Scientific Center ‘Institute of Immunology’ of the Federal Medical-Biological Agency
Contact person: Tatyana P. Markova, logot12@list.ru
The article presents the results of examination of children with repeated respiratory infections (ARVI) 6–12 times a year and allergic rhinitis of mild severity. 50 children (30 boys and 20 girls) aged 5–7 years (mean age 5.7 ± 0.9) were randomized into two groups, similar in gender, age and clinical manifestations. Children received standard therapy (wave-salt nasal washes, antiseptics, levocetiresin). 25 children (group Ib) received an additional imunofan intranasally (spray) with courses without acute period of respiratory viral infections and allergic rhinitis. When prescribing Imunofan, the serum immunoglobulin A, interferons α levels were higher during the year, and the persistence of Staphylococcus aureus on the oropharyngeal mucosa was lower than in untreated with Imunofan children. The frequency of ARVI decreased by 1.8 times and the inflammation of the mucous membranes of the upper respiratory tract decreased. There was no increase in immunoglobulin E level and allergic reactions in the children.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.