Аналоги пиримидина в комбинации с цитокинами – вторая линия терапии быстропрогрессирующего метастатического рака почки
- Аннотация
- Статья
- Ссылки

В последнее время существенно изменились представления о лечении одного из наиболее проблемных онкологических заболеваний – рака почки. Это стало возможным после понимания и более глубокого изучения биологических особенностей опухоли, гистогенетических характеристик, механизмов взаимодействия с иммунной системой, ряда прогностических факторов. Так, до недавних пор рак почки считался химиорезистентной опухолью, и лечение его ограничивалось первой и единственной линией терапии на основе цитокинов – высоких доз интерлейкина-2 (ИЛ-2) и/или интерферона-α2b (ИФН). В России при почечно-клеточном раке (ПКР) в большинстве случаев назначался ИФН. Понятия «вторая линия терапии» не существовало до настоящего времени. Различий в лечении разных гистологических подтипов ПКР также не проводилось. Между тем более чем в 70% случаев ПКР проявляет устойчивость к иммунотерапии в чистом виде и требует дополнительного лечения.
Агрессивными формами ПКР можно считать:
- резистентный к иммунотерапии или рецидивирующий в первый год после нефроэктомии светлоклеточный вариант ПКР (часто сопровождается экспрессией гена VHL);
- саркоматоидный вариант ПКР;
- папиллярный вариант ПКР (характеризуется гиперэкспрессией BHD или мутацией c-met);
- неклассифицируемый рак почки;
- дуктальная карцинома;
- медуллярная карцинома.
Агрессивные формы ПКР обладают наиболее злокачественным течением, сопровождающимся стремительным ростом первичной опухоли, быстрым «отсевом» метастазов, низкой частотой объективных ответов на иммунотерапию и, соответственно, крайне неудовлетворительными показателями 5-летней выживаемости. Следовательно, необходимо уделять особое внимание разработке современных подходов к лечению агрессивных форм ПКР как в первой, так и во второй линиях терапии. Современные тенденции в этом направлении базируются на двух принципах:
- изучении препаратов таргетной терапии (сунитиниб, сорафениб);
- разработке комбинаций аналогов пиримидина (гемцитабин, капецитабин, 5-фторурацил (5-ФУ)) ± иммунотерапия (ИФН, ИЛ-2) с оценкой их эффективности.
Оба направления могут развиваться параллельно, т. е. друг друга взаимно не исключают, лишь дополняют. Аналоги пиримидина представляют собой класс противоопухолевых препаратов, относящихся к группе антиметаболитов. Они ингибируют ферменты, необходимые для синтеза нуклеиновых кислот, а также могут встраиваться в ДНК и РНК опухолевых клеток. Выделяют две основные подгруппы аналогов пиримидина – фторпиримидины (5-ФУ, капецитабин) и аналоги цитидина (гемцитабин). Они схожи по механизму действия. 5-ФУ – наиболее старый представитель группы. Еще 10 лет назад было замечено, что кроме прямого цитотоксического действия через ингибирование ферментов 5-ФУ способен оказывать опосредованное действие – повышать иммуногенность некоторых опухолей, в частности рака почки. Предполагается, что данный феномен обусловлен влиянием препарата на клеточный цикл с повышением экспрессии опухоль-ассоциированных антигенов, появляющихся на клеточной поверхности. Это приводит к распознаванию опухолевой клетки иммуноцитами и активации противоопухолевого иммунного ответа. Сравнительно недавно появился новый представитель аналогов пиримидина – капецитабин. Капецитабин разработан как пероральный, активируемый в опухоли в результате тройного ферментативного каскада, фторпиримидин. Пероральная терапия капецитабином имитирует длительную инфузию 5-ФУ. По активности капецитабин превосходит 5-ФУ благодаря непосредственному превращению в 5-ФУ внутри клетки. Препарат нового поколения – гемцитабин – проявил себя с положительной стороны при многих опухолях. В последнее время появляются работы по изучению гемцитабина при ПКР. Как и капецитабин, гемцитабин превращается в активные метаболиты внутри клетки. Основные метаболиты гемцитабина угнетают синтез ферментов (рибонуклеотидредуктаза), являющихся катализаторами реакции, при которой образуются дезоксинуклеозидтрифосфаты для синтеза ДНК. Кроме того, происходит конкуренция при построении ДНК, в результате которой метаболиты гемцитабина встраиваются в молекулу нуклеиновой кислоты. В отличие от 5-ФУ и капецитабина, оказывающих в том числе иммуномодулирующий эффект, целесообразность включения гемцитабина в схемы при быстропрогрессирующем ПКР заключается в его циторедуктивном действии по отношению к активно делящимся клеткам рака, что повышает эффективность противоопухолевого иммунного ответа.
В свою очередь биогенные препараты модулируют иммунный ответ. ИЛ-2 и ИФН активируют Т-лимфоциты, NK-клетки, экспрессию молекул главного комплекса гистосовместимости, который представлен на поверхности клетки с опухоль-ассоциированным антигеном.
Все это свидетельствует о целесообразности изучения комбинаций цитокинов и аналогов пиримидина при агрессивном течении рака почки.
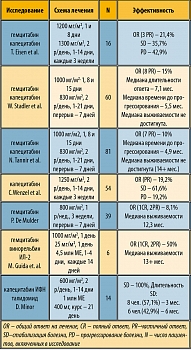
В таблице 1 приводятся сведения об эффективности различных режимов в качестве второй линии терапии по данным зарубежных авторов.
В отделении биотерапии опухолей РОНЦ им. Н.Н. Блохина РАМН в настоящее время также проводится 3 исследования эффективности аналогов пиримидина в комбинации с цитокинами при агрессивных формах ПКР. Получены первые сведения об их эффективности и переносимости. В исследование были включены больные с распространенными формами заболевания, ответ на лечение у которых оценить весьма сложно, а стандартом ведения таких пациентов является лишь хорошая поддерживающая терапия.
Комбинация 5-ФУ, ИЛ-2, ИФН.
Материалы и методы
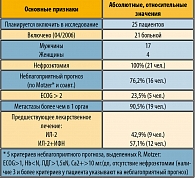
На первом этапе в наше исследование планировалось включить 25 пациентов с ПКР после прогрессирования на первой линии терапии, представленной цитокинами ИЛ-2 и ИФН. Условиями включения больных в протокол были гистологически подтвержденный почечно-клеточный рак, неэффективность цитокинотерапии, наличие измеряемых очагов поражения, отсутствие хронических декомпенсированных заболеваний, а также заболеваний аутоиммунной природы, метастазов в головной мозг. Статус по ECOG не являлся ограничением к назначению терапии (за исключением ECOG = 4).
Больным, вошедшим в исследование, проводилось лечение по схеме:
- 5-ФУ, 500 мг/м2, в/в, капельно, 1 день, 1-3 недели;
- ИЛ-2 (Ронколейкин), 1 млн. МЕ, в/в, капельно, длительно, с добавлением 10%-ного раствора альбумина-5 мл, 3 раза в нед., 1-3 недели;
- ИФН (Реаферон), 5 млн МЕ, п/к, 3 раза в нед., 1-3 недели.
Лечение осуществлялось курсами до появления признаков прогрессирования заболевания. Перерыв между ними составлял 3 недели. Эффективность терапии оценивалась по критериям RECIST (Response Evaluation Criteria in Solid Tumors; критерии оценки ответа при солидных опухолях) после каждых двух курсов.
Первичная оценка эффективности терапии проводилась по частоте объективных ответов и 8-месячной выживаемости. Переносимость режима оценивалась по критериям CTCAE v. 3.0 (Common Terminology Criteria for Adverse Events; критерии оценки неблагоприятных событий, 3-я версия). Вторичная оценка включает медиану выживаемости, общую выживаемость и изменения в иммунном статусе больного.
Особенности клинических признаков больных, объединенных в исследование, представлены в таблице 2.
Результаты исследования и их обсуждение
За период с января 2004 г. по апрель 2006 г. проспективно наблюдался 21 больной. Среднее число проведенных курсов 5-ФУ, ИЛ-2, ИФН составило 5,5. Частота объективных ответов представлена в таблице 3.
Длительность течения частичного ответа составила 12,5 мес. Оба пациента в настоящее время находятся в ремиссии и получают терапию по схеме. Стабилизация болезни в среднем продолжалась 5,4 мес. (2-26 мес.).
Переносимость лечения расценена как удовлетворительная. Токсичность у 100% больных представляла I ст. по СТСAE. Основные наблюдаемые побочные явления были представлены гриппоподобным синдромом (лихорадка, озноб, миалгии, слабость) и гипотензией. Для купирования гриппоподобного синдрома использовались нестероидные противовоспалительные препараты (парацетамол, диклофенак, кетопрофен, целекоксиб). Гипотензия, связанная с инфузиями ИЛ-2, отмечена только в 9,5% случаев (2 чел.). Из других нежелательных эффектов от проводимого лечения наблюдались эритема в месте инъекции ИФН и незначительное снижение настроения больного.
Таким образом, предварительные результаты указывают на эффективность комбинации 5-ФУ+ИЛ-2+ИФН в качестве второй линии терапии у больных с быстропрогрессирующим ПКР, не ответивших на лечение цитокинами. Общая частота позитивных исходов лечения (частичный ответ и стабилизация болезни) составила 52,4%. Режим хорошо переносится. Влияние биохимиотерапии на выживаемость больных будет представлено позже после набора планируемого числа больных.
Комбинация Капецитабина и ИФН.
Материалы и методы
Исследование является проспективным пилотным с запланированным количеством наблюдений – 30. Критерии включения соответствуют таковым в вышеприведенном исследовании. Во время лечения больных не использовали других видов химиотерапии, иммунотерапии, а также препараты, обладающие колониестимулирующим действием на гемопоэз. Больные с метастазами в кости ± болевой синдром получали бисфосфонаты (памидроновая кислота, золедроновая кислота) и по показаниям – паллиативную лучевую терапию. Всем пациентам проводился режим биохимиотерапии, предусматривающий параллельное введение капецитабина и ИФН по схеме:
Капецитабин (Кселода), 1250мг/м2, перорально, 2 раза в сутки, 1-14 дни.
ИФН (Реаферон), 5 млн МЕ, п/к, 3 раза в неделю, 1-21 дни.
Интервал между курсами составлял 14 дней (1-4 курсы), 21 день (последующие). Лечение проводилось до появления признаков прогрессирования заболевания. Для оценки опухолевых очагов использовали компьютерную томографию (КТ) – каждые 4 курса, ультразвуковое исследование (УЗИ), рентгенографию легких – каждые 2 курса. Для определения эффективности терапии основывались на критериях RECIST. Выводы по эффективности терапии и целесообразности ее назначения в качестве второй линии (по результатам настоящего пилотного исследования) будут сделаны на основании общей выживаемости больных, медианы выживаемости и частоты объективных ответов. Лечение проводилось амбулаторно.
Результаты исследования и их обсуждение
С января 2005 г. по апрель 2006 г. в исследование было включено 15 пациентов, 10 из которых получили более 2 курсов. Средний возраст составил 58,3 года (50-72). Все пациенты были с метастатическими очагами более чем в одном органе. 60% больных (6 человек) имели ECOG статус больше 2. Нефроэктомия выполнена у 9 пациентов (90%). Лечебные эффекты представлены в таблице 4.
Несмотря на отсутствие полных эффектов, частота позитивных исходов (частичный эффект и стабилизация) была 70%. 6-месячная выживаемость в группе с потенциально неблагоприятным исходом составила 70%.
Анализ токсичности показал безопасность режима и возможность его проведения в амбулаторном режиме. Все пациенты переносили терапию удовлетворительно с характерными побочными эффектами ИФН – подъем температуры, мышечные и суставные боли (I ст. по СТСAE), а также тошнотой (3 пациента: I ст. по СТСAE – 2; II ст. по СТСAE – 1) после капецитабина. Изменений со стороны гемограммы не было. Полученные результаты позволяют дальше проводить набор в исследование.
Комбинация Гемцитабина, Винорельбина, ИЛ-2
Нами был повторен режим, предложенный M. Guida с соавторами (см. таблицу 1), основанный на трехкомпонентной схеме – гемцитабин, навельбин, ИЛ-2, демонстрирующий 50%-ную эффективность при ПКР. Отличительной особенностью этой схемы является включение нового представителя винкаалкалоидов – винорельбина. Нужно признать, что винбластин – предшественник винорельбина – уже изучался в лечении ПКР и, к сожалению, не показал эффективности как в монорежиме, так и в комбинации с ИФН. Однако изучение эффективности винорельбина – более активного препарата совместно с гемцитабином и ИЛ-2 представляется чрезвычайно интересным.
Материалы и методы
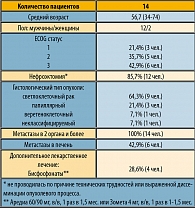
Для оценки результативности комбинации в протокол проспективно включено 14 больных с гистологически или цитологически подтвержденным раком почки, измеряемыми очагами поражения, отсутствием неврологической симптоматики, без выраженных нарушений со стороны органов и систем, а также инфекционных заболеваний. Статус по ECOG не являлся ограничением к назначению терапии (за исключением ECOG = 4). В качестве 3-й линии лечение проводилось у 4 пациентов (28,6%). В качестве 2-й линии режим получили 7 больных (50%). 3 больных (21,4%) с неблагоприятным прогнозом и ожидаемой неэффективностью иммунотерапии (несветлоклеточный рак) никакого лечения в анамнезе не получали. Предшествующая терапия у 11 пациентов была проведена позже 4 недель назад. Характеристика лечебной группы – в таблице 5.
Пациенты получали курс биохимиотерапии по схеме:
- Гемзар 1000 мг/м2, в/в, капельно, 1 день;
- Навельбин 25 мг/м2, в/в, капельно, 1 день;
- Пролейкин 4,5 млн МЕ, п/к, 2-5 дни.
Для инфузии химиопрепаратов устанавливался внутривенный катетер. Интервал между курсами составлял 14-21 день. Затем проводился следующий курс. Лечение осуществлялось до прогрессирования, которое устанавливалось по результатам ультразвукового исследования, рентгенографии органов грудной полости и компьютерной томографии.
Оценка эффективности базировалась на международных критериях RECIST (Response Evaluation Criteria in Solid Tumors; критерии оценки ответа при солидных опухолях), токсичности – CTCAE v. 3 (Common Terminology Criteria for Adverse Events; критерии оценки неблагоприятных событий, 3-я версия).
Первичная оценка эффективности терапии основывалась на медиане выживаемости *, превышающей 4 месяца.
Вторичная оценка включала частоту объективных ответов на лечение, длительность ответа и стабилизации болезни, токсичность и переносимость.
Результаты исследования и их обсуждение
За период с ноября 2003 г. по март 2006 г. 14 пациентов получили 48 лечебных курсов, в среднем – 3,4 курса на человека (1-9).
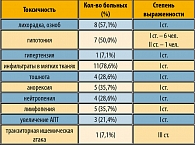
Наиболее частым проявлением токсичности было снижение давления на фоне ИЛ-2, а также повышение температуры тела и инфильтраты в зонах введения цитокина. Побочные реакции со стороны химиопрепаратов практически не отмечены. Серьезным неврологическим осложнением явилась транзиторная ишемическая атака – у 1 пациента с ишемией головного мозга в анамнезе. Лечение в данном случае, несмотря на полученную стабилизацию болезни (проведено 3 курса), было отменено. Других выраженных побочных реакций не встречалось (таблица 6).
Все побочные эффекты легко купировались вспомогательными препаратами. Снижение доз препаратов не требовалось.
Согласно протоколу, пациенты, получившие 2 и более курсов лечения, подлежали оценке. Из 14 включенных больных оценено было 13. Общий ответ на лечение составил 7,7% – 1 частичный эффект. У 6 пациентов наблюдалась стабилизация болезни – 46,15%. Прогрессирование выявлено у 6 больных (46,15%). Длительность частичного ответа и стабилизации была 5,9 месяцев. Медиана выживаемости в общей группе составила 5+ месяцев. Медиана в группе больных со стабилизацией и ответом на лечение – 7+ месяцев (5-10).
Заключение
Больные метастатическим раком почки с неблагоприятными факторами прогноза, в т. ч. несветлоклеточным гистологическим типом, а также не ответившие на иммунотерапию, составляют группу с медианой выживаемости, не превышающей 3-4 месяца. В среднем 70% пациентов с диссеминированным раком почки являются рефрактерными к проводимому лечению в первой линии. Еще 20% прогрессируют в течение года после начала лечения. Подходы к повышению эффективности терапии у этой группы пациентов, направленные на увеличение продолжительности жизни, разрабатываются. Одним из наиболее перспективных направлений представляется таргетная терапия. Другим возможным – комбинация химиотерапии (аналогов пиримидина) и иммунотерапии (ИЛ-2).
Полученные в нашем исследовании результаты показывают, что приблизительно у 50% больных ПКР с неблагоприятным прогнозом можно рассчитывать на эффект в виде стабилизации или неполной регрессии опухоли на протяжении почти 6 месяцев и некоторым преимуществом в выживаемости. 3 пациента живы в настоящее время (12 месяцев). Лечение не является токсичным, переносимость была удовлетворительной. Комбинации, изучаемые в нашем исследовании, при дальнейшем их практическом внедрении могут быть предложены пациентам в качестве второй линии терапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.