БАД Вука Вука® в лечении пациентов с эректильной дисфункцией
- Аннотация
- Статья
- Ссылки



Эректильная дисфункция является широко распространенной медицинской, психологической и социальной проблемой. По данным Massachusetts Male Aging Study, частота встречаемости ЭД у мужчин в возрасте 40-70 лет составила 52% (2). По некоторым оценкам, к 2025 г. во всем мире число мужчин с ЭД может превысить 300 млн человек (3), в том числе составит в Европе более 11,9 млн человек, в Северной Америке – более 9,1 млн, в Африке – более 19,3 млн, в Азии – более 113 млн.
ЭД можно классифицировать с учетом этиологии и тяжести. По этиологии выделяют органическую, психогенную, а также ятрогенную форму, развивающуюся вследствие приема лекарственных препаратов. В свою очередь органическую ЭД разделяют на сосудистую, нейрогенную, анатомическую и эндокринную. Психогенная форма может быть генерализованной и ситуационно зависимой (4). В зависимости от тяжести нарушения эрекции выделяют легкую, умеренной степени, средней степени выраженности и тяжелую ЭД.
Основными заболеваниями, приводящими к развитию ЭД, являются сахарный диабет, сердечно-сосудистые заболевания, хроническая почечная недостаточность, такие заболевания полового члена, как болезнь Пейрони, травма, кавернозный фиброз, а также андрогенный дефицит различной этиологии. В развитие стойкой ЭД вносят вклад факторы риска, связанные с образом жизни – курение, употребление наркотиков, злоупотребление алкоголем, гиподинамия.
Новые диагностические методы в корне изменили прежние представления о преимущественно психогенных нарушениях эрекции. Хорошо изучен механизм возникновения и поддержания эрекции. Теперь почти в 80% случаев выявляются органические причины нарушения эрекции. Наиболее часто встречается ЭД смешанного генеза, при сочетании психогенных и органических факторов.
В последние годы в арсенале врача появляется все больше средств, с достаточно высокой эффективностью позволяющих проводить неинвазивное лечение ЭД.
За последние 20 лет достигнут значительный прогресс в понимании физиологии эрекции полового члена (5-8), что привело к величайшим достижениям в фармакологическом лечении ЭД путем применения препаратов ингибиторов фосфодиэстеразы 5 типа (ФДЭ-5). Первым среди них стал силденафил цитрат (Виагра), появившийся на американском фармакологическом рынке в 1998 г. и открывший новую эру в лечении ЭД – эру эффективного перорального лечения. В 2002-2003 гг. было зарегистрировано два новых препарата, относящихся к группе ингибиторов ФДЭ-5 – тадалафил (Сиалис, Eli Lilly) и варденафил (Левитра, Bayer).
В многочисленных клинических исследованиях ингибиторы ФДЭ-5 продемонстрировали хорошую эффективность и безопасность, и в настоящее время рекомендованы в качестве первой линии терапии для мужчин с ЭД (9-11).
Эффективность ингибиторов ФДЭ-5 в лечении ЭД составляет от 70% до 80%. Однако, несмотря на столь показательные результаты терапии, остаются около 30% больных с наиболее тяжелыми формами ЭД, у которых терапия данными препаратами оказывается неэффективной (12).
В то же время высокая стоимость препаратов и существенный риск развития нежелательных лекарственных реакций, особенно в группе больных с сердечно-сосудистыми заболеваниями, существенно ограничивают широкое их применение, что и способствует поиску и разработке новых лекарственных средств для лечения ЭД.
В последнее десятилетие в мире особенно возрос интерес как производителей, так и потребителей лекарственных средств к методам так называемой биологической медицины. На фармацевтическом рынке в настоящее время появилось множество препаратов для лечения ЭД природного (животного и растительного) происхождения. Это обусловлено тем, что данные препараты имеют значительно меньше побочных эффектов по сравнению с химиопрепаратами, не вызывают привыкания и синдрома отмены. Многие из них не являются лекарствами, относясь к биологически активным добавкам (БАД).
В начале XX в. в связи с развитием фармакологии казалось, что лекарственным средствам растительного происхождения и их сторонникам не остается ничего другого, как смириться с судьбой медленной, но верной гибели их прежней славы и значения. Появившиеся новые синтетические лекарственные препараты оказались более эффективными по сравнению с традиционными растительными. Однако во второй половине XX в. стало ясно, что этот прогноз ошибочен. В настоящее время пришло понимание, что растительные лекарственные средства имеют огромное значение и их не могут полностью заменить синтетические препараты. С той же поспешностью, с какой 100 лет назад отвергали растительные лекарственные средства, сейчас к ним возвращаются вновь, но на другом уровне познания, имея в распоряжении другие методы их выделения, более полные научные сведения и возможности в области фармакологии.
Преимущества растительных лекарственных средств:
- относительная безопасность действия (химическая природа лекарственных средств растительного происхождения позволяет препаратам на их основе легко включаться в биохимические процессы человека, оказывая многостороннее, мягкое действие даже при длительном применении);
- незначительное количество побочных эффектов, что выгодно отличает растительные лекарственные средства от синтетических аналогов;
- возможность рационального сочетания растительных лекарственных средств между собой и с синтетическими средствами (эта их особенность важна для пациентов пожилого возраста, больных с сочетанной патологией);
- ценовая доступность.
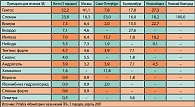
Российский рынок БАД растительного происхожления для лечения ЭД представлен большим количеством препаратов (таблица 1).
Как видно из приведенной таблицы, препараты растительного происхождения являются самыми назначаемыми препаратами для лечения ЭД в РФ. На их долю приходится более 70% назначений. Однако общий процент эффективности этих препаратов по статистике не превышает 50%, что приближает их к эффекту плацебо (13). Несмотря на имеющиеся публикации по применению БАД для лечения ЭД, эта тема до конца не исследована и количество исследований по проблеме невелико. Более того, существуют определенные трудности в проведении рандомизированных клинических исследований этих препаратов. Во-первых, зачастую действие препарата является результатом совокупного действия его компонентов, эффективность же изолированных компонентов может быть значительно снижена. Во-вторых, по той же причине практически очень сложно проведение фармакокинетических наблюдений, так как все вместе компоненты не могут быть прослежены с помощью маркеров или биоисследований. И, в-третьих, у многих фармакологических компаний, выпускающих в продажу БАД растительного происхождения, просто нет стимула для проведения дорогостоящих исследований, так как для выхода на рынок такого препарата достаточно простых тестов, исключающих токсичность.
В 2008 г. в России появился новый препарат (БАД) растительного происхождения для лечения ЭД – Вука ВукаÒ, производимый компанией ООО «Витамер» по заказу и под контролем фармацевтической компании «Макиз-Фарма» (ГК «STADA»). Препарат представляет собой таблетированную смесь редких южноафриканских растений, произрастающих только в определенном регионе юга Африки – провинции Булавайо в Зимбабве: гетероморфа древовидная (Heteromorpha arborescens), озороа сетчатая (Ozoroa reticulate), карисса съедобная (Carissa edulis), секуринега вироза (Securinega virosa), триумфетта велвича (Triumfetta welwitschii). Природные свойства каждого из компонентов препарата приведены в таблице 2.
Результаты качественного анализа на основные группы биологически активных веществ показали наличие в препарате следующих компонентов: сапонины стероидного ряда, флавоноиды, дубильные вещества, а также кумарины группы окси- и пиранокумаринов, индол и триптофан (незаменимая аминокислота индольного ряда). Существует небольшое количество научных работ, предполагающих проэректогенный эффект биологически активных веществ, содержащихся в препарате. Так, например, сапонины стероидного ряда увеличивают количество коитусов и эякуляций, удлиняют продолжительность коитуса, а также усиливают сексуальную мотивацию у самцов крыс (14), повышают высвобождение основного вазодилататора – оксида азота (NO) эндотелиальными клетками кавернозной ткани (15). Некоторые исследования показывают наличие у флавоноидов активности в отношении подавления активности ароматазы (фермента, превращающего тестостерон в эстрадиол), что также может способствовать увеличению уровня тестостерона и улучшению качества эрекции (22).
На базе ФГУ НИИ Урологии Росмедтехнологий нами было проведено исследование эффективности и безопасности БАД Вука ВукаÒ в лечении пациентов с эректильной дисфункцией различной этиологии.
Материалы и методы
Данное клиническое исследование проведено как слепое сравнительное рандомизированное плацебо-контролированное. Исследуемая популяция состояла из пациентов с ЭД различной этиологии.
В исследование было включено 50 пациентов в возрасте от 19 до 73 лет (средний возраст 39,5 ± 13,4 года, медиана 38,5 лет) с наличием жалоб на снижение качества адекватных эрекций легкой, умеренной и средней степени тяжести (оценка эректильной функции по шкале IIEF от 11 до 25 баллов). Давность проявления симптоматики ЭД составила от 2 до 432 месяцев (в среднем 46,54 ± 63,35 месяцев, медиана 24 месяца).
Эффективность терапии оценивалась на третьем и четвертом визитах (через 30 дней от начала приема препарата и через 30 дней после отмены терапии соответственно). Сравнение значений на визитах 3 и 4 производилось со значениями на визите 1. С целью оценки эффективности препарата были использованы следующие параметры: оценка динамики степени выраженности и характера жалоб пациента на основании данных, полученных в результате анализа параметров анкетирования шкал МИЭФ (Международный Индекс Эректильной Функции) (17), МКФ (шкала количественной оценки Мужской Копулятивной Функции) (18), госпитальной шкалы тревоги и депрессии (19), AMS (20); оценка динамики параметров пенильного кровотока на основании изучения ультразвуковых показателей при выполнении фармакодопплерографии. Эффективность терапии оценивалась по следующим критериям:
- выраженный эффект – отсутствие жалоб пациента на эректильные нарушения;
- хороший эффект – снижение выраженности жалоб пациента при анкетировании более чем на одну степень хотя бы по одной из оценочных шкал при улучшении параметров пенильного кровотока более чем на 30%;
- удовлетворительный эффект – снижение выраженности жалоб пациента при анкетировании на одну степень хотя бы по одной из оценочных шкал и/или улучшение параметров пенильного кровотока до 30%;
- неудовлетворительный эффект – отсутствие положительной динамики состояния пациента или ухудшение состояния пациента.
В исследование не включались пациенты, у которых были зарегистрированы симптомы тяжелой степени выраженности ЭД (оценка эректильной функции по шкале IIEF менее 11 баллов); пациенты с повышением концентрации PSA в сыворотке крови более 4 нг/мл; пациенты, страдающие хроническим алкоголизмом, наркоманией, психическими заболеваниями; пациенты с наличием подтвержденного инструментальными методами исследования патологического венозного сброса по системе глубокой дорзальной и глубоких пенильных вен. Критериями исключения также явилось наличие у пациента заболеваний, передающихся половым путем, а также наличие сопутствующих заболеваний в стадии декомпенсации.
Всем пациентам проводилось исследование уровня общего тестостерона в крови. При этом в исследование не были включены пациенты со сниженным уровнем общего тестостерона (< 11 нмоль/л).
Из сопутствующих заболеваний у 6 (12%) пациентов имелся хронический простатит, у 4 (8%) – артериальная гипертензия, у 3 (6%) – ишемическая болезнь сердца. Среди сопутствующих заболеваний также встречались сахарный диабет 2 типа в стадии компенсации, хронический гастрит, вирусный гепатит С вне обострения, болезнь Бехтерева, остеоартроз тазобедренного сустава, доброкачественная гиперплазия предстательной железы.
Все пациенты, включенные в исследование, были рандомизированы на две группы численностью 25 человек каждая в соответствии с планом рандомизации. Основная группа (n = 25) для терапии основного заболевания получала БАД Вука ВукаÒ таблетки по 550 мг (1 таблетка) 2 раза в сутки. Контрольная группа (n = 25) для терапии основного заболевания получала препарат плацебо-таблетки в аналогичной последовательности. Длительность лечения составила 30 дней. Последующий период наблюдения для определения периода последействия БАД после его отмены составил 30 дней.
В ходе исследования проводилась регистрация сопутствующей терапии по поводу острых или хронических заболеваний, допускался прием лекарственных средств для лечения сопутствующих заболеваний в случае, если эти препараты не оказывали действия на эректильную функцию. Доза и кратность назначения этих препаратов, по возможности, должны были оставаться постоянными на протяжении всего периода исследования.
Прием ряда препаратов за две недели до начала исследования и в ходе исследования был запрещен: ингибиторы ФДЭ-5, препараты тестостерона, хорионического гонадотропина, антиэстрогены; a-адреноблокаторы, холинергические и антихолинергические препараты, ингибиторы 5-a-редуктазы, экстракты растительного и животного происхождения для лечения заболеваний простаты и эректильной дисфункции, диуретики (тиазиды, спиронолактон), симпатолитики (метилдопа, клонидин, резерпин), b-блокаторы, антидепрессанты, ингибиторы МАО, бензодиазепины, сердечные гликозиды, блокаторы Н2-рецепторов, кетоконазол (Низорал), ниацин, фенобарбитал, фенитоин.
Статистический анализ выполнен с помощью программного пакета SAS. Все статистические тесты выполнены для двустороннего 5-процентного уровня статистической значимости. Проверка достоверности изменения относительно исходного уровня выполнялась для количественных переменных с использованием парного критерия Стьюдента (paired t-test) либо знаковым критерием Вилкоксона (Wilcoxon signed test) в случае ненормальности закона распределения.
Результаты
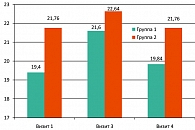
По результатам анкетирования с использованием шкалы МИЭФ, в основной группе (группа 1) на третьем визите было отмечено достоверное (р = 0,034) улучшение эректильной функции со средних значений в баллах шкалы 19,4 ± 3,81 при медиане 19 (визит 1) до 21,6 ± 3,32 при медиане 23 (визит 3) (сравнение значений на визитах 3 и 4 производилось со значением на визите 1). Динамика оцениваемых параметров для основной группы (группа 1) на временном промежутке визит 3 ® визит 4, а также для контрольной группы (группа 2) за весь период наблюдения носит недостоверный характер. Данные представлены в таблице 3 и на рисунке 1.
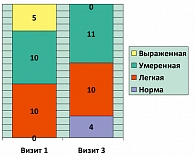
Рисунок 2 отражает структуру эректильной функции в основной группе (группа 1) на визитах 1 и 3 по шкале МИЭФ. Представленные здесь цифровые значения демонстрируют распределение количества пациентов по степени выраженности эректильной функции. Как видно из представленных данных, на фоне проведения лечения на визите 3 у 4 пациентов отмечена нормализация параметров эрекции (на визите 1 пациентов с нормальными значениями эректильной функции не зарегистрировано), выявлено также отсутствие пациентов с выраженными эректильными расстройствами за счет их перехода в зону легких и умеренных нарушений.
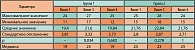
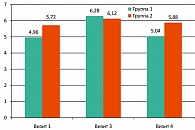
По результатам анкетирования с использованием шкалы МКФ, в основной группе (группа 1) на третьем визите отмечено достоверное (р = 0,037) улучшение эректильной функции со средних значений в баллах шкалы 4,96 ± 1,9 при медиане 5 (визит 1) до 6,28 ± 2,42 при медиане 6 (визит 3) (сравнение значений на визитах 3 и 4 производилось со значением на визите 1). Динамика оцениваемых параметров для группы 1 на временном промежутке визит 3 ® визит 4, а также для группы 2 за весь период наблюдения носит недостоверный характер. Данные представлены в таблице 4 и на рисунке 3.
Достоверных изменений результатов анкетирования с использованием других опросников (госпитальной шкалы тревоги и депрессии, AMS) на третьем и четвертом визите по сравнению с первым как в основной, так и в контрольной группах отмечено не было.
Оценка эффективности препарата выражается количеством (%) пациентов, у которых был достигнут выраженный, хороший и удовлетворительный эффект.
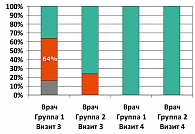
Таким образом, со стороны пациентов общая эффективность лечения в основной группе (группа 1) на момент визита 3 составила 48%, со стороны врача общая эффективность лечения в основной группе на момент визита 3 составила 64%. В контрольной группе (группа 2) на момент визита 3 общая эффективность лечения со стороны пациентов и врача совпала и составила 24%.
Через месяц после отмены проводимого лечения в обеих группах не зафиксировано ни одного случая, когда был достигнут выраженный, хороший или удовлетворительный эффект. Данные представлены на рисунках 4 и 5.
Достоверных изменений динамики параметров пенильного кровотока при выполнении фармакодопплерографии в обеих группах наблюдаемых пациентов (основной и контрольной) отмечено не было (p > 0,05).
Безопасность и переносимость препарата оценивалась по изменению лабораторных показателей, полученных в результате клинического, биохимического исследования крови, динамики показателей гормонального профиля плазмы крови, а также клинического исследования мочи. При этом нежелательных явлений, связанных с приемом исследуемого препарата, не было зафиксировано ни в одном случае у пациентов обеих исследуемых групп. Все пациенты завершили исследование согласно протоколу, случаев исключения пациентов из исследования зафиксировано не было.
Заключение
Согласно комплексной оценке со стороны пациентов и врача, БАД Вука ВукаÒ эффективен в диапазоне от 48% до 64% (при эффекте плацебо 24%) у пациентов всех возрастных групп с ЭД различной этиологии и давностью проявлений, а также сопутствующими заболеваниями различной степени тяжести.
БАД характеризуется высокой безопасностью и переносимостью, в том числе у пациентов с выраженными интеркуррентными заболеваниями. Клинический эффект препарата проявляется при его применении в течение не менее 30 дней. Препарат не оказывает выраженного влияния на гомеостаз, что подтверждается в том числе отсутствием изменений основных биохимических показателей.
Таким образом, БАД Вука ВукаÒ может быть использован как в качестве средства монотерапии ЭД, так и в комплексном лечении этого заболевания в сочетании с другими методами и лекарственными средствами. Анализ тенденций эффективности при применении сексологического тестирования, лабораторных и инструментальных методов позволяет предположить усиление терапевтического действия препарата при увеличении его суточного и курсового приема, что, соответственно, требует дальнейшего изучения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.