количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Безопасность и эффективность введения препарата Амелотекс® в триггерные зоны при нижнепоясничном болевом синдроме
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология и Психиатрия" №5 (47)
- Аннотация
- Статья
- Ссылки
- English
В статье представлены результаты клинического исследования эффективности инъекций мелоксикама при люмбоишиалгическом синдроме. Введение препаратов мелоксикама в триггерные точки и внутримышечно продемонстрировало достоверное уменьшение интенсивности болевого синдрома, наибольший эффект был достигнут после третьего дня лечения. При этом на фоне инъекций в триггерные точки отмечалось более существенное снижение показателей выраженности нейродистрофического синдрома и улучшение качества жизни пациентов. Применение препаратов мелоксикама не сопровождалось серьезными побочными эффектами.
В статье представлены результаты клинического исследования эффективности инъекций мелоксикама при люмбоишиалгическом синдроме. Введение препаратов мелоксикама в триггерные точки и внутримышечно продемонстрировало достоверное уменьшение интенсивности болевого синдрома, наибольший эффект был достигнут после третьего дня лечения. При этом на фоне инъекций в триггерные точки отмечалось более существенное снижение показателей выраженности нейродистрофического синдрома и улучшение качества жизни пациентов. Применение препаратов мелоксикама не сопровождалось серьезными побочными эффектами.
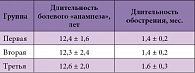
Таблица 1. Продолжительность болевого синдрома в изучаемых группах

Рис. 1. Динамика болевого синдрома по визуально-аналоговой шкале
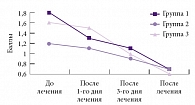
Рис. 2. Динамика объема движений по шкале пятибалльной оценки вертеброневрологической симптоматики
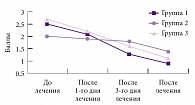
Рис. 3. Динамика нейродистрофического синдрома по шкале пятибалльной оценки вертеброневрологической симптоматики

Таблица 2. Оценка эффективности лечения по опроснику МакГилла
Введение
Болевой спондилогенный синдром является междисциплинарной проблемой и остается объектом внимания врачей различных специальностей. В России боли в нижней части спины составляют от 20 до 80% случаев временной нетрудоспособности в активной социальной группе и 20,4% в общей структуре инвалидности при дегенеративных заболеваниях костно-суставной системы [1–3].
В отечественной классификации люмбоишиалгический синдром был отнесен к рефлекторным вертеброгенным болевым синдромам, предполагая боль в поясничной области с иррадиацией в ногу без неврологических дефицитов. В качестве источников рефлекторной импульсации рассматриваются дегенеративно-дистрофические изменения мышечно-связочных структур позвоночно-двигательного сегмента, включая изменения в диске, межпозвонковых (фасеточных) суставах и др. [2].
В Международной классификации болезней Х пересмотра определение «люмбоишиалгический синдром» не только фигурирует как рефлекторный болевой синдром, но и используется при указании на наличие болевого синдрома при корешковых (компрессионных, ишемических) проявлениях. Таким образом, данная дефиниция приобретает более широкое толкование.
Благодаря новым данным по нейрофизиологии болевого синдрома изменяются подходы в лечении болевых спондилогенных синдромов. В последние годы значительно возрос интерес неврологов к проблеме миофасциального болевого синдрома. Во многом это вызвано появлением труда Д.Г. Симонса и соавт., которые определили миофасциальную боль как «локальную неспецифическую мышечную боль, обусловленную возникновением в мышце фокусов повышенной раздражимости (триггерных точек)». Существенно, что воспроизводимость боли – одно из необходимых условий диагностики миофасциальных синдромов, поэтому для подтверждения диагноза необходимо воспроизвести ту боль, на которую жалуется больной, надавив на активную триггерную точку [4].
Абсолютно доказанной считается необходимость как можно скорейшего обезболивания пациента. Чем раньше начато лечение и быстрее достигнут значимый анальгетический эффект, тем меньше вероятность хронизации боли и лучше общий прогноз. Общепризнанным для болей в спине является обезболивание с помощью нестероидных противовоспалительных препаратов [5–7]. Имеются данные о преимуществе введения различных препаратов (Новокаин и Лидокаин [4], бетаметазон [8], толперизон [9] и т.д.) в триггерные точки при лечении болевого синдрома по сравнению с обычным внутримышечным введением.
Нами предпринята попытка изучить воздействие на триггерные точки селективного ингибитора циклооксигеназы 2 мелоксикама у пациентов с люмбоишиалгическим синдромом. Этот препарат был выбран по ряду причин. Во-первых, на сегодняшний день на российском рынке мелоксикам является единственным селективным ингибитором циклооксигеназы 2 в инъекционной форме. Во-вторых, результаты многих клинических исследований свидетельствуют о достаточно высокой эффективности мелоксикама в лечении болей в нижней части спины, которая довольно редко сопровождается развитием побочных явлений [10–14]. В-третьих, одним из осложнений при локальном введении нестероидных противовоспалительных препаратов являются местное раздражение и очаговый некроз тканей, подтвержденные повышением уровня креатинфосфокиназы. Ни в исследованиях на добровольцах, ни в клинических исследованиях после внутримышечного введения мелоксикама повышения креатинфосфокиназы – изофермента, специфического для скелетных мышц, – отмечено не было [15]. Мелоксикам не вызывает местного раздражения и очагового некроза тканей, что является несомненным преимуществом препарата и обусловливает возможность его введения в триггерные зоны.
Материал и методы
С целью изучения эффективности различных лечебных комплексов проведено рандомизированное контролируемое клиническое исследование. Обследованные 62 пациента распределялись по группам с помощью генератора случайных чисел, при этом в группах не отмечалось существенных различий по профессиональному составу, возрасту, сопутствующей патологии – факторам, которые могли бы повлиять на исход лечения.
Обязательным критерием включения было наличие нижнепоясничного болевого синдрома. Критериями исключения являлись непереносимость мелоксикама, наличие «аспириновой триады», язвенная болезнь желудка и/или двенадцатиперстной кишки в стадии обострения, клинически значимые нарушения функции печени или почек, а также беременность и кормление грудью.
Продолжительность болевого анамнеза, а также обострения в исследуемых группах была сопоставима (р > 0,05) (табл. 1). В 1-й группе (n = 21) пациентам в триггерные точки вводился Мовалис по 15 мг/1,5 мл ежедневно в течение 3 суток с последующим назначением таблетированной формы 15 мг ежедневно в течение 20 суток. Наиболее часто триггерные зоны локализовались у гребня подвздошной кости (место прикрепления средней ягодичной мышцы), в проекции крестцово-подвздошного сочленения, паравертебрально. Во 2-й группе (n = 21) пациентам внутримышечно вводился Мовалис по 15 мг/1,5 мл (1 ампула) ежедневно в течение 3 суток с последующим назначением таблетированной формы 15 мг ежедневно в течение 20 суток. В 3-ю группу было включено 20 пациентов, которым в триггерные точки вводился Амелотекс® по 15 мг/1,5 мл ежедневно в течение 3 суток с последующим назначением таблетированной формы 15 мг ежедневно в течение 20 суток. Всем больным также был назначен массаж пояснично-крестцовой области, лечебная физкультура по стандартным методикам.
Оценка эффективности лечения проводилась по визуально-аналоговой шкале (ВАШ), шкале пятибалльной оценки вертеброневрологической симптоматики [16]. Динамика самочувствия больных оценивалась до лечения, после первого и третьего дня и после завершения курса лечения. Для оценки использовался Oсвестровский опросник нарушений жизнедеятельности при болях в нижней части спины (Oswestry low back pain disability questionnaire) [17], опросник МакГилла (McGill Pain Questionnaire, MPQ).
Обработка данных проводилась с использованием пакета прикладных программ Primer of Biostatistics 4.03 (БИОСТАТ) общепринятыми методами вариационной статистики.
Результаты и обсуждение
По визуально-аналоговой шкале начальный уровень выраженности болевого синдрома в группах был сопоставим. С первого дня лечения было отмечено достоверное уменьшение интенсивности болевого синдрома во всех трех группах (p < 0,05). Более выраженный анальгетический эффект отмечался после третьего дня лечения также во всех трех группах (рис. 1).
Оценка состояния пациентов по шкале пятибалльной оценки вертеброневрологической симптоматики по объему движений и нейродистрофическому синдрому выявила положительную динамику во всех группах. Существенное улучшение показателей объема движений отмечалось в первой и третьей группах уже с первого дня лечения, во второй группе – с третьего дня лечения (p < 0,05) (рис. 2), хотя изначально в первой и третьей группах уровень ограничения движений и показатель нейродистрофического синдрома были несколько выше, чем во второй. К концу лечения улучшение объема движений достоверно (p < 0,05) отмечено во всех трех группах. После завершения курса лечения снижение показателей выраженности нейродистрофического (миофасциального) синдрома в первой и третьей группах достоверно отличались (p < 0,05), а во второй группе наблюдалась тенденция к уменьшению степени нейродистрофических проявлений (рис. 3). Положительная динамика по показателю «корешковый синдром» определена во всех трех группах с третьего дня лечения (p < 0,05). Динамики по сколиозу не отмечено ни в одной из групп (p > 0,05).
Оценка эффективности лечения по опроснику МакГилла, детализирующему интенсивность и характер болевых ощущений показала, что сумма рангов и число слов дескрипторов в группах до лечения сопоставимы (табл. 2). Достоверное улучшение по сумме рангов было отмечено во всех группах, но во второй группе (8,6 ± 1,7) и третьей (11,8 ± 2,2) оно было более выражено, чем в первой (17,8 ± 2,3). По количеству слов-дескрипторов достоверное улучшение наблюдалось во всех трех группах.
При оценке эффективности лечения по Освестровскому опроснику, оценивающему качество жизни пациентов, были получены достоверные различия во всех трех группах (p < 0,05). Улучшение было отмечено во всех трех группах, но было более выражено в первой группе (42,0 ± 2,6 до и 28,1 ± 2,7 после лечения, p < 0,01) и третьей группе (44,7 ± 2,8 до и 24,6 ± 2,4 после лечения, p < 0,01). Менее выражено улучшение во второй группе до и после лечения (30,1 ± 2,4 и 19,6 ± 2,0 соответственно).
При введении мелоксикама во всех группах как в триггерные зоны, так и внутримышечно не было отмечено местных побочных явлений. Анализ динамики креатинфосфокиназы показал, что в первой группе в пяти случаях имело место повышение креатинфосфокиназы после блокад, но в пределах диапазона нормы. Во второй группе повышение фермента зарегистрировано в трех случаях, и лишь в одном концентрация превысила норму. В первой группе у двух больных выявлено повышение артериального давления, диспепсические расстройства – у двух пациентов. В одном случае после первой блокады Мовалисом были жалобы на головную боль, тем не менее лечение было продолжено и впоследствии головные боли не повторялись.
Во второй группе у двух больных зарегистрировано повышение артериального давления, у двух – диспепсические расстройства, у одного – обострение хронического эрозивного гастрита.
В группе 3 (введение препарата Амелотекс®) в двух случаях отмечалось повышение артериального давления, в одном случае – диспепсические проявления. Повышенный уровень креатинфосфокиназы, но в пределах нормы, выявлен у одного пациента, и у двух – повышение трансаминаз также в пределах нормы.
Выводы
Предложенные методы введения препаратов мелоксикама в триггерные зоны и внутримышечно при нижнепоясничном болевом синдроме показали достоверную эффективность уже с первого дня лечения, достигая уменьшения интенсивности болевого синдрома к третьему дню лечения. В группах 1 и 3 достигнута одинаковая эффективность.
При ведении препаратов Мовалис и Амелотекс® как в триггерные зоны, так и внутримышечно не было отмечено местных побочных явлений. Количество больных с диспепсическими расстройствами и кратковременным повышением артериального давления было сопоставимо группах. Введение препарата Амелотекс® в триггерные зоны при нижнепоясничном болевом синдроме является высокоэффективным и безопасным методом лечения и может быть рекомендовано для использования в практическом здравоохранении.
Болевой спондилогенный синдром является междисциплинарной проблемой и остается объектом внимания врачей различных специальностей. В России боли в нижней части спины составляют от 20 до 80% случаев временной нетрудоспособности в активной социальной группе и 20,4% в общей структуре инвалидности при дегенеративных заболеваниях костно-суставной системы [1–3].
В отечественной классификации люмбоишиалгический синдром был отнесен к рефлекторным вертеброгенным болевым синдромам, предполагая боль в поясничной области с иррадиацией в ногу без неврологических дефицитов. В качестве источников рефлекторной импульсации рассматриваются дегенеративно-дистрофические изменения мышечно-связочных структур позвоночно-двигательного сегмента, включая изменения в диске, межпозвонковых (фасеточных) суставах и др. [2].
В Международной классификации болезней Х пересмотра определение «люмбоишиалгический синдром» не только фигурирует как рефлекторный болевой синдром, но и используется при указании на наличие болевого синдрома при корешковых (компрессионных, ишемических) проявлениях. Таким образом, данная дефиниция приобретает более широкое толкование.
Благодаря новым данным по нейрофизиологии болевого синдрома изменяются подходы в лечении болевых спондилогенных синдромов. В последние годы значительно возрос интерес неврологов к проблеме миофасциального болевого синдрома. Во многом это вызвано появлением труда Д.Г. Симонса и соавт., которые определили миофасциальную боль как «локальную неспецифическую мышечную боль, обусловленную возникновением в мышце фокусов повышенной раздражимости (триггерных точек)». Существенно, что воспроизводимость боли – одно из необходимых условий диагностики миофасциальных синдромов, поэтому для подтверждения диагноза необходимо воспроизвести ту боль, на которую жалуется больной, надавив на активную триггерную точку [4].
Абсолютно доказанной считается необходимость как можно скорейшего обезболивания пациента. Чем раньше начато лечение и быстрее достигнут значимый анальгетический эффект, тем меньше вероятность хронизации боли и лучше общий прогноз. Общепризнанным для болей в спине является обезболивание с помощью нестероидных противовоспалительных препаратов [5–7]. Имеются данные о преимуществе введения различных препаратов (Новокаин и Лидокаин [4], бетаметазон [8], толперизон [9] и т.д.) в триггерные точки при лечении болевого синдрома по сравнению с обычным внутримышечным введением.
Нами предпринята попытка изучить воздействие на триггерные точки селективного ингибитора циклооксигеназы 2 мелоксикама у пациентов с люмбоишиалгическим синдромом. Этот препарат был выбран по ряду причин. Во-первых, на сегодняшний день на российском рынке мелоксикам является единственным селективным ингибитором циклооксигеназы 2 в инъекционной форме. Во-вторых, результаты многих клинических исследований свидетельствуют о достаточно высокой эффективности мелоксикама в лечении болей в нижней части спины, которая довольно редко сопровождается развитием побочных явлений [10–14]. В-третьих, одним из осложнений при локальном введении нестероидных противовоспалительных препаратов являются местное раздражение и очаговый некроз тканей, подтвержденные повышением уровня креатинфосфокиназы. Ни в исследованиях на добровольцах, ни в клинических исследованиях после внутримышечного введения мелоксикама повышения креатинфосфокиназы – изофермента, специфического для скелетных мышц, – отмечено не было [15]. Мелоксикам не вызывает местного раздражения и очагового некроза тканей, что является несомненным преимуществом препарата и обусловливает возможность его введения в триггерные зоны.
Материал и методы
С целью изучения эффективности различных лечебных комплексов проведено рандомизированное контролируемое клиническое исследование. Обследованные 62 пациента распределялись по группам с помощью генератора случайных чисел, при этом в группах не отмечалось существенных различий по профессиональному составу, возрасту, сопутствующей патологии – факторам, которые могли бы повлиять на исход лечения.
Обязательным критерием включения было наличие нижнепоясничного болевого синдрома. Критериями исключения являлись непереносимость мелоксикама, наличие «аспириновой триады», язвенная болезнь желудка и/или двенадцатиперстной кишки в стадии обострения, клинически значимые нарушения функции печени или почек, а также беременность и кормление грудью.
Продолжительность болевого анамнеза, а также обострения в исследуемых группах была сопоставима (р > 0,05) (табл. 1). В 1-й группе (n = 21) пациентам в триггерные точки вводился Мовалис по 15 мг/1,5 мл ежедневно в течение 3 суток с последующим назначением таблетированной формы 15 мг ежедневно в течение 20 суток. Наиболее часто триггерные зоны локализовались у гребня подвздошной кости (место прикрепления средней ягодичной мышцы), в проекции крестцово-подвздошного сочленения, паравертебрально. Во 2-й группе (n = 21) пациентам внутримышечно вводился Мовалис по 15 мг/1,5 мл (1 ампула) ежедневно в течение 3 суток с последующим назначением таблетированной формы 15 мг ежедневно в течение 20 суток. В 3-ю группу было включено 20 пациентов, которым в триггерные точки вводился Амелотекс® по 15 мг/1,5 мл ежедневно в течение 3 суток с последующим назначением таблетированной формы 15 мг ежедневно в течение 20 суток. Всем больным также был назначен массаж пояснично-крестцовой области, лечебная физкультура по стандартным методикам.
Оценка эффективности лечения проводилась по визуально-аналоговой шкале (ВАШ), шкале пятибалльной оценки вертеброневрологической симптоматики [16]. Динамика самочувствия больных оценивалась до лечения, после первого и третьего дня и после завершения курса лечения. Для оценки использовался Oсвестровский опросник нарушений жизнедеятельности при болях в нижней части спины (Oswestry low back pain disability questionnaire) [17], опросник МакГилла (McGill Pain Questionnaire, MPQ).
Обработка данных проводилась с использованием пакета прикладных программ Primer of Biostatistics 4.03 (БИОСТАТ) общепринятыми методами вариационной статистики.
Результаты и обсуждение
По визуально-аналоговой шкале начальный уровень выраженности болевого синдрома в группах был сопоставим. С первого дня лечения было отмечено достоверное уменьшение интенсивности болевого синдрома во всех трех группах (p < 0,05). Более выраженный анальгетический эффект отмечался после третьего дня лечения также во всех трех группах (рис. 1).
Оценка состояния пациентов по шкале пятибалльной оценки вертеброневрологической симптоматики по объему движений и нейродистрофическому синдрому выявила положительную динамику во всех группах. Существенное улучшение показателей объема движений отмечалось в первой и третьей группах уже с первого дня лечения, во второй группе – с третьего дня лечения (p < 0,05) (рис. 2), хотя изначально в первой и третьей группах уровень ограничения движений и показатель нейродистрофического синдрома были несколько выше, чем во второй. К концу лечения улучшение объема движений достоверно (p < 0,05) отмечено во всех трех группах. После завершения курса лечения снижение показателей выраженности нейродистрофического (миофасциального) синдрома в первой и третьей группах достоверно отличались (p < 0,05), а во второй группе наблюдалась тенденция к уменьшению степени нейродистрофических проявлений (рис. 3). Положительная динамика по показателю «корешковый синдром» определена во всех трех группах с третьего дня лечения (p < 0,05). Динамики по сколиозу не отмечено ни в одной из групп (p > 0,05).
Оценка эффективности лечения по опроснику МакГилла, детализирующему интенсивность и характер болевых ощущений показала, что сумма рангов и число слов дескрипторов в группах до лечения сопоставимы (табл. 2). Достоверное улучшение по сумме рангов было отмечено во всех группах, но во второй группе (8,6 ± 1,7) и третьей (11,8 ± 2,2) оно было более выражено, чем в первой (17,8 ± 2,3). По количеству слов-дескрипторов достоверное улучшение наблюдалось во всех трех группах.
При оценке эффективности лечения по Освестровскому опроснику, оценивающему качество жизни пациентов, были получены достоверные различия во всех трех группах (p < 0,05). Улучшение было отмечено во всех трех группах, но было более выражено в первой группе (42,0 ± 2,6 до и 28,1 ± 2,7 после лечения, p < 0,01) и третьей группе (44,7 ± 2,8 до и 24,6 ± 2,4 после лечения, p < 0,01). Менее выражено улучшение во второй группе до и после лечения (30,1 ± 2,4 и 19,6 ± 2,0 соответственно).
При введении мелоксикама во всех группах как в триггерные зоны, так и внутримышечно не было отмечено местных побочных явлений. Анализ динамики креатинфосфокиназы показал, что в первой группе в пяти случаях имело место повышение креатинфосфокиназы после блокад, но в пределах диапазона нормы. Во второй группе повышение фермента зарегистрировано в трех случаях, и лишь в одном концентрация превысила норму. В первой группе у двух больных выявлено повышение артериального давления, диспепсические расстройства – у двух пациентов. В одном случае после первой блокады Мовалисом были жалобы на головную боль, тем не менее лечение было продолжено и впоследствии головные боли не повторялись.
Во второй группе у двух больных зарегистрировано повышение артериального давления, у двух – диспепсические расстройства, у одного – обострение хронического эрозивного гастрита.
В группе 3 (введение препарата Амелотекс®) в двух случаях отмечалось повышение артериального давления, в одном случае – диспепсические проявления. Повышенный уровень креатинфосфокиназы, но в пределах нормы, выявлен у одного пациента, и у двух – повышение трансаминаз также в пределах нормы.
Выводы
Предложенные методы введения препаратов мелоксикама в триггерные зоны и внутримышечно при нижнепоясничном болевом синдроме показали достоверную эффективность уже с первого дня лечения, достигая уменьшения интенсивности болевого синдрома к третьему дню лечения. В группах 1 и 3 достигнута одинаковая эффективность.
При ведении препаратов Мовалис и Амелотекс® как в триггерные зоны, так и внутримышечно не было отмечено местных побочных явлений. Количество больных с диспепсическими расстройствами и кратковременным повышением артериального давления было сопоставимо группах. Введение препарата Амелотекс® в триггерные зоны при нижнепоясничном болевом синдроме является высокоэффективным и безопасным методом лечения и может быть рекомендовано для использования в практическом здравоохранении.
1. Павленко С.С. Боли в нижней части спины (эпидемиология, клинико-диагностическая классификация, современные направления в диагностике, лечении и стандартизации медицинской помощи): руководство. Новосибирск: Сибмедиздат НГМУ, 2007. 172 с.
2. Попелянский Я.Ю. Ортопедическая неврология (вертеброневрология): руководство для врачей. 5-е изд. М.: Медпресс-информ, 2011. 672 с.
3. The low back pain. Handbook. A Guide for the Practicing Clinician. / Ed. by A.J. Cole, S.A. Herring. 2nd ed. Philadelphia: Hanley & Belfus, Inc, 2003. 67 p.
4. Симонс Д.Г., Трэвелл Ж.Г., Симонс Л.С. Миофасциальные боли и дисфункции: руководство по триггерным точкам. Т. 1. Верхняя половина туловища. 2-е изд., перераб. и доп. М.: Медицина, 2005. 1192 с.
5. Borenstein D.G. Epidemiology, etiology, diagnostic evaluation, and treatment of low back pain // Curr. Opin. Rheumatol. 1999. Vol. 11. № 2. P. 151–157.
6. Koes B.W., van Tuider M.W., Thomas S. Diagnosis and treatment of low back pain // BMJ. 2006. Vol. 332. № 7555. P. 1430–1434.
7. Ehrlich G.E., Khaltaev N.G. Low back pain initiative. Geneva: WHO, 1999. 152 p.
8. Широков В.А. Диагностический алгоритм при боли в области плечевого пояса // Вертеброневрология. 2002. № 1–2. С. 111–114.
9. Скоромец А.А., Андреев А.В., Громова О.А. Применение мидокалмовых блокад в лечении спондилогенных поясничных болевых синдромов. Результаты двойного слепого исследования // Русский медицинский журнал. 2002. Т. 10. № 21. С. 968–971.
10. Алексеев В.В., Подчуфарова Е.В. Мелоксикам в лечении люмбоишиалгического синдрома // Патогенез. 2005. Т. 3. № 1. С. 59.
11. Бадокин В.В. Переносимость и безопасность мелоксикама // Русский медицинский журнал. 2007. Т. 15. № 26. С. 2037–2041.
12. Одинак М.М., Емелин А.Ю. Применение Мовалиса в лечении дорсопатий // Журнал неврологии и психиатрии им. С.С. Корсакова. 2004. Т. 104. № 12. С. 29–32.
13. Bosch H.C., Sigmund R., Hettich M. Efficacy and tolerability of intramuscular and oral meloxicam in patients with acute lumbago: comparison with intramuscular and oral piroxicam // Curr. Med. Res. Opinion. 1997. Vol. 14. № 1. P. 29–38.
14. Colberg K., Netting M., Sigmund R. et al. The efficacy and tolerability of an 8-day administration of intravenous and oral meloxicam: a comparison with intramuscular and oral diclofenac in patients with acute lumbago // Curr. Med. Res. Opinion. 1996. Vol. 13. № 7. P. 363–377.
15. Цветкова Е.С. Мелоксикам: применение внутримышечной формы в ревматологии // Терапевтический архив. 2003. № 8. С. 96–97.
16. Шкалы, тесты и опросники в медицинской реабилитации / под ред. А.Н. Беловой, О.И. Щепетовой. М.: Антидор, 2002. 40 с.
17. Fairbank J.C., Couper J., Davies J.B. et al. The Oswestry low back pain disability questionnaire // Physiotherapy. 1980. Vol. 66. № 8. P. 271–273.
Safety and efficacy of Amelotex administered in trigger zones in patients with lower lumbar pain syndrome
V.A. Shirokov
V.A. Shirokov
A.V. Potaturko
I.M. Goncharenko
Yekaterinburg Medical Research Centre for Prophylaxis and Health Protection in Industrial Workers, Chair of Neurology
Contact person: Vasily Afanasyevich Shirokov, vashirokov@gmail.com
Results of clinical study on efficacy of meloxicam injected to patients with lumboischialgic syndrome are presented. There was found that after meloxicam was injected in trigger points as well as intramuscularly it resulted in a significantly reduced intensity of pain syndrome, reaching a maximum effect after the 3rd day of therapy. Furthermore, when meloxicam was injected in trigger points it led to a more pronouncedly reduced intensity of neurodistrophic syndrome as well as improved patients’ life quality. Administration of meloxicam was not accompanied by any serious side effects.
Key words: lumboischialgic syndrome, trigger points, meloxicam, Amelotex
Yekaterinburg Medical Research Centre for Prophylaxis and Health Protection in Industrial Workers, Chair of Neurology
Contact person: Vasily Afanasyevich Shirokov, vashirokov@gmail.com
Results of clinical study on efficacy of meloxicam injected to patients with lumboischialgic syndrome are presented. There was found that after meloxicam was injected in trigger points as well as intramuscularly it resulted in a significantly reduced intensity of pain syndrome, reaching a maximum effect after the 3rd day of therapy. Furthermore, when meloxicam was injected in trigger points it led to a more pronouncedly reduced intensity of neurodistrophic syndrome as well as improved patients’ life quality. Administration of meloxicam was not accompanied by any serious side effects.
Key words: lumboischialgic syndrome, trigger points, meloxicam, Amelotex
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье представлены результаты клинического исследования эффективности инъекций мелоксикама при люмбоишиалгическом синдроме. Введение препаратов мелоксикама в триггерные точки и внутримышечно продемонстрировало достоверное уменьшение интенсивности болевого синдрома, наибольший эффект был достигнут после третьего дня лечения. При этом на фоне инъекций в триггерные точки отмечалось более существенное снижение показателей выраженности нейродистрофического синдрома и улучшение качества жизни пациентов. Применение препаратов мелоксикама не сопровождалось серьезными побочными эффектами.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
