Вопросы ранней диагностики и лечения остеоартрита, развившегося у больных ревматоидным артритом
- Аннотация
- Статья
- Ссылки
- English

Введение
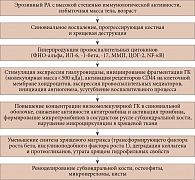
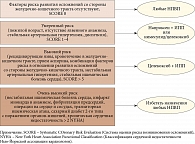
У больных ревматоидным артритом (РА) старше 40 лет среди коморбидных патологий доминирует остеоартрит (ОА) – 50,7% случаев. У 71,5% пациентов он развивается через один – пять лет после дебюта РА, у 70,1% из них носит вторичный характер, то есть является осложнением РА [1, 2]. Частота встречаемости ОА увеличивается у лиц, не достигающих эффекта от терапии РА [3]. Это свидетельствует о том, что РА является независимым фактором риска развития и прогрессирования ОА. Механизмы формирования вторичного ОА представлены на рис. 1 [4].
В исследованиях J. Haschka и соавт. (2016) [5] выявлена корреляция между общим количеством эрозий при РА и количеством остеофитов (р < 0,001), размером эрозий и остеофитов (р < 0,001), количеством остеофитов и возрастом больных (р < 0,001), количеством остеофитов и активностью РА (р = 0,001), количеством остеофитов и значениями по опроснику оценки здоровья (Health Assessment Questionare – HAQ) (р = 0,013). Исследователи также отметили, что количество (р = 0,033) и размер (р < 0,001) остеофитов значительно увеличивались у больных с длительным течением РА.
И.А. Стародубцева и соавт. (2015) [2] установили факторы риска развития вторичного ОА у пациентов с РА. К таковым были отнесены высокая активность патологии по индексу активности болезни (Disease Activity Score – DAS) 28 на момент проведения исследования и в анамнезе (отношение риска (OP) 1,6; р < 0,01), утренняя скованность > 120 минут (OP 2,1; р < 0,01), боль по визуальной аналоговой шкале (ВАШ) ≥ 50 мм (OP 1,7; р < 0,01), возраст ≥ 40 лет (OP 1,14; р < 0,01), индекс массы тела > 25 кг/м2 (OP 1,54; р < 0,01), общий холестерин > 5 ммоль/л (OP 1,57; р < 0,01), внутрисуставное введение глюкокортикостероидов (ГКС) в анамнезе (OP 2,0; р < 0,01). Сочетание указанных факторов ассоциировалось с повышением риска развития вторичного ОА в два раза. У 92% больных с вторичным ОА отмечалось снижение качества жизни по HAQ [2].
В отличие от первичного ОА вторичный развивается в более молодом возрасте, дегенеративные изменения носят полиартикулярный характер [6]. Хроническое течение РА с выраженной тенденцией к прогрессированию деструкции суставов может приводить не только к развитию, но и прогрессированию вторичного ОА. Как следствие, ранняя инвалидизация и снижение качества жизни.
Диагностика
Общепризнанным методом диагностики вторичного ОА при РА является магнитно-резонансная томография (МРТ) коленного сустава с акцентом на суставной хрящ, которая предполагает получение Т2- и протонно-взвешенных изображений с применением программ жироподавления и Т1-взвешенных градиентных последовательностей [7]. Использование подобного протокола обследования оказывается недостаточно эффективным, особенно в дебюте ОА.
Основными методами, позволяющими проводить оценку хрящевой ткани на этапе изменения структуры и концентрации коллагена, протеогликанов и межклеточной жидкости, являются картирование суставного хряща Т2, Т1 (Т1rho) - количественное измерение толщины и объема суставного хряща, а также отсроченное МР-контрастирование суставного хряща препаратами гадолиния (dGERMIC).
Т2-картирование – это магнитно-резонансное исследование с последующей реконструкцией и построением цветных Т2-карт. В основе Т2-картирования суставного хряща лежит многосрезовое мультиспин-эхо (минимум семь). В среднем продолжительность подобной программы на томографе 3,0 Т составляет от четырех до семи минут.
Количественная оценка времени Т2-релаксации – неинвазивный маркер дегенерации суставного хряща, так как этот параметр зависит от степени гидратации ткани и ее биохимического состава. Т2-релаксация отражает способность молекул водорода к перемещению и межмолекулярному энергетическому взаимодействию в хрящевом матриксе и напрямую зависит от микроскопической подвижности системы. В неизмененном суставном хряще большая часть воды находится в связанном состоянии с окружающими макромолекулами, что обусловливает низкую интенсивность МР-сигнала в последовательностях с длинным временем эхо, то есть на Т2-взвешенных изображениях (табл.). Нарушение структуры протеогликано-коллагенового комплекса и анизотропное распределение Col2a1 приводят к уменьшению микровязкости и увеличению содержания свободной жидкости в матриксе. Повышение гидрофильности хряща обусловливает увеличение времени Т2-релаксации.
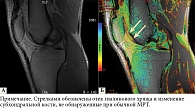
Иммобилизация водных протонов в хрящевой ткани с помощью матрикса «коллаген – протеогликан» способствует затуханию сигнала Т2, в то время как подвижные водные протоны синовиальной жидкости сохраняют высокий сигнал Т2. Потеря коллагена и протеогликанов при дегенерации хряща увеличивает подвижность молекул воды, вследствие чего интенсивность сигнала на Т2-взвешенных изображениях повышается. Таким образом, время релаксации Т2 – это значение, характеризующее анизотропию распределения коллагена и гидрофильность хрящевой ткани сустава (рис. 2) [4].
По мнению большинства авторов, поражение костного мозга в виде отека (остеита) является одним из наиболее значимых факторов прогрессирования ОА.
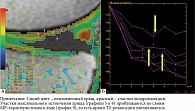
По нашим данным, время Т2-релаксации составляет 27–29 мс для неизмененного хряща и 31–34 мс для участков хондромаляции (рис. 3).
Преимущества Т2-картирования суставного хряща заключаются в том, что это полностью неинвазивный метод, не требующий введения контрастирующих веществ. Он может дополнять стандартный объем импульсных последовательностей, имеет высокую диагностическую значимость на ранних этапах развития гонартроза.
Анализ данных в отношении чувствительности и специфичности разных методов лучевой диагностики раннего ОА позволяет предположить, что каждый из методов обладает своей точкой приложения в диагностике структурных повреждений гиалинового хряща, что в совокупности позволяет верифицировать минимальные проявления ОА (рис. 4) [7].
Профилактика и лечение вторичного остеоартрита
Патогенетическая терапия РА позволяет снизить активность и препятствует деструкции суставов. Поэтому ее можно считать основой профилактики формирования вторичного ОА.
Патогенетическими средствами при ОА считаются метотрексат, лефлуномид, сульфасалазин, генно-инженерные биологические препараты. Однако, учитывая роль воспаления в развитии вторичного ОА, важнейшей составляющей его лечения являются противовоспалительные препараты, преимущественно нестероидные противовоспалительные препараты (НПВП). Доказано, что непрерывное их применение позволяет лучше контролировать симптомы ОА, чем использование по требованию [8].
Противовоспалительное и анальгетическое действие большинства НПВП реализуется за счет подавления активности циклооксигеназы (ЦОГ) – фермента, регулирующего биотрансформацию арахидоновой кислоты в простагландины, простациклин, тромбоксан. На сегодняшний день идентифицированы две ее изоформы: ЦОГ-1 и ЦОГ-2. Они играют разную роль в регуляции физиологических адаптационных и патофизиологических процессов. Так, ЦОГ-1 участвует в поддержании физиологических процессов, ЦОГ-2 – в индукции воспаления при РА.
Данные о роли ЦОГ-2 в индукции и поддержании воспалительного процесса стали предпосылкой для разработки новой группы НПВП – селективных ингибиторов ЦОГ-2, обладающих наименьшим риском развития осложнений со стороны желудочно-кишечного тракта по сравнению с традиционными НПВП при сопоставимости противовоспалительного и обезболивающего действия. Традиционные НПВП – неселективные ингибиторы ЦОГ (диклофенак, ибупрофен, кетопрофен, пироксикам и др.) обладают обезболивающим, жаропонижающим и противовоспалительным эффектами. Однако, как было сказано ранее, на фоне такой терапии нередко развиваются побочные эффекты из-за подавления синтеза физиологической ЦОГ-1. Наиболее частыми признаны эрозивно-язвенные поражения желудочно-кишечного тракта, в первую очередь антрального отдела желудка и/или двенадцатиперстной кишки, и их осложнения (перфорация, кровотечение). К факторам риска развития нежелательных реакций со стороны желудочно-кишечного тракта относят пожилой возраст (старше 75 лет), язвенный анамнез, сочетанное применение ГКС, тяжелые сопутствующие заболевания, прием высоких доз НПВП или одномоментное применение нескольких НПВП.
Для профилактики и лечения НПВП-индуцированных гастропатий используются ингибиторы протонной помпы (ИПП) (Омез 20–40 мг/сут, Ланзап 30–60 мг/сут), синтетические аналоги простагландина Е, мизопростол и др. Блокаторы H2-гистаминовых рецепторов (Ранитидин, Фамотидин) применяются редко из-за низкой эффективности.
Согласно современным рекомендациям, ингибиторы ЦОГ-2 следует назначать в следующих ситуациях:
- при необходимости длительного приема НПВП;
- у пациентов старше 65 лет при наличии язвенных осложнений в анамнезе;
- при наличии тяжелых заболеваний.
Нимесулид (препарат Нимесил®) оказывает выраженный противовоспалительный и анальгетический эффекты при РА и обладает хорошим профилем гастродуоденальной безопасности. Данный препарат относится к производным сульфонанилида и преимущественно ингибирует ЦОГ-2. Основной механизм действия препарата Нимесил® заключается в ингибировании синтеза простагландинов, причем в зоне воспаления оно происходит значительно интенсивнее.
Кроме того, нимесулид и его активный метаболит 4-гидроксинимесулид обладают антиоксидантной активностью. Они подавляют образование свободных радикалов, угнетая экспрессию миелопероксидазы (ММП) и протеиназ. Нимесулид ингибирует высвобождение гистамина из тучных клеток и базофилов.
После применения данный препарат почти полностью всасывается, на его абсорбцию не влияют качество и время приема пищи. Период полувыведения составляет от трех до шести часов. Максимальная суточная доза препарата Нимесил® – 200 мг.
Клиническая эффективность нимесулида при РА доказана результатами многочисленных контролируемых исследований. Так, Р.М. Балабанова и соавт. (2004) [9] установили, что на фоне 12-недельного лечения Нимесилом в комбинации с базисными противовоспалительными препаратами у больных РА количество припухших и болезненных суставов уменьшилось более чем на 30%. Кроме того, такая терапия хорошо переносилась.
Известно, что на фоне лечения нимесулидом у пациентов с хроническими ревматическими заболеваниями и язвенным анамнезом рецидивы язв и эрозий желудка и двенадцатиперстной кишки отмечаются в шесть раз реже, чем при лечении диклофенаком (5,6 и 33,3%). Применение нимесулида редко сопровождается симптомами энтеротоксичности. Однако может привести к повышению уровня аминотрансфераз.
В то же время при исследовании переносимости НПВП выяснилось, что у диклофенака гепатотоксичность выше, чем у напроксена, а у напроксена она выше, чем у пироксикама и нимесулида [10].
При выборе НПВП следует учитывать, что некоторые из них обладают способностью нивелировать антитромботический эффект низких доз аспирина. Речь, в частности, идет об индометацине и ибупрофене. Однако кетопрофен, диклофенак, а также селективные ингибиторы ЦОГ-2 не оказывают данного воздействия. С целью снижения сердечно-сосудистых рисков одновременное назначение низких доз аспирина при терапии НПВП (независимо от их селективности) пациентам с сердечно-сосудистыми факторами риска обязательно [11, 12].
Необходимо отметить, что все НПВП наряду с поражением желудочно-кишечного тракта (неселективные и селективные) потенциально могут влиять на функцию почек и систему кровообращения. У пациентов, перенесших острое нарушение мозгового кровообращения, инфаркт миокарда и аортокоронарное шунтирование, применение НПВП противопоказано из-за высоких сердечно-сосудистых рисков. В этих случаях следует рассмотреть возможность назначения парацетамола, локальное применение НПВП или ГКС (параартикулярно или внутрь сустава).
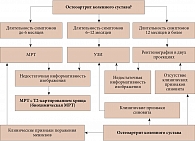
Тактика применения НПВП при наличии риска гастроэнтерологических и кардиоваскулярных осложнений представлена на рис. 5 [13].
В настоящее время нет однозначного мнения в отношении эффективности применения при вторичном ОА у больных РА препаратов замедленного действия, структурно модифицирующих хрящ (symptomatic slow-active drug in osteoarthritis – SYSADOA).
Опыт использования хондроитина сульфата у больных РА описан в работе Е.И. Шмидт и соавт. [14]. В открытом наблюдательном исследовании 20 пациентов с РА и ОА получали хондроитина сульфат по обычной схеме: 500 мг два раза в день. Через шесть месяцев терапии значительно улучшились функциональные возможности суставов (оценивалось по индексу Лекена), уменьшился болевой синдром при движении и в состоянии покоя (по ВАШ). Отмечено выраженное снижение потребности во внутрисуставном введении ГКС. Нежелательных побочных эффектов проводимой терапии не зафиксировано. Врачами эффективность лечения оценена как хорошая в 73,3% случаев, пациентами – в 80%. При выполнении контрольных рентгенограмм по окончании терапии хондроитина сульфатом прогрессирование деструктивных изменений в коленных суставах не выявлено.
И.А. Стародубцева и соавт. [2] изучали эффективность диацереина (50 мг два раза в день) в комбинации с метотрексатом у 122 пациентов с РА и ОА. Применение диацереина в комбинации с метотрексатом у больных РА первой и второй степени активности и ОА через шесть месяцев привело к достоверному снижению уровня интерлейкина (ИЛ) 1, COMP (маркер деградации хряща), С-реактивного белка в сыворотке крови, скорости оседания эритроцитов, что сопровождалось снижением активности РА по DAS 28.
Тайваньские исследователи (2008) [15] оценивали терапевтический эффект внутрисуставных инъекций гиалуроновой кислоты (ГК) у 22 пациентов с РА в стадии ремиссии и ОА коленного сустава второй и третьей степени по классификации Kellgren – Lawrence. Все пациенты получали 1%-ную гиалуроновую кислоту 25 мг/2,5 мл, молекулярная масса – 600–1,170 кДа. Курс терапии – пять инъекций по одной в неделю. Физиотерапевтические процедуры исключались.
Выраженность боли, тугоподвижность/скованность и функциональный статус суставов определяли по индексу выраженности ОА Университетов Западного Онтарио и МакМастера (Western Ontario and McMaster Universities Osteoarthritis Index – WOMAC) до начала лечения, через пять и девять недель (через месяц после последней инъекции гиалуроновой кислоты). В результате внутрисуставного введения препарата отмечено статистически достоверное улучшение всех параметров через пять (p < 0,0167) и девять недель (0,0167) по сравнению с исходными данными. Значительной разницы между результатами, достигнутыми через пять и девять недель, не зафиксировано.
Результаты исследований свидетельствуют, что в условиях in vitro комплексный биоактивный препарат Алфлутоп снижал высвобождение ИЛ-6 в человеческих хондроцитах, стимулированных ИЛ-1-бета [16]. Отмечено также ингибирующее влияние Алфлутопа на внеклеточное высвобождение ИЛ-6 и -8 из хондроцитов человека после их стимуляции фактором некроза опухоли (ФНО) альфа. Алфлутоп значительно снижал уровень внеклеточного фактора роста эндотелия сосудов, что, возможно, связано с его влиянием на снижение активности опосредованных фактором роста эндотелия сосудов деструктивных процессов: стимуляции металлопротеиназ и деградации матричного белка. Обработка хондроцитов препаратом Алфлутоп по сравнению с контролем после стимуляции ФНО-альфа способствовала снижению внеклеточной экспрессии генов ИЛ-6, -8, -1-бета.
Установлено, что Алфлутоп стимулирует пролиферацию хондроцитов, активацию синтеза внеклеточного матрикса посредством модуляции трансформирующего фактора роста бета, ингибирование гиалуронидазы и окислительного стресса, обеспечивает антицитокиновую активность. Такая многоплановая биологическая активность Алфлутопа обусловливает как симптом-модифицирующее, так и структурно-модифицирующее воздействие при ОА [10]. Эти эффекты подтверждают целесообразность применения Алфлутопа при вторичном ОА.
Больным РА и вторичным ОА назначение SYSADOA должно осуществляться по показаниям и только после достижения ремиссии основного заболевания.
Мощным противовоспалительным потенциалом обладают ГКС. Согласно международным рекомендациям по лечению раннего РА, они применяются системно в низких дозах (менее 10 мг/сут преднизолона) на короткий период (менее шести месяцев от начала терапии базисными противовоспалительными средствами) [17].
Локальное применение ГКС также широко практикуется при РА, поскольку позволяет быстро устранить боль, связанную с синовитом [16]. Однако, согласно результатам рандомизированных контролируемых исследований, действие ГКС непродолжительно, а их регулярное применение ускоряет катаболизм суставного хряща и способствует прогрессированию структурных изменений [18].
Заключение
Ранняя диагностика вторичного ОА у больных РА и выбор оптимальной лечебной тактики являются сложной задачей.
Медикаментозную терапию таким больным следует подбирать с учетом особенностей течения болезни, наличия сочетанной патологии, возраста и других факторов.
Снижение активности РА и профилактика деструкции суставов с помощью патогенетической терапии – основа профилактики вторичного ОА.
I.B. Belyayeva, V.I. Mazurov, Ye.A. Trofimov, A.S. Trofimova
I.I. Mechnikov North-West State Medical University
Contact person: Irina Borisovna Belyayeva, belib@mail.ru
In the structure of comorbid pathology in patients with rheumatoid arthritis (RA), osteoarthritis (OA) accounts for 50.7%. T2-mapping of articular cartilage has a high diagnostic ability to detect OA in the early stages. The main method of preventing OA formation in patients with RA is considered to be a decrease in the activity of the main disease and prevention of joint destruction. The latter can be achieved by the appointment of pathogenetic therapy of RA, in particular – the drug nimesil.
Nimesil mainly inhibits cyclooxygenase 2. The drug has a pronounced anti-inflammatory and analgesic effects in RA.
In addition, it has a good profile of gastroduodenal tolerability and cardiovascular safety.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.