Деносумаб при лечении остеопороза у женщин в постменопаузе, страдающих ревматоидным артритом и получающих глюкокортикостероиды
- Аннотация
- Статья
- Ссылки
- English
Деносумаб – полностью человеческое моноклональное антитело, которое связывает RANKL, препятствует взаимодействию с его рецептором на остеокластах, снижает их активность и ингибирует резорбцию костной ткани.
Цель исследования: оценить эффект терапии деносумабом на минеральную плотность кости (МПК) осевого и периферического скелета у больных РА, получающих ГКС, через 12 месяцев наблюдения.
Материал и методы. 66 пациенток в постменопаузе, страдающих РА, с установленным диагнозом ОП получали дважды деносумаб 60 мг (подкожное введение): исходно и через шесть месяцев. МПК измеряли до назначения терапии и через 12 месяцев наблюдения. Для этого проводили двухэнергетическую рентгеновскую абсорбциометрию трех отделов: поясничного отдела позвоночника (L1–L4), шейки бедра (ШБ) и дистального отдела предплечья (ДОП).
Результаты. Средний возраст больных составил 59,6 ± 7,4 года, длительность РА – 17,7 ± 10,4 года. Все получали противовоспалительную терапию, из них 34 (49,3%) – ГКС. Среднее изменение МПК через 12 месяцев терапии деносумабом в группе получавших ГКС составило в L1–L4 +4,7% (от -4,6 до +17,6), в ШБ +2,1% (от -8,7 до +13,5), в ДОП +0,6% (от -13,2 до +30,4). В группе не получавших ГКС среднее изменение МПК было сопоставимым и составило в L1–L4 +4,5% (от -0,8 до +19,6), в ШБ +3,5% (от -14,6 до +21,7), в ДОП +0,9% (от -9,1 до +8,4).
Вывод. Терапия деносумабом в дозе 60 мг (подкожное введение) два раза в год с интервалом шесть месяцев позволила увеличить МПК осевого и периферического скелета независимо от приема ГКС.
Деносумаб – полностью человеческое моноклональное антитело, которое связывает RANKL, препятствует взаимодействию с его рецептором на остеокластах, снижает их активность и ингибирует резорбцию костной ткани.
Цель исследования: оценить эффект терапии деносумабом на минеральную плотность кости (МПК) осевого и периферического скелета у больных РА, получающих ГКС, через 12 месяцев наблюдения.
Материал и методы. 66 пациенток в постменопаузе, страдающих РА, с установленным диагнозом ОП получали дважды деносумаб 60 мг (подкожное введение): исходно и через шесть месяцев. МПК измеряли до назначения терапии и через 12 месяцев наблюдения. Для этого проводили двухэнергетическую рентгеновскую абсорбциометрию трех отделов: поясничного отдела позвоночника (L1–L4), шейки бедра (ШБ) и дистального отдела предплечья (ДОП).
Результаты. Средний возраст больных составил 59,6 ± 7,4 года, длительность РА – 17,7 ± 10,4 года. Все получали противовоспалительную терапию, из них 34 (49,3%) – ГКС. Среднее изменение МПК через 12 месяцев терапии деносумабом в группе получавших ГКС составило в L1–L4 +4,7% (от -4,6 до +17,6), в ШБ +2,1% (от -8,7 до +13,5), в ДОП +0,6% (от -13,2 до +30,4). В группе не получавших ГКС среднее изменение МПК было сопоставимым и составило в L1–L4 +4,5% (от -0,8 до +19,6), в ШБ +3,5% (от -14,6 до +21,7), в ДОП +0,9% (от -9,1 до +8,4).
Вывод. Терапия деносумабом в дозе 60 мг (подкожное введение) два раза в год с интервалом шесть месяцев позволила увеличить МПК осевого и периферического скелета независимо от приема ГКС.

Ревматоидный артрит (РА) – центральная проблема ревматологии. Это наиболее часто встречающееся хроническое аутоиммунное воспалительное заболевание, характеризующееся развитием системного воспалительного поражения внутренних органов и хронического артрита (синовита) [1]. Для РА характерно появление эрозий в мелких суставах кистей и стоп, периартикулярной остеопении [1, 2]. Одним из ключевых факторов, запускающих костную деструкцию при РА, считается активация сигнального пути RANKL (Receptor Activator of Nuclear Factor Kappa B Ligand), который обеспечивает дифференцировку остеокластов, их функциональную активность и выживание [3].
Для подавления аутоиммунного воспаления при РА используются глюкокортикостероиды (ГКС). Однако препараты данного класса наиболее часто становятся причиной вторичного, ГКС-индуцированного остеопороза (ОП) [4]. Установлено, что при ОП, развившемся вследствие приема ГКС, начальная фаза потери костной ткани связана с повышением активности остеокластов и костной резорбции, а следующая фаза – с подавлением активности остеобластов и уменьшением костеобразования. Непрямое влияние ГКС на кость заключается в снижении абсорбции кальция в кишечнике, повышении его экскреции с мочой, гипогонадизме [5, 6]. Влияние ГКС на костную ткань ассоциируется не только со снижением показателей минеральной плотности кости (МПК), но и с изменением скорости костного ремоделирования, минерализации, нарушением микроархитектоники кости [7]. Прием низких доз ГКС (не более 7,5 мг/сут) более 12 месяцев приводит к снижению МПК вне зависимости от сохранности менструального цикла, активности РА и функциональной недостаточности суставов [8–10]. ГКС являются факторами риска не только ОП, но и переломов, в том числе проксимального отдела бедра, при РА [11, 12].
Применение антиостеопоротических средств в комплексном лечении РА является патогенетически обоснованным. Особый интерес представляют результаты терапии принципиально новым лекарственным препаратом деносумабом. Деносумаб – полностью человеческое моноклональное антитело (иммуноглобулин G) к RANKL, которое связывает RANKL и препятствует взаимодействию с его рецептором RANK на поверхности остеокластов. Как следствие, деносумаб ингибирует созревание, выживание и активацию остеокластов, тем самым блокируя резорбцию кости [13].
Цель исследования
Целью настоящей работы стала оценка эффекта терапии деносумабом в течение 12 месяцев на МПК осевого и периферического скелета у пациенток в постменопаузе с ОП, страдающих РА и получающих ГКС.
Материал и методы
В открытое контролируемое нерандомизированное проспективное наблюдательное 12-месячное исследование эффективности и безопасности деносумаба у пациенток в период постменопаузы, страдающих РА, с установленным диагнозом ОП последовательно (по мере обращения) было включено 69 человек в возрасте от 36 до 72 лет. Все участницы отвечали критериям РА (АCR (American College of Rheumatology) 1987 г.) и ОП (рекомендации Российской ассоциации остеопороза 2012 г.) [14].
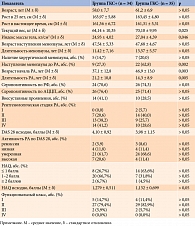
Средний возраст больных составил 59,6 ± 7,4 года, длительность РА – 17,7 ± 10,4 года (от 1,5 до 44 лет).
В зависимости от характера противовоспалительной терапии пациентки были распределены на две группы: получавшие и не получавшие ГКС (ГКС+ и ГКС-). Группа ГКС+ включала 34 больных (49,3%). Доза ГКС составляла от 1 до 15 мг в сутки, средняя суточная доза – 3,4 ± 0,9 мг в сутки, средняя длительность приема – 102,9 ± 81,1 месяца, средняя кумулятивная доза – 16 367,4 ± 5378,7 мг. В группе ГКС- было 35 больных РА (50,7%), 18 из них никогда не принимали ГКС, 17 – не принимали их в течение года до включения в исследование.
Обе группы были сопоставимы по возрасту участниц, основным клиническим характеристикам и проявлениям РА, спектру сопутствующих заболеваний, переломам в анамнезе, количеству пациенток, позитивных по ревматоидному фактору (РФ), антителам к циклическому цитруллинированному пептиду (АЦЦП), проводимой терапии базисными противовоспалительными препаратами. Необходимо отметить, что возраст больных в группе ГКС+ на начало РА был меньше, а длительность РА – больше. В группе ГКС- было больше пациенток, у которых менопауза наступила до начала РА (табл. 1).
Все пациентки находились в периоде менопаузы не менее года.
В течение года до включения в исследование ни одна больная не получала генно-инженерных биологических препаратов и антиостеопоротическую терапию, за исключением препаратов кальция и витамина D.
Малотравматические переломы в анамнезе имело сопоставимое число больных в каждой группе: в группе ГКС+ – 20 (58,8%), в группе ГКС- – 18 (51,4%). Средний возраст пациенток на момент перелома составлял 48,9 ± 10,1 и 50,4 ± 10,8 года соответственно.
Остеопоротические переломы, то есть переломы, произошедшие при минимальной травме или спонтанно на фоне менопаузы, или переломы в возрасте 40 лет и старше зафиксированы у 18 (52,9%) больных в группе ГКС+ и у 18 (51,4%) больных в группе ГКС-. Средний возраст пациенток на момент первого перелома был сопоставим в обеих группах и составлял 48,9 ± 10,1 и 50,4 ± 10,8 года соответственно.
Не установлено различий между группами по МПК в поясничном отделе позвоночника (L1–L4) и дистальном отделе предплечья (ДОП). На момент включения в исследование МПК в L1–L4 в группе ГКС+ составляла 0,809 ± 0,109 г/см², в группе ГКС- – 0,833 ± 0,098 г/см², в ДОП – 0,496 ± 0,113 и 0,499 ± 0,062 г/см² соответственно. Исходно минеральная плотность кости в шейке бедра (ШБ) в группе ГКС+ была ниже, чем в группе ГКС-: 0,598 ± 0,087 против 0,649 ± 0,086 г/см² соответственно.
Из включенных в исследование пациенток 68 получили две подкожные инъекции деносумаба 60 мг (исходно и через шесть месяцев), одна (выбывшая из исследования) – одну инъекцию в течение первых 12 месяцев.
Завершили исследование 66 участниц. Три выбыли из него в связи со сменой места жительства. При проведении статистического анализа в динамике их исходные показатели не учитывались.
Динамическое наблюдение включало пять визитов через каждые три месяца. Оценивались безопасность терапии, показатели общего и биохимического анализов крови (лаборатория Научно-исследовательского института ревматологии им. В.А. Насоновой), число болезненных и припухших суставов, активность РА по DAS 28 (Disease Activity Score), функциональный статус по HAQ (Health Assessment Questionnaire), ежедневная физическая активность (длительность прогулок и ходьбы в день), приверженность противовоспалительной терапии и приему препаратов кальция и витамина D.
У всех больных определена МПК в L1–L4, ШБ, в предплечье в целом (total) и ДОП в динамике (исходно и через 12 месяцев). Для этого проводили двухэнергетическую рентгеновскую абсорбциометрию на аппарате Hologic QDR1000.
На всех пациенток заполнены специально разработанные тематические карты, данные внесены в электронную базу для дальнейшей статистической обработки.
Статистическая обработка материала выполнена с использованием программы Microsoft Excel, а также программы Statistica 6.0, включая общепринятые методы параметрического и непараметрического анализа.
При сравнении параметров с нормальным распределением применялся парный t-тест для независимых выборок. Для параметров, распределение которых отличалось от нормального, при сравнении показателей двух групп использовали критерий Манна – Уитни.
Результаты представлены в виде медианы (М) с интерквартильным размахом [25-й; 75-й перцентили].
Различия считались достоверными при p < 0,05.
Результаты
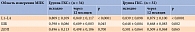
В обеих группах через 12 месяцев терапии деносумабом МПК в L1–L4 и ШБ достоверно увеличилась, в ДОП достигнута стабилизация (табл. 2). У пациенток группы ГКС+ минеральная плотность кости в L1–L4 исходно составляла 0,809 ± 0,109 г/см², через 12 месяцев она увеличилась до 0,849 ± 0,117 г/см² (р < 0,0001). У пациенток группы ГКС- таковая повысилась с 0,839 ± 0,098 до 0,879 ± 0,100 г/см² (р < 0,0001). Минеральная плотность кости в ШБ в группе ГКС+ исходно составляла 0,598 ± 0,086 г/см², в конце наблюдения – 0,609 ± 0,083 г/см² (р = 0,045), в группе ГКС- – 0,648 ± 0,084 и 0,668 ± 0,083 г/см² (р = 0,002) соответственно. Минеральная плотность кости в ДОП в группе ГКС+ исходно была 0,496 ± 0,113 г/см², после 12 месяцев терапии – 0,498 ± 0,106 г/см² (р > 0,05), в группе ГКС- – 0,501 ± 0,064 и 0,509 ± 0,068 г/см² (р > 0,05) соответственно.
Среднее изменение МПК через 12 месяцев терапии деносумабом в группе ГКС+ составило в L1–L4 +4,7% (от -4,6 до +17,6), в ШБ +2,1% (от -8,7 до +13,5), в ДОП +0,6% (от -13,2 до +30,4). В группе ГКС- среднее изменение МПК было сопоставимым: в L1–L4 +4,5% (от -0,8 до +19,6), в ШБ +3,5% (от -14,6 до +21,7), в ДОП +0,9% (от -9,1 до +8,4) (табл. 3).
При оценке влияния терапии деносумабом на показатели активности РА по DAS 28 и функциональный статус по HAQ в обеих группах достоверных изменений не отмечено.
За период наблюдения не зафиксировано серьезных неблагоприятных реакций, связанных с приемом деносумаба и потребовавших отмены препарата, дополнительных назначений лекарственной терапии, госпитализации или какого-либо специального обследования. Только 3 (5,7%) пациентки отмечали незначительное усиление боли в мышцах и суставах в течение трех-четырех дней после первого введения препарата.
У одной пациентки через семь месяцев от начала лечения произошел травматический перелом вследствие падения с лестницы. Однако за помощью она обратилась только через два месяца после события из-за усиления боли в правом плечевом суставе. С помощью компьютерной томографии спустя два с половиной месяца после травмы поставлен диагноз «перелом большого бугорка правой плечевой кости с признаками консолидации; отрыв передненижнего сегмента суставной впадины лопатки справа (повреждение Банкарта)».
Обсуждение результатов
В настоящее время по результатам клинических исследований создана убедительная доказательная база эффективности деносумаба при ОП. Однако сведения о влиянии препарата на МПК у больных, получавших ГКС, единичные, а проспективные многоцентровые плацебоконтролируемые рандомизированные клинические исследования не завершены. Малочисленны и противоречивы данные о применении деносумаба при РА, в том числе о его влиянии на эрозивно-деструктивные изменения в кистях и стопах. Между тем, учитывая механизм действия препарата, использование его при РА представляется перспективным.
Наше исследование выполнено на достаточно репрезентативной выборке постменопаузальных больных РА с длительным течением заболевания, потребовавшим назначения ГКС большому числу больных с осложненным ОП смешанного генеза и возникновением переломов.
Результаты проведенного исследования показали, что лечение ОП у больных РА моноклональными антителами к RANKL эффективно, в том числе на фоне терапии ГКС, что подтверждается увеличением или стабилизацией МПК осевого и периферического скелета: в L1–L4 – у 89,4% пациенток, в ШБ – у 66,7%, в ДОП – у 60,6%. МПК через 12 месяцев терапии увеличилась в среднем в L1–L4 на 4,6%, в ШБ на 2,8%, в ДОП на 0,7%.
Полученные нами в условиях реальной клинической практики данные совпадают с данными 12-месячного рандомизированного двойного слепого плацебоконтролируемого клинического исследования II фазы [15]. Авторы изучали влияние деносумаба на МПК и костное ремоделирование у больных РА, получавших ГКС или бисфосфонаты в качестве сопутствующей терапии. Через 12 месяцев у больных РА, получавших деносумаб по 60 мг (n = 71), МПК в L1–L4 и ШБ достоверно увеличилась по сравнению с таковой у получавших плацебо – независимо от исходной МПК и сопутствующей терапии ГКС.
У наших больных увеличение МПК в L1–L4 и ШБ также происходило независимо от приема ГКС.
Вывод
Полученные результаты позволяют положительно оценивать эффект терапии деносумабом на МПК в L1–L4 при РА (независимо от характера противовоспалительной терапии) и рекомендовать его для включения в комплексную терапию больных РА с ОП.
Прозрачность исследования. Исследование не имело спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях. Все авторы принимали участие в разработке концепции статьи и написании рукописи. Окончательная версия рукописи была одобрена всеми авторами. Авторы не получали гонорар за статью.
P.S. Kovalenko, I.S. Dydykina, A.V. Smirnov, S.I. Glukhova, Ye.L. Nasonov
Research Institute of Rheumatology named after V.A. Nasonova
Contact person: Polina Sergeyevna Kovalenko, polina_dydykina@mail.ru
Therapy of rheumatoid arthritis (RA) is not only aimed at suppressing inflammation, but also preventing local generalized loss of bone tissue, especially in patients receiving glucocorticosteroids (GCS). Denosumab is a promising medicine for treatment of osteoporosis (OP) during RA, including GCS-induced RA.
Denosumab is a fully human monoclonal antibody against RANKL, which hinders its binding to cognate receptor on osteoclasts, lowers its activity and inhibits resorption of bone tissue.
Study objective: to assess effects of 12-month therapy with denosumab on bone mineral density (BMD) in axial and peripheral skeleton of patients with RA receiving GCS.
Materials and Methods. Sixty six post-menopausal women suffering from RA with confirmed OP were given 60 mg denosumab (subcutaneous administration), twice a year. BMD was measured before therapy and 12 months later. For this, dual-energy x-ray absorptiometry was carried out in lumbar (L1–L4), femoral neck (FN) and distal forearm (DF).
Results. Patients enrolled (average age 59.6 ± 7.4 years) suffered from RA for 17.7 ± 10.4 years, and received anti-inflammatory therapy, including GCS (34 patients, 49,3%). After 12 month-therapy with denosumab mean change of BMD in patients receiving GCS was: in L1–L4 +4.7% (from -4.6 to +17.6), in FN +2.1% (from -8.7 to +13.5), in DF +0.6% (from -13.2 to +30.4). Patients receiving GCS had comparable change of average BMD reaching in L1–L4 +4.5% (from -0.8 to +19.6), in FN +3.5% (from -14.6 to +21.7), in DF +0.9% (from -9.1 to +8.4).
Conclusion. Therapy with denosumab at dose of 60 mg (subcutaneous administration) twice a year, with 6-month interval, allowed to increase BMD in axial and peripheral skeleton regardless of using GCS.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.