Взаимосвязь между эрозивно-деструктивными изменениями костной ткани и генерализованным остеопорозом у больных ревматоидным артритом
- Аннотация
- Статья
- Ссылки
- English


Ревматоидный артрит (РА) – аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным воспалительным поражением внутренних органов.
Установлено, что РА является фактором, способствующим потере минеральной плотности кости (МПК), то есть заболеванием, увеличивающим риск развития остеопороза (ОП) [1]. Вторичный ОП при РА диагностируется как у женщин, так и у мужчин, причем во всех возрастных группах. Околосуставной (периартикулярный) ОП – одно из ранних рентгенологических проявлений артрита – развивается еще до образования костных эрозий [2]. По мере увеличения длительности РА развивается генерализованный (распространенный) ОП. Генерализованный ОП присоединяется на более поздних этапах болезни на фоне хронического воспаления, снижения физической активности пациентов. ОП характеризуется уменьшением МПК, изменением качества и микроархитектоники кости, возникновением переломов в различных участках скелета. Генерализованная потеря МПК начинается уже в первые годы болезни. В исследовании BEST у больных с ранней стадией РА через один год с момента начала исследования было отмечено снижение МПК в шейке бедра (ШБ) на 1,4% у мужчин и на 1,5% у женщин, несмотря на проводимую базисную терапию заболевания [3].
В последние годы широко обсуждается положение о том, что прогрессирование эрозивно-деструктивных изменений в кистях и стопах при РА (увеличение числа эрозий) тесно связано со снижением МПК, а увеличение количества и активности остеокластов при РА играет ключевую роль в возникновении эрозий и снижении костной массы [4, 5].
Изучение взаимосвязи между эрозивно-деструктивными изменениями костной ткани и генерализованным остеопорозом у больных ревматоидным артритом очень важно для оценки прогноза течения заболевания и принятия решения о проведении дополнительных диагностических и лечебно-профилактических мероприятий.
Целью исследования стало изучение взаимосвязи между эрозивно-деструктивными изменениями костной ткани и генерализованным остеопорозом у больных ревматоидным артритом.
Материалы и методы исследования
Данная работа является фрагментом многоцентровой программы «Остеопороз при ревматоидном артрите: диагностика, факторы риска, переломы, лечение». В исследовании, проведенном в ФГБУ НИИР РАМН в 2011–2013 гг., участвовали 66 женщин с достоверным РА, отвечавших критериям Американской коллегии ревматологов (American College of Rheumatology, ACR) 1987 г., в возрасте от 18 до 65 лет, с давностью заболевания от полугода до 38 лет. На всех больных были заполнены специально разработанные тематические карты, данные внесены в таблицу Exсel для дальнейшей статистической обработки. Сведения о больных включали результаты опроса и сбора анамнеза, осмотра, анализов крови (скорость оседания эритроцитов, тест на С-реактивный белок, ревматоидный фактор (РФ), гемоглобин, общепринятые биохимические показатели), оценку активности заболевания (DAS28) и качества жизни (оценивавшегося с помощью опросника HAQ (Health Assessment Questionnaire – Опросник для оценки состояния здоровья)). Всем больным выполнили рентгенографию кистей и стоп. Рентгенологические признаки прогрессирования РА оценивали методом Sharp/van der Heijde (число эрозий, выраженность сужений межсуставных щелей кистей и стоп, суммарный индекс Sharp/van der Heijde). Методом двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorbtiometry – DXA) на аппарате Hologic была определена МПК не менее чем в двух из трех изучаемых отделов скелета: в поясничном отделе позвоночника (L1–L4) у 57 больных, в проксимальном отделе бедренной кости у 55 и в дистальном отделе предплечья (ДОП) (средней трети лучевой кости) у 57 пациенток. Рентгенографию и денситометрию (на одном аппарате) проводили в лаборатории лучевой диагностики ФГБУ НИИР РАМН.
Женщинам в пери- и постменопаузе диагноз ОП устанавливали клинически на основании перенесенного при минимальной травме или спонтанного перелома (кроме переломов пальцев или костей черепа) либо по результатам денситометрии: при Т-критерии ≤ -2,5 стандартных отклонения (СО) от пика костной массы или ≤ -1,5 СО на фоне приема глюкокортикостероидов (ГКС). У женщин с сохраненным менструальным циклом диагноз ОП устанавливали по Z-критерию, при значении показателя МПК < -2,0 СО с учетом терапии ГКС или низкотравматических переломов в анамнезе. Остеопению в пери- и постменопаузе определяли по Т-критерию от -1,0 до -2,4 СО. Значения Т-критерия от +2,5 до -0,9 СО соответствовали норме. Поскольку в рекомендациях Всемирной организации здравоохранения, клинических рекомендациях Международной федерации остеопороза (International Osteoporosis Federation – IOF) 2008 г. и клинических рекомендациях Российской ассоциации по остеопорозу 2012 г. для женщин с сохраненным менструальным циклом не определены значения остеопении и нормы, мы распределили таких больных следующим образом: МПК от -1,0 СО до -2,0 СО по Z-критерию – остеопения, МПК > -1,0 СО по Z-критерию – норма.
Статистический анализ проводили с использованием программы Statistica 6.0. Применяли стандартные методы описательной статистики (вычисление средних значений, средних квадратичных отклонений), критерии Краскела – Уоллиса и Стьюдента. Статистическая значимость показателей была определена как р < 0,05. Качественные показатели в двух несвязанных группах сравнивали в таблице сопряженности 2 × 2 с помощью критерия хи-квадрат.
Результаты
Средний возраст больных, включенных в исследование, составил 51,6 ± 9,6 года, средняя длительность РА – 13,2 ± 9,1 года. Позитивными по РФ были 54 (82%) пациентки, негативными – 11 (18%). Терапию ГКС получали 45 (68%) больных. Средний показатель количества эрозий по методу Sharp/van der Heijde составил 38,8 ± 51,5 балла, число суженных щелей – 87,2 ± 41,4 балла, суммарный индекс Sharp/van der Heijde – 125,4 ± 85,4 балла. Среднее значение МПК в L1–L4 составило 0,908 ± 0,147 г/см², в ШБ – 0,695 ± 0,118 г/см², в ДОП – 0,469 ± 0,090 г/см². ОП в L1–L4 выявлен у 13 (23%) больных, в ШБ – у 7 (13%). Наиболее часто ОП диагностировали в ДОП – у 24 (42%) больных. Остеопения в L1–L4 отмечена у 24 (42%) пациенток, в ШБ – у 30 (54%), в ДОП – у 17 (30%). Нормальные значения МПК в L1–L4 наблюдались у 20 (35%), в ШБ – у 18 (33%), в ДОП – у 16 (28%) пациенток (табл. 1).
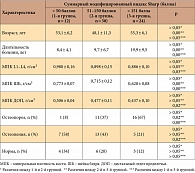
В зависимости от суммарного индекса Sharp больных распределили на 3 группы: 1-я группа – менее 50 баллов (12 (19%) пациенток), 2-я – от 51 до 150 баллов (30 (45%)), 3-я – более 150 баллов (24 (36%)) (табл. 2). Средний возраст пациенток составил 53,1 ± 6,2, 48,1 ± 11,3 и 55,3 ± 6,1 года соответственно. Возраст больных 1-й группы был сопоставим с возрастом больных 2-й и 3-й группы, а средний возраст пациенток 2-й группы был достоверно меньше, чем пациенток 3-й группы. По мере увеличения суммарного индекса Sharp увеличивалась средняя длительность болезни – 8,4 ± 4,1, 9,7 ± 6,7 и 19,9 ± 9,5 года в 1-й, 2-й и 3-й группе соответственно и в 3-й группе она была достоверно больше, чем в 1-й и 2-й. Увеличение суммарного показателя индекса Sharp сопровождалось снижением МПК во всех отделах скелета. МПК больных 3-й группы была достоверно ниже во всех отделах скелета по сравнению с больными 1-й группы и достоверно ниже в ШБ по сравнению с больными 2-й группы. Среднее значение МПК в 1-й, 2-й и 3-й группе соответственно составило:
в L1–L4 – 0,980 ± 0,160, 0,898 ± 0,150 и 0,886 ± 0,100 г/см²;
ШБ – 0,773 ± 0,070, 0,715 ± 0,12 и 0,628 ± 0,08 г/см²;
ДОП – 0,506 ± 0,040, 0,477 ± 0,110 и 0,437 ± 0,100 г/см².
По мере увеличения показателя индекса Sharp возрастало количество больных с ОП и остеопенией. Остеопороз хотя бы в одном из анализируемых участков скелета был выявлен у 1 (8%) больной 1-й группы, у 11 (37%) пациенток 2-й группы и 16 (67%) больных 3-й группы, остеопения – у 7 (58%), 13 (43%) и 5 (21%) больных 1-й, 2-й и 3-й группы соответственно. У больных 3-й группы по сравнению с больными 1-й и 2-й группы частота ОП была достоверно выше (р < 0,001).
При изучении МПК и прогрессирования эрозивных изменений в суставах особый интерес вызывает возраст больных на момент начала РА. В связи с этим мы сформировали три группы в зависимости от возраста на момент начала заболевания. В 1-ю группу вошли пациентки, заболевшие в возрасте от 18 до 30 лет, – 20 (30%), во 2-ю – заболевшие в возрасте от 31 до 50 лет – 36 (55%) и в 3-ю группу – заболевшие в возрасте 51 года и старше – 10 (15%). Характеристика эрозивно-деструктивных изменений и МПК этих больных представлена в табл. 3. Как видим, пациентки 1-й группы были достоверно моложе больных 2-й и 3-й группы, а больные 2-й группы – моложе больных 3-й группы. Средний возраст больных 1-й группы составил 46,7 ± 12,1, 2-й группы – 51,9 ± 6,7 и 3-й группы – 60,3 ± 3,3 года. При этом длительность РА в 1-й группе была достоверно больше, чем во 2-й и 3-й группах, – 21,4 ± 10,7, 10,5 ± 4,6 и 6,75 ± 2,9 года соответственно. В свою очередь длительность болезни во 2-й группе была больше, чем в 3-й (р < 0,05). По мере уменьшения длительности заболевания закономерно и достоверно (между 1-й и 2-й группой, 1-й и 3-й группой (р = 0,02)) снижался показатель числа эрозий с 73,2 ± 63,5 балла в 1-й группе до 24,5 ± 37,5 балла во 2-й и 21,4 ± 35,6 балла в 3-й. Показатель сужения щелей также имел достоверное различие в 1-й и 2-й группах – 107,9 ± 39,1 балла vs 77,1 ± 38,6 балла. В 3-й группе его значение составило 82,5 ± 46,2 балла. Суммарный модифицированный индекс Sharp, так же как показатель числа эрозий, снижался по мере уменьшения длительности заболевания – 181,1 ± 91,3, 100,5 ± 71,5 и 103,9 ± 74,5 балла в 1-й, 2-й и 3-й группе соответственно. Достоверные различия показателей были получены между 1-й и 2-й группой и 1-й и 3-й группой. При этом значения МПК ШБ у пациенток 1-й группы были значимо ниже, чем у пациенток 2-й и 3-й группы, – 0,611 ± 0,080, 0,739 ± 0,111 и 0,713 ± 0,120 г/см² соответственно. Показатели МПК в L1–L4 и в ДОП были сопоставимы во всех группах. Остеопороз хотя бы в одном из анализируемых участков скелета был выявлен у 12 (60%) больных 1-й группы, 12 (33%) 2-й группы и 5 (50%) больных 3-й группы, а остеопения – у 7 (35%), 14 (39%) и 3 (30%) пациенток соответственно.
Заключение
В результате проведенного нами исследования установлена ассоциация между эрозивно-деструктивными изменениями в суставах кистей и стоп и МПК различных отделов скелета. Независимо от возраста больных РА по мере увеличения длительности заболевания возрастает не только показатель суммарного индекса Sharp, но и число больных с ОП. Снижение МПК отмечено преимущественно в ШБ. Пациентки с РА, заболевшие в возрасте до 30 лет (в период формирования костной массы), по сравнению с теми, кто заболел после 50 лет (после наступления менопаузы), также имеют более низкие значения МПК в ШБ, высокий показатель числа эрозий и суммарного индекса Sharp. При этом пациентки, заболевшие до 30 лет, на момент обследования были значительно моложе, но продолжительность РА у них была больше.
Обсуждение
РА характеризуется прогрессированием эрозивно-деструктивного полиартрита, который становится причиной функциональных нарушений, снижения качества жизни и инвалидизации больных. Присоединившийся ОП усугубляет эти нарушения и становится причиной таких осложнений, как переломы.
Отметим, что для многих больных денситометрия по-прежнему остается малодоступным методом обследования из-за недостаточной оснащенности рентгеновскими денситометрами лечебных учреждений, в которых наблюдаются больные РА, и высокой стоимости исследования.
Увеличение длительности болезни сопровождается увеличением числа эрозий независимо от возраста, что отражает патогенез заболевания. Снижение МПК (и возникновение ОП) ассоциируется прежде всего с возрастом, наступлением менопаузы и другими традиционными факторами. В нашем исследовании снижение МПК во всех отделах скелета ассоциировалось не с возрастом больных, а с длительностью болезни и увеличением значения модифицированного индекса Sharp. Так, у сопоставимых по возрасту больных с длительностью заболевания свыше 20 лет МПК оказалась ниже, чем у больных с длительностью заболевания не более 7,5 года. У пациенток с меньшей давностью заболевания, несмотря на пожилой возраст, МПК оказалась выше, чем у больных более молодых, но с большей длительностью РА.
Связь генерализованной потери костной ткани с РА была доказана в эпидемиологических исследованиях с помощью различных методов. Так, исследование R.F. Laan и соавт. было первым, в котором использование двухэнергетической рентгеновской костной абсорбциометрии (DXA) для диагностики ОП продемонстрировало, что больные РА имели более низкие показатели МПК по сравнению с пациентами контрольной группы [6]. Впоследствии A.K. Gough и соавт. обнаружили нарастающую потерю МПК в поясничном отделе позвоночника и области большого вертела у пациентов с ранним РА в сравнении с больными контрольной группы [7]. Распространенность ОП у больных РА в поясничном отделе позвоночника (L1–L4) и проксимальном отделе бедра (ШБ), по данным ряда авторов, составляет от 10 до 67% и определяется качеством, количеством выборки, возрастом больных, включенных в исследование [2, 8–15]. По данным, полученным в ФГБУ НИИР РАМН при анализе протоколов денситометрии 1923 больных РА (88% женщин, 12% мужчин) в возрасте от 20 до 94 лет, выполненной на аппарате Hologic Discovery A за период с 2004 по 2009 г. в трех областях (L1–L4, ШБ и ДОП недоминантной руки), ОП хотя бы в одной области измерения выявлен у 29% больных, в том числе у 15% больных моложе 50 лет. Наиболее часто ОП диагностировали в области предплечья (34%). Частота ОП в L1–L4 и ШБ была примерно одинаковой (16%). У молодых мужчин частота ОП в L1–L4 (18%) и ШБ (21%) оказалась выше, чем у молодых женщин (7 и 4% соответственно) (р < 0,01). Нормальные значения МПК наблюдались менее чем у половины больных РА [16].
Как известно, на возникновение и течение вторичного ОП при РА влияют не только традиционные (общепринятые, популяционные) факторы риска ОП, такие как женский пол, возраст, ИМТ, низкая МПК, семейный анамнез ОП, низкая физическая активность, курение, злоупотребление алкоголем, дефицит витамина D, недостаточное потребление кальция, гипогонадизм, ранняя менопауза, длительная иммобилизация, но и собственные факторы, отражающие развитие и течение РА, внесуставные проявления болезни, вовлечение в патологический процесс внутренних органов.
Противоречивые результаты получены исследователями, изучавшими взаимосвязь между длительностью РА и снижением МПК. Одни ее установили [9, 17–19], другие не подтвердили [3].
При РА описаны три формы изменения костной ткани: фокальная потеря костной массы непосредственно в субхондральной кости и суставных поверхностях (с образованием эрозий), периартикулярная остеопения в воспаленных суставах и генерализованный ОП с вовлечением осевого и периферического скелета.
Предполагалось, что патофизиологические механизмы генерализованной потери костной ткани и фокальных эрозий различны. Однако была выдвинута гипотеза о том, что патофизиологические механизмы этих процессов могут быть общими [20]. Эта гипотеза была подтверждена в исследовании L. Sinigaglia и соавт., подтвердившем связь между высокой распространенностью ОП и наличием эрозий у женщин с РА [21]. Достоверная положительная корреляция между МПК и эрозиями в суставах кистей и стоп зарегистрирована в ряде исследований [22–28].
Например, K. Forslind и соавт. были обследованы 204 пациента с РА (134 женщины и 70 мужчин, средний возраст 55 и 61 год соответственно). Получена корреляция между количеством эрозий в кистях и стопах и МПК. Значительные различия обнаружены только у женщин. Так, женщины с низкой МПК и ОП имели более высокие показатели эрозий [24].
В исследовании OSTRA представлены данные из трех стран в отношении МПК и деформации позвонков у женщин в возрасте 50–70 лет с многолетним РА. Исследователи продемонстрировали связь между количеством эрозий в суставах кистей и стоп и низкой МПК [25]. Корреляция эрозий и низкой МПК получена также в ходе исследования М. Rossini [26]. В исследовании участвовал 1191 пациент с РА (1014 женщин и 177 мужчин, средний возраст составлял 58,9 ± 11,1 года). Рентгенологически костные эрозии в кистях и стопах выявлены у 64,1% пациентов. У этих пациентов средние значения МПК были значительно ниже как в L1–L4 (-0,74 ± 1,19 vs -0,46 ± 1,31, р = 0,05), так и в ШБ (-0,72 ± 1,07 vs -0,15 ± 1,23, р < 0,001).
В недавнем исследовании D. Solomon и соавт. анализировали взаимосвязь между МПК и эрозиями в когорте постменопаузальных женщин, страдающих РА. Установлено, что изменение МПК ШБ коррелировало с числом эрозий (r = -0,33, р < 0,0001). Однако по мере учета других факторов (возраст, продолжительность РА, ИМТ, суммарная доза ГКС) эта взаимосвязь исчезала. Авторы установили выраженную взаимосвязь между количеством эрозий и МПК ШБ в группе более молодых пациентов (моложе 62 лет), в группе пациентов с меньшей длительностью болезни (< 5 лет), с более высоким ИМТ (< 28 мг/м²) и меньшей кумулятивной дозой ГКС (< 960 мг). Кроме того, корреляция между числом эрозий и МПК ШБ была сильнее (r = -0,33, р < 0,0001), чем с МПК L1–L4 (r = -0,09, р = 0,27) [27]. Очевидно, что на взаимосвязь между показателем индекса Sharp и МПК влияют традиционные факторы ОП, а также факторы, связанные с РА. В исследовании BEST также установлена связь между количеством эрозий и МПК у пациентов с продолжительностью болезни менее 2 лет [28].
Таким образом, нами проанализированы материалы рентгенологического и денситометрического обследования больных РА, представлены предварительные результаты сравнительного анализа, демонстрирующие связь между МПК и эрозивно-деструктивными изменениями в костной ткани по мере увеличения длительности болезни независимо от возраста больных. Более подробный последующий анализ большей выборки больных с учетом различных факторов позволит определить вклад каждого фактора и соответственно разработать алгоритм и персонифицированную тактику клинико-диагностических и лечебных мероприятий при РА.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.