Диабетон МВ в национальных и международных рекомендациях
- Аннотация
- Статья
- Ссылки
- English
В статье рассматриваются препараты производных сульфонилмочевины, которые различаются не только в отношении риска развития гипогликемий, но и профилями сердечно-сосудистой и почечной безопасности.
Особое внимание уделено одному из наиболее безопасных и эффективных препаратов данной группы – Диабетону МВ (гликлазид модифицированного высвобождения). Представлены особенности его фамакокинетики, режим дозирования, скорость абсорбции, аффинность связывания со специфическим рецептором, структурные особенности, обусловливающие антиоксидантное действие. Проведено сравнение с препаратами новейших классов – ингибиторами дипептидилпептидазы 4 и натрий-глюкозного котранспортера 2.
В статье рассматриваются препараты производных сульфонилмочевины, которые различаются не только в отношении риска развития гипогликемий, но и профилями сердечно-сосудистой и почечной безопасности.
Особое внимание уделено одному из наиболее безопасных и эффективных препаратов данной группы – Диабетону МВ (гликлазид модифицированного высвобождения). Представлены особенности его фамакокинетики, режим дозирования, скорость абсорбции, аффинность связывания со специфическим рецептором, структурные особенности, обусловливающие антиоксидантное действие. Проведено сравнение с препаратами новейших классов – ингибиторами дипептидилпептидазы 4 и натрий-глюкозного котранспортера 2.
Введение
В 2006 г. эксперты Организации Объединенных Наций приняли резолюцию 61/225, в которой сахарный диабет (СД) был признан неинфекционной эпидемией, поражающей население во всех странах мира, и заболеванием, представляющим не меньшую угрозу для жизни, чем ВИЧ/СПИД. Для сравнения – в 2013 г. от СПИДа умерло 1,5 млн человек, в 2015 г. от СД – 5 млн. Неблагоприятные исходы у пациентов с СД обусловлены прежде всего его микро- и макрососудистыми осложнениями, которые легли в основу акростиха о диабете «САГА»:
- Слепота у пациентов с сахарным диабетом наступает в 25 раз чаще, чем среди лиц без диабета,
- Ампутация конечностей – в 17–45 раз,
- Гемодиализ – от 21,7 до 32,4% всех случаев терминальной стадии хронической почечной недостаточности,
- Аортокоронарное шунтирование и стентирование – от 15 до 25% случаев.
В 2017 г. в мире насчитывалось 425 млн больных СД [1]. Если суммировать количество лиц с диагностированным (425 млн) и недиагностированным диабетом (200 млн), а также с предиабетом (300 млн), то уже в прошлом году из 7,5 млрд населения планеты приблизительно у 1 млрд имели место те или иные нарушения углеводного обмена. К 2045 г. количество пациентов с СД может достичь 629 млн. Согласно прогнозам, распространенность патологии в Северной Америке увеличится на 35%, Юго-Восточной Азии – на 84%, на Среднем Востоке и в Северной Африке – на 110%.
Достижение контроля гликемии, его удержание в течение длительного времени, профилактика развития микро- и макрососудистых осложнений, сохранение качества жизни пациентов признаны основными задачами лечения СД 2 типа. Ключ к успешному их решению – пациент-ориентированный подход. Последний означает, что стратегия лечения должна обсуждаться с пациентом, учитывать особенности как больного, так и назначаемого лекарственного средства.
Не так давно получено разрешение на применение целого ряда новых препаратов при СД 2 типа, что привело к пересмотру основных алгоритмов лечения. Для большинства больных препаратом первой линии по-прежнему остается метформин. Производные сульфонилмочевины (ПСМ) сохраняют свои позиции как препараты второй и третьей линии терапии. В основе таких решений – подтвержденная эффективность и безопасность, огромный клинический опыт, простота применения, возможность комбинации с другими сахароснижающими препаратами, а также низкая стоимость.
Механизм действия производных сульфонилмочевины и его клиническое значение
Производные сульфонилмочевины применяются в клинической практике с конца 1950-х гг. За указанный период они продемонстрировали сопоставимую эффективность в снижении уровня гликированного гемоглобина (HbA1c), однако их характеристики в отношении развития побочных реакций оказались уникальными. Как следствие, клинически значимые внутриклассовые различия.
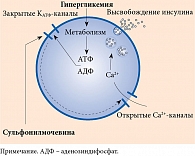
Препараты данной группы относятся к секретагогам, то есть стимулируют секрецию инсулина бета-клетками поджелудочной железы. Современные ПСМ реализуют инсулин-стимулирующий потенциал за счет аденозинтрифосфат-зависимых калиевых каналов (АТФ-зависимых K-каналов) (рис. 1).
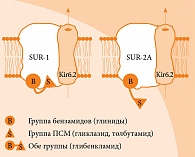
Рецепторы к сульфонилмочевине (SUR) являются неотъемлемым компонентом АТФ-зависимых K-каналов [2]. Каждый канал состоит из четырех белков Kir6.2, формирующих в клеточной мембране центральную пору для селективного переноса ионов калия, и четырех субъединиц SUR, регуляторных рецепторов. SUR-1 представлен в бета-клетках поджелудочной железы, SUR-2A – в кардиомиоцитах, SUR-2B – в гладкомышечных клетках [3, 4]. Именно аффинностью с данными рецепторами определяется селективность действия препаратов ПСМ (рис. 2).
Открытие КАТФ-каналов в кардиомиоцитах защищает сердце в период ишемии. Производные сульфонилмочевины с аффинностью с КАТФ-каналами в кардиомиоцитах могут подавлять их открытие. В то же время ПСМ с селективностью в отношении SUR-1 ассоциируются с меньшим сердечно-сосудистым риском [5] и являются предпочтительными, особенно у лиц с высоким риском развития ишемии миокарда.
Следствием хронической гипергликемии является окислительный стресс, приводящий к апоптозу бета-клеток поджелудочной железы. Глибенкламид увеличивает образование гидроксильного, перекисного и других радикалов (реактивных форм кислорода), усиливающих апоптоз бета-клеток [6].
Высокая селективность и аффинность Диабетона МВ, способность нейтрализовать свободные радикалы объясняются наличием в его структуре аминоазобициклооктанового кольца [7]. За счет нейтрализации свободных радикалов препарат способен защищать бета-клетки поджелудочной железы от апоптоза [8].
В клинической практике сказанное ранее имеет чрезвычайно важное значение, особенно если учитывать феномен вторичной резистентности к сульфонилмочевине. Так, при изучении вторичной резистентности к ПСМ у 248 больных СД 2 типа было установлено, что через пять лет частота таковой была ниже в группе гликлазида (7%), чем в группах глибенкламида (глибурида) (18%) и глипизида (26%) [9]. Согласно результатам ретроспективного наблюдения, применение Диабетона МВ в отличие от других ПСМ позволяло отсрочить назначение инсулина более чем на восемь лет [10].
Сердечно-сосудистая безопасность
В 2008 г. экспертами Управления по санитарному надзору за качеством пищевых продуктов и медикаментов были выдвинуты новые требования к регистрации препаратов, согласно которым избыточный сердечно-сосудистый риск, связанный с новыми сахароснижающими препаратами, должен быть исключен [11].
Необходимо отметить, что роль ПСМ в профилактике сердечно-сосудистых осложнений у больных СД 2 типа изучалась в ряде рандомизированных контролируемых исследований. В них приняли участие пациенты с СД 2 типа без сердечно-сосудистого риска, а также с высоким и очень высоким сердечно-сосудистым риском.
Так, исследование UKPDS, ставшее хрестоматийным по частоте цитирования, проводилось у лиц с впервые выявленным СД 2 типа. Его авторы изучали влияние интенсивного контроля гликемии на развитие микро- и макрососудистых осложнений [12, 13]. Участники исследования были рандомизированы в группы стандартного гликемического контроля с диетотерапией либо интенсивного гликемического контроля с использованием ПСМ (хлорпропамида, глибенкламида, глипизида) или инсулина. Инсулин и ПСМ оказались сопоставимыми в отношении снижения риска развития микрососудистых осложнений. Однако ни один из препаратов статистически значимо не влиял на частоту развития макрососудистых заболеваний [12]. Результаты исследования также свидетельствовали об отсутствии повышения риска сердечно-сосудистой смерти у пациентов, получавших ПСМ. По завершении рандомизированной фазы исследования UKPDS, длившейся десять лет, наблюдение за пациентами было продолжено. Через десять лет, по окончании расширенной фазы исследования, было установлено, что в группе интенсивного контроля гликемии ПСМ или инсулина риск развития инфаркта миокарда был меньше на 15%, микрососудистого заболевания – на 24%, смерти от любой причины – на 13% [14].
В исследование TOSCA.IT были включены пациенты с СД 2 типа и низким сердечно-сосудистым риском, находившиеся на монотерапии метформином и не достигшие целевых показателей углеводного обмена. 3028 больных рандомизировали в группы пиоглитазона или ПСМ (глибенкламид – 2%, глимепирид – 48%, гликлазид – 50%). Авторы исследования оценивали долгосрочную эффективность двойной терапии (метформин и препарат сравнения) в отношении сердечно-сосудистых событий [15]. Через пять лет между группами терапии достоверного различия в достижении первичной конечной точки (смерть от любой причины, первый случай нефатального инфаркта миокарда, нефатального инсульта или экстренной реваскуляризации миокарда) не зафиксировано.
В крупное международное многоцентровое рандомизированное исследование ADVANCE были включены пациенты с СД 2 типа с длительностью заболевания в среднем восемь лет [16]. Целью исследования было доказать превосходство интенсивного контроля гликемии (HbA1c ≤ 6,5%) в снижении риска развития как микро-, так и макрососудистых осложнений над стандартным лечением. 11 140 больных рандомизировали на две группы сахароснижающей терапии. Первая получала гликлазид МВ и любой другой сахароснижающий препарат, вторая – стандартное лечение (в случае необходимости можно было добавлять любой ПСМ, но не гликлазид). Период наблюдения в среднем составил пять лет. Первичная конечная точка включала макрососудистые (инфаркт миокарда, инсульт или сердечно-сосудистая смерть) и микрососудистые события (ретинопатия или нефропатия). Результаты исследования продемонстрировали, что интенсивная стратегия способствовала более безопасному улучшению микрососудистых исходов (особенно почечных), а также не ассоциировалась с увеличением смертности. Первичный исход достигнут в 18,1% случаев в группе интенсивного контроля и в 20,0% – в группе стандартного контроля (p = 0,013). Интенсивная терапия достоверно не снижала риск макрососудистых осложнений (отношение рисков (ОР) 0,94, p = 0,32). Различия по первичному исходу были связаны главным образом с меньшим числом микрососудистых событий, в частности диабетической нефропатии. Частота последней уменьшилась приблизительно на 20%. Таким образом, исследование ADVANCE продемонстрировало безопасность Диабетона МВ у больных СД 2 типа с высоким и очень высоким сердечно-сосудистым риском [16]. В продленной десятилетней фазе исследования – ADVANCE-ON была отмечена долгосрочная сердечно-сосудистая безопасность интенсивной терапии. Особого внимания заслуживают результаты в отношении развития терминальной стадии хронической почечной недостаточности. Так, в группе интенсивной терапии зафиксировано 29 таких случаев, стандартной – 53 (ОР 0,54, p < 0,01) [17, 18].
В датском исследовании STENO-2 приняли участие 160 пациентов с СД 2 типа, микроальбуминурией и высоким сердечно-сосудистым риском. Они получали либо стандартное лечение, либо интенсивное (метформин или гликлазид) для поддержания уровня HbA1c < 6,5% [19]. За восемь лет наблюдения зарегистрировано 118 сердечно-сосудистых событий – 85 у 35 пациентов группы стандартного лечения и 33 у 19 больных группы интенсивного лечения [20, 21].
Таким образом, результаты исследований ADVANCE и STENO-2 свидетельствуют о преимуществах одномоментной интенсивной коррекции нескольких факторов риска у больных СД 2 типа. Однако они не отвечают на вопрос: какой компонент был наиболее полезным с точки зрения снижения частоты развития осложнений?
В обзорах и метаанализах контролируемых исследований также доказана сердечно-сосудистая безопасность Диабетона МВ и глимепирида по сравнению с глибенкламидом [22, 23].
Не меньший интерес представляет сердечно-сосудистая безопасность современных инновационных пероральных сахароснижающих препаратов: ингибиторов дипептидилпептидазы 4 (ДПП-4) и ингибиторов натрий-глюкозного котранспортера 2 (НГЛТ-2). Оценка их сердечно-сосудистой безопасности проводилась в пяти исследованиях – в трех с ингибиторами ДПП-4 и двух с ингибиторами НГЛТ-2. Для саксаглиптина (SAVOR-TIMI), ситаглиптина (TECOS) и алоглиптина (EXAMINE) [24–26] частота достижения первичной конечной точки достоверно не отличалась от таковой плацебо. Однако частота госпитализаций по поводу сердечной недостаточности у получавших саксаглиптин по сравнению с принимавшими плацебо достоверно повысилась, у принимавших алоглиптин отмечена тенденция к таковым. Лишь в группе ситаглиптина она была аналогичной группе плацебо.
В исследованиях EMPA-REG OUTCOME и CANVAS ингибиторы НГЛТ-2 эмпаглифлозин и канаглифлозин в отличие от плацебо продемонстрировали кардиопротективный эффект [27, 28]. Однако необходимо отметить, что на фоне канаглифлозина достоверно повышался риск ампутации конечностей.
В вышеперечисленных исследованиях помимо указанных выше препаратов пациенты получали метформин (66,2–81,6%) и/или ПСМ (40,2–46,5%).
В 2019 г. должно завершиться исследование CAROLINA, которое позволит получить данные о сердечно-сосудистых исходах на фоне применения ПСМ (глимепирида) и ингибитора ДПП-4 (линаглиптина).
Эффективность в виде комбинированной и монотерапии
Монотерапия метформином не всегда приводит к достижению целевых показателей углеводного обмена, и даже при достижении таковых результат со временем ускользает. Как следствие, возникает потребность в комбинированной терапии. В ряде метаанализов и обзоров была изучена эффективность разных классов антидиабетических препаратов у больных СД 2 типа с недостаточным контролем углеводного обмена на фоне метформина. Полученные данные свидетельствуют, что значимые различия между разными классами препаратов в отношении снижения уровня HbA1c отсутствуют [29, 30]. Однако, согласно результатам систематического обзора 218 рандомизированных клинических исследований с участием около 79 тыс. пациентов, разные классы сахароснижающих препаратов различаются в отношении достижения HbAlc < 7% [31]. Наиболее эффективными оказались метформин и ПСМ. Так, количество пациентов с HbAlc < 7% в этих двух группах достигло 42 и 48%. В то же время в группах ингибиторов ДПП-4 и глинидов таковых насчитывалось 39%, глитазонов – 33%, ингибиторов альфа-глюкозидазы – 26%.
При сравнении эффективности в отношении снижения HbA1c различий между ПСМ в отдельности и плацебо не выявлено [29, 32]. В то же время, согласно результатам метаанализа рандомизированных клинических исследований, ПСМ более выраженно снижали уровень HbA1c, чем ингибиторы ДПП-4 [33].
Определить время дебюта СД 2 типа, как правило, достаточно сложно. Поэтому можно предположить, что влияние гипергликемии на организм было длительным, особенно у пациентов с исходно высоким уровнем HbA1c. В этой связи особый интерес представляют результаты двойного слепого рандомизированного контролируемого клинического исследования ADOPT с участием 4360 больных [34]. В нем изучали эффективность росиглитазона, метформина и глибенкламида в качестве начальной монотерапии у пациентов с впервые диагностированным СД 2 типа. Через пять лет кумулятивная частота вторичной неэффективности терапии для метформина составила 21%, глибенкламида – 34%, росиглитазона – 15%. В исследовании ADVANCE стратегия интенсивного лечения с использованием Диабетона МВ характеризовалась более длительным гликемическим контролем (в течение пяти лет) с достижением HbA1c ≤ 6,5%. При этом у четырех из каждой пятерки пациентов был достигнут уровень HbA1c ≤ 7,0% [16].
Оценке эффективности ПСМ и ингибиторов ДПП-4 в отношении HbA1c в течение длительного периода времени (26, 52 и до 104 недель) был посвящен метаанализ восьми рандомизированных клинических исследований [35]. По сравнению с ПСМ ингибиторы ДПП-4 ассоциировались с меньшим снижением уровня HbA1c с 24–28-й по 104-ю неделю (средняя разница -0,16% при 95%-ном доверительном интервале (ДИ) -0,21– -0,11 (p < 0,001)) и c 52-й по 104-ю неделю (средняя разница -0,06% (95% ДИ -0,10 – -0,02), р = 0,001) [36]. В то же время в метаанализе 12 рандомизированных клинических исследований ингибиторов ДПП-4 (длительность применения – до 108 недель) показано, что эффективность такой терапии в отношении HbA1c уменьшалась в течение второго года лечения [37]. Надо признать, что двухлетний период оценки длительности эффекта сахароснижающей терапии, используемый в большинстве исследований, признается относительно небольшим. В настоящее время проводится исследование GRADE, в котором в течение четырех лет у пациентов с впервые диагностированным СД 2 типа оценивается гликемический контроль на фоне комбинации ПСМ, ингибиторов ДПП-4, агонистов рецепторов глюкагоноподобного пептида 1 (ГПП-1) и базального инсулина, которые добавили к метформину [38].
Сахароснижающий эффект ПСМ (глимепирида и глипизида при их дополнении к метформину) также сравнивали с ингибиторами НГЛТ-2. Аналогичных исследований с гликлазидом не проводилось.
В одно из таких исследований было включено 1549 пациентов, которые получали эмпаглифлозин или глимепирид [39]. Разницу средних уровней HbA1c по сравнению с исходными значениями оценили через два года, хотя исследование было рассчитано на четыре. Она составила -0,11% (95% ДИ -0,19– -0,02), p = 0,0153) в пользу эмпаглифлозина. В другом исследовании у 814 больных СД 2 типа оценивали эффективность дапаглифлозина и глипизида [40]. Через четыре года отмечено стойкое снижение уровня HbA1c на фоне дапаглифлозина. Разница составила -0,30% (95% ДИ -0,51– -0,09).
Получены также данные об отсутствии достоверной разницы в снижении HbA1c между ПСМ и глитазоном при их добавлении к метформину [15, 41].
Влияние на массу тела
С момента выпуска на фармацевтический рынок ПСМ активно обсуждается вопрос об их влиянии на массу тела. Установлено, что монотерапия ПСМ способствует увеличению массы тела на 1,5–2,5 кг [42]. Аналогичные результаты зафиксированы в исследовании UKPDS. Так, у пациентов, получавших ПСМ, масса тела в первый год лечения увеличилась больше, чем у лиц на диетотерапии, – хлорпропамид и глибенкламид +2,6 и +1,7 кг соответственно [12]. Однако через год данная тенденция уже не наблюдалась, а через три-четыре года масса тела стабилизировалась [43]. В исследовании ADOPT в первый год монотерапии глибуридом масса тела повысилась на 1,6 кг, однако в дальнейшем стабилизировалась [33]. В исследовании ADVANCE за период наблюдения в группе интенсивного контроля гликемии масса тела у пациентов в среднем увеличилась лишь на 0,7 кг (p < 0,001 по сравнению с группой стандартного контроля гликемии) [16]. В целом прибавка массы тела при интенсивном лечении гликлазидом МВ была минимальной – 0,1 кг за пять лет наблюдения [44]. Анализ результатов исследования RECORD свидетельствует, что у пациентов, включенных в группу интенсивного лечения «метформин + ПСМ», масса тела не увеличилась [41]. В ходе пятилетнего наблюдения отмечено, что добавление к метформину ПСМ не приводило к изменению массы тела, однако добавление к ПСМ метформина способствовало ее снижению на 1,5 кг. Данный тренд наблюдался и в исследовании TOSCA [15].
Риск гипогликемии
Ятрогенная гипогликемия является серьезным препятствием для интенсификации терапии больных СД 2 типа. Особенности механизма действия ПСМ обусловливают необходимость учета таковой.
Результаты многоцентровых сравнительных исследований свидетельствуют о различии степени риска развития гипогликемии у разных препаратов ПСМ. Это зависит прежде всего от их избирательности и обратимости связывания с рецептором SUR-1 на бета-клетках поджелудочной железы [45–47]. Длительно действующие и образующие активные метаболиты препараты сульфонилмочевины (глибенкламид и глимепирид) повышают риск пролонгированной и тяжелой гипогликемии, особенно у пожилых пациентов [48, 49]. Достоверно низким оказался риск гипогликемий на фоне применения глипизида и гликлазида, что обусловлено их способностью распадаться до неактивных метаболитов.
В ряде метаанализов, в которых сравнивали глибенкламид с другими ПСМ, при лечении глибенкламидом зафиксировано повышение ОР любых эпизодов гипогликемии в 1,4 раза, тяжелых гипогликемий – более чем в 4,7 раза [46]. Выявлено также, что при сопоставимом снижении уровня HbA1c (от -0,66 до -0,84%) добавление к метформину гликлазида ассоциировалось с наименьшим риском гипогликемий любой степени тяжести по сравнению с добавлением глибенкламида (ОР 0,40 (95% ДИ 0,13–1,27)), глимепирида (ОР 0,21 (95% ДИ 0,03–1,48)) и глипизида (ОР 0,22 (95% ДИ 0,05–0,96)) [50].
При проведении метаанализа рандомизированных клинических исследований в отношении частоты возникновения гипогликемий на фоне препаратов сульфонилмочевины установлено, что гипогликемии при уровне глюкозы в крови ≤ 3,1 ммоль/л отмечались у 10,1% пациентов, получавших любой препарат данного класса (95% ДИ 7,3–13,8%), и лишь у 1,4% пациентов, получавших гликлазид (95% ДИ 0,8–2,4%) [47]. Тяжелая гипогликемия зафиксирована у 0,8% пациентов, получавших любой ПСМ (95% ДИ 0,5–1,3%), и лишь у 0,1% – гликлазид (95% ДИ 0,0–0,7%). Результаты метаанализов рандомизированных клинических исследований подтвердили достоверно низкий риск гипогликемий у пациентов, получавших гликлазид, по сравнению с больными, принимавшими другие препараты сульфонилмочевины (ОР 0,47 (95% ДИ 0,77–0,70), p = 0,004) [32].
В исследовании GUIDE гликлазид МВ и глимепирид были одинаково эффективными в улучшении контроля глюкозы крови, однако количество эпизодов гипогликемии на фоне первого было практически на 50% меньше, чем на фоне второго [51].
В исследовании ADVANCE стратегия интенсивного лечения на основе гликлазида МВ по сравнению со стандартной терапией ассоциировалась с низким риском тяжелых гипогликемий – один тяжелый эпизод гипогликемии у 2,7% пациентов против 1,5% [16]. В то же время в исследованиях ACCORD и VADT частота тяжелых эпизодов гипогликемий в группах интенсивного контроля составила 16,2 и 21,2% соответственно [52, 53].
Установлено, что в период Рамадана риск эпизодов тяжелых гипогликемий повышается в 7,5 раза [54, 55]. У 1024 лиц с СД 2 типа, постившихся в этот период, частота гипогликемий при лечении препаратами сульфонилмочевины – глибенкламидом, глимепиридом и гликлазидом МВ, а также ингибитором ДПП-4 ситаглиптином составила 19,7, 12,4, 6,6 и 6,7% соответственно [56]. Это свидетельствует о безопасности Диабетона МВ даже по сравнению с ингибитором ДПП-4. Необходимо отметить, что во время постов сахароснижающая терапия должна проводиться под тщательным контролем гликемии и с соблюдением всех врачебных рекомендаций [55–57].
Нефропротекция
Сахарный диабет является ведущей причиной развития терминальной стадии хронической почечной недостаточности [58], поэтому остро стоит вопрос о приемлемости применения препаратов того или иного класса для лечения больных с нарушенной функцией почек.
Использование большинства антидиабетических препаратов лимитировано скоростью клубочковой фильтрации (СКФ). Возможность использования ПСМ зависит от степени поражения почек и риска развития гипогликемических состояний [59]. Препараты сульфонилмочевины, распад которых сопровождается образованием активных метаболитов (глибенкламид, глимепирид), повышают риск развития гипогликемий по мере снижения СКФ. Поэтому глибенкламид предпочтительно назначать пациентам только с нормальной функцией почек или хронической почечной недостаточностью легкой степени (СКФ 60–90 мл/мин/1,73 м2), у лиц с СКФ 30–60 мл/мин/1,73 м2 он должен применяться с осторожностью, а у лиц с СКФ < 30 мл/мин/1,73 м2 он должен быть отменен. В то же время глимепирид в более низкой дозе может применяться при СКФ 30–60 мл/мин/1,73 м2 [50]. Гликлазид и глипизид расщепляются до неактивных метаболитов, в связи с чем у пациентов с почечной недостаточностью риск развития гипогликемий низкий. Данные препараты могут применяться при СКФ менее 30 мл/мин/1,73 м2 при условии тщательного наблюдения за пациентами [60]. Особенно это относится к гликлазиду, который подобно ингибиторам ДПП-4 можно использовать на первой – третьей стадиях хронической болезни почек (СКФ > 30 мл/мин/1,73 м2), а в сниженной дозе – у пациентов с тяжелой хронической болезнью почек [50, 61].
Согласно результатам исследований, интенсивный контроль гликемии в группе гликлазида МВ приводил к снижению риска микроальбуминурии на 9% (p = 0,01), макроальбуминурии на 30% (p < 0,001), развития или ухудшения нефропатии на 21% (p = 0,006) и терминальной стадии хронической почечной недостаточности на 65% (p = 0,02) [62]. Кроме того, интенсивное снижение уровня глюкозы, основанное на применении гликлазида МВ, способствовало регрессу альбуминурии на одну стадию у 62% лиц, при этом у большинства пациентов была достигнута нормоальбуминурия. Преимущества интенсивного контроля гликемии с помощью гликлазида МВ в отношении недостижения терминальной стадии хронической почечной недостаточности сохранялись в течение десяти лет от начала лечения [12].
При назначении ингибиторов НГЛТ-2 следует учитывать, что их способность блокировать реабсорбцию глюкозы зависит от адекватной функции почек, поэтому они противопоказаны пациентам с СКФ < 45–60 мл/мин/1,73 м2.
Место производных сульфонилмочевины в современных алгоритмах лечения
Результаты систематических обзоров и метаанализов способствовали признанию сахароснижающей эффективности ПСМ.
В авторитетных национальных и международных руководствах эффективность метформина, ПСМ, глитазонов и агонистов рецепторов ГПП-1 характеризуется как высокая – по сравнению с промежуточной эффективностью ингибиторов ДПП-4 и НГЛТ-2 [63]. В обновленных в 2018 г. международных руководствах, таких как стандарты лечения Американской диабетической ассоциации, ПСМ рассматриваются в качестве дополнительных средств к метформину у пациентов с сердечно-сосудистыми заболеваниями после неуспешного применения препаратов с доказанными преимуществами в отношении сердечно-сосудистого риска. ПСМ остаются препаратами второй линии, при условии добавления их к метформину, у больных без сердечно-сосудистых заболеваний [64–66].
В ряде национальных руководств ПСМ дифференцируются в зависимости от класса. В частности, эксперты Королевской коллегии врачей общей практики и диабетологов Австралии, Итальянского общества диабетологов, Общества эндокринологии, метаболизма и диабета Южной Африки выделили гликлазид как препарат с более низким риском развития сердечно-сосудистых заболеваний, гипогликемий и нейтральный в отношении массы тела [67–70].
В рекомендациях Инициативной группы по качеству лечения и исходам при болезнях почек Национального почечного фонда отмечается, что гликлазид МВ 60 мг является наиболее предпочтительным среди ПСМ у пациентов с хронической почечной недостаточностью [71].
Эксперты Всемирной организации здравоохранения (ВОЗ) в примерном перечне основных лекарственных средств рекомендуют использовать метформин и гликлазид МВ у пациентов с СД 2 типа [72]. Необходимо напомнить, что рекомендации ВОЗ (2018) являются основополагающими для большинства стран, где доступность и стоимость остаются ключевыми факторами при принятии решения о выборе лечения.
В консенсусе Федерации эндокринных обществ Южной Азии ПСМ рассматриваются как предпочтительные средства второй линии после метформина [73]. В рекомендациях Канадской ассоциации диабетологов (2013) гликлазид фигурирует как препарат с наименьшей частотой гипогликемий [74]. Важно подчеркнуть, что в самых последних рекомендациях – совместный консенсус Европейской ассоциации по изучению диабета и Американской диабетической ассоциации – ПСМ указаны в качестве препаратов второй линии у пациентов без тяжелого коморбидного фона, то есть без сердечно-сосудистых заболеваний атеросклеротического генеза или хронической почечной недостаточности.
Вывод
Медико-социальная значимость СД 2 типа обусловливает остроту вопроса о достижении целевых показателей гликемии. Для достижения таковых в первую очередь следует придерживаться персонифицированного подхода к лечению.
Во всех национальных и международных алгоритмах лечения больных СД 2 типа препаратом первого выбора является метформин, при условии хорошей переносимости и отсутствии противопоказаний к применению.
В настоящее время в России для лечения СД используется семь классов препаратов, как пероральных, так и инъекционных, в том числе инновационных. Столь широкий выбор требует от врачей глубоких знаний и умений при выработке тактики лечения.
Несмотря на внедрение в клиническую практику инновационных препаратов, производные сульфонилмочевины сохраняют свое значение как препараты второй и третьей линии в силу доказанной эффективности и безопасности, огромного клинического опыта использования, простоты применения, возможности комбинировать их с другими сахароснижающими препаратами, а также низкой стоимости.
Учитывая, что СД 2 типа является эквивалентом сердечно-сосудистой патологии, у пациентов с установленными сердечно-сосудистыми заболеваниями предпочтение следует отдавать препаратам с доказанным положительным влиянием на сердечно-сосудистые конечные точки. Диабетон МВ во многих исследованиях доказал кардиобезопасность, нефропротекцию, низкий риск гипогликемий и нейтральность в отношении массы тела.
A.M. Mkrtumyan
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
Type 2 diabetes mellitus has become a kind of epidemic due to the scale of its spread. This non-infectious disease is characterized by serious complications with poor management. Currently, seven classes of antidiabetic drugs are used to control glycemia in Russia, among which sulfonylurea derivatives occupy the special place.
The article discusses preparations of sulfonylurea derivatives, which differ not only in relation to the risk of hypoglycemia, but also the profiles of cardiovascular and renal safety.
Special attention is paid to one of the safest and most effective drugs of this group – Diabeton MR (modified release gliclazide). The peculiarities of its pharmacokinetic, the dosage, absorption rate, binding affinity with the specific receptor, the structural features that conditioned the antioxidant activity. Provided the comparison with products of the newest classes of dipeptidyl peptidase 4 inhibitors and sodium-glucose cotransporter 2.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.