Повторное применение ингибиторов BRAF и MEK у пациентов с метастатической меланомой кожи с мутацией в гене BRAF
- Аннотация
- Статья
- Ссылки
- English



Введение
Мутация BRAF V600E или V600K является предиктором ответа на терапию ингибиторами BRAF/MEK (BRAFi/MEKi). Некоторые мутации в гене BRAF (более 90% из них составляет мутация BRAF V600E) ответственны за конститутивную активацию сигнального пути MAPK/ERK, что приводит к неконтролируемой пролиферации клеток. Мутации BRAF обнаружены у 40–50% пациентов с меланомой кожи [1–3].
Для пациентов с мутацией в гене BRAF существует несколько опций выбора терапии первой линии: комбинированная иммунотерапия (анти-CTLA-4 + анти-PD-1/ ипилимумаб + ниволумаб), иммунотерапия анти-PD-1-препаратами (пембролизумаб, ниволумаб, пролголимаб), комбинированная таргетная терапия (ТТ) ингибиторами BRAF/MEK (вемурафениб + кобиметиниб, дабрафениб + траметиниб, энкорафениб + биниметиниб) или сочетание таргетной и иммунотерапии. Монотерапия BRAFi показала меньшую частоту объективных ответов, меньшую выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ). В плацебо-контролируемом исследовании III фазы COMBI-d 423 ранее не получавших лечения пациента с мутацией BRAF V600E или V600K были рандомизированы для получения дабрафениба и траметиниба (n = 211) или только дабрафениба (n = 212). Медиана ОВ составила 25,1 месяца (95% доверительный интервал (ДИ) 19,2 – не достигнуто) в группе дабрафениба и траметиниба по сравнению с 18,7 месяца (95% ДИ 15,2–23,7) в группе только дабрафениба (отношение рисков (ОР) 0,71, 95% ДИ 0,55–0,92; p = 0,0107). Риск наступления летального исхода снижался на 29% при использовании комбинации BRAFi/MEKi по сравнению с монотерапией BRAFi. Общая выживаемость составила 74% через один год и 51% через два года в группе дабрафениба и траметиниба по сравнению с 68 и 42% соответственно в группе только дабрафениба. Медиана выживаемости без прогрессирования составила 11,0 месяца (95% ДИ 8,0–13,9) в группе дабрафениба и траметиниба и 8,8 месяца (95% ДИ 5,9–9,3) в группе дабрафениба (ОР 0,67, 95% ДИ 0,53–0,84; p = 0,0004). В связи с этим монотерапия BRAFi может быть назначена только тем пациентам, которым противопоказаны ингибиторы MEK [4].
Если ранее медиана ОВ пациентов с метастатической меланомой составляла 6–9 месяцев, а большинство пациентов не переживали год после постановки диагноза метастатической меланомы, то с появлением ТТ и иммунотерапии ингибиторами контрольных точек (ИКТ) пациенты переживают семилетний рубеж наблюдения [5]. В исследовании CheckMate-067 по результатам 6,5-летнего наблюдения за пациентами медиана общей продолжительности жизни в группе комбинированной иммунотерапии составила 72,1 месяца (95% ДИ 38,2 – не достигнуто), в группе моноиммунотерапии (ниволумаб) – 36,9 месяца (95% ДИ 28,2–58,7), а в группе ипилимумаба – 19,9 месяца (95% ДИ 16,8–24,6). Медиана меланома-специфичной ОВ в группе комбинированной иммунотерапии не достигнута (95% ДИ 71,9 – не достигнуто), в группе ниволумаба составила 58,7 месяца (95% ДИ 35,9 – не достигнуто), в группе ипилимумаба – 21,9 месяца (95% ДИ 18,1–27,4) [6, 7].
Для лечения пациентов из групппы благоприятного прогноза (ECOG = 0, уровень лактатдегидрогеназы (ЛДГ) равен или ниже верхней границы нормы, менее трех метастатических очагов) с мутацией в гене BRAF, как правило, в первой линии отдают предпочтение иммунотерапии – комбинированной иммунотерапии или моноиммунотерапии анти-PD-1-препаратами. При быстром прогрессировании метастатического процесса, наличии жалоб со стороны метастатических очагов, уровне ЛДГ выше нормы наиболее предпочтительным вариантом терапии с целью реализации быстрого противоопухолевого ответа является комбинация BRAFi/MEKi.
При прогрессировании заболевания после первой линии терапии BRAFi/MEKi стандартом терапии второй линии является иммунотерапия [8] или наоборот: если пациент в первой линии терапии получал ИКТ, то при прогрессировании будет назначена вторая линия терапии с использованием BRAFi/MEKi. Однако что можно предложить пациентам, которые последовательно прогрессируют на фоне таргетной терапии BRAFi/MEKi и иммунотерапии (анти-PD-1 ± анти-CTLA-4)? Есть ли возможность и клиническая целесообразность повторного использования того варианта лекарственной терапии, который ранее уже был использован с эффектом?
Материал и методы
Для начала необходимо определиться с терминами. Коллеги, занимающиеся лечением пациентов с метастатической меланомой и выработкой клинических рекомендаций в странах Европейского союза, в 2020 г. опубликовали статью, касающуюся общей терминологии, которую целесообразно использовать в дальнейшем для лучшего понимания и интерпретации того, что происходит с пациентом [9]. Термины rechallenge и retreatment были разделены, и им даны определения.
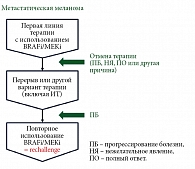
Rechallenge – повторное применение препаратов того же самого терапевтического класса после прогрессирования заболевания у пациентов, у которых ранее были зарегистрированы клиническое улучшение или ответ при использовании по поводу неоперабельной/метастатической меланомы (рис. 1).
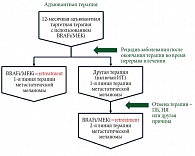
Retreatment – повторное лечение с использованием препаратов того же терапевтического класса при рецидиве/прогрессировании заболевания, которое возникло после завершения адъювантной терапии (рис. 2).
В период с 2018 по 2019 г. проходил набор в многоцентровое наблюдательное исследование по оценке эффективности и переносимости таргетной терапии BRAFi/MEKi в РФ под научным руководством Ассоциации специалистов по проблемам меланомы [10]. Исследование одобрено на заседании Независимого комитета по этической экспертизе клинических исследований от 24 августа 2018 г. и зарегистрировано на clinicaltrials.gov (NCT03663647). Все пациенты, принимавшие участие в наблюдательном исследовании, подписали форму информированного согласия. Медицинская информация о пациенте из истории болезни вносилась в электронную индивидуальную регистрационную карту для последующего анализа. Основными критериями включения были возраст старше 18 лет на момент начала таргетной терапии, морфологически подтвержденный диагноз меланомы, метастатическая и/или неоперабельная форма заболевания, по поводу которой пациент получал таргетную терапию, наличие мутации в гене BRAF, наличие хотя бы одной оценки эффективности таргетной терапии в соответствии с рутинной клинической практикой. Первоначально в задачи исследования не входил анализ пациентов, которым терапия была назначена повторно. Однако удалось проанализировать показатели ВБП и ОВ, принимая во внимание все ограничения ретроспективного исследования, включая неполные данные в медицинских картах и не всегда достаточный период наблюдения. Основными оцененными показателями стали: ВБП (рассчитана как время от начала повторного назначения таргетной терапии до прогрессирования заболевания или летального исхода), а также ОВ (время от начала повторного назначения таргетной терапии до летального исхода). Ситуации, когда у пациента не зарегистрированы прогрессирование или летальный исход на момент даты последнего наблюдения, рассматривались как цензурированные события.
Результаты и описания клинических случаев
В период с октября 2018 г. по апрель 2019 г. проводился набор в исследование пациентов, которые ранее или на момент участия в исследовании получали таргетную терапию BRAFi/MEKi, а также имели данные по оценке эффективности проводимой им терапии BRAFi/MEKi.
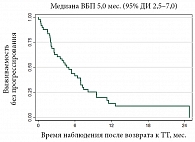
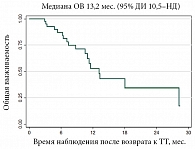
В окончательный анализ были включены 382 пациента с метастатической и/или неоперабельной меланомой с мутацией в гене BRAF. Достоверно известно, что у 50 из них таргетная терапия использовалась дважды по показанию «метастатическая и/или неоперабельная меланома». Медиана ВБП составила 5,0 месяца (95% ДИ 2,5–7,0) (рис. 3). Медиана ОВ составила 13,2 месяца (95% ДИ 10,5 – не достигнуто) (рис. 4). Эти данные сопоставимы с результатами уже опубликованных работ, которые более подробно будут представлены в разделе «Обсуждение».
Приводим два клинических случая повторного назначения комбинированной таргетной терапии (BRAFi/MEKi) пациентам в рамках общей медицинской практики.
Клинический случай 1 (Москва)
Пациентка Т., женщина, бухгалтер, 61 год.
В марте 2013 г. выполнено иссечение новообразования кожи правой голени. По данным гистологического исследования – меланома, pT2a. В опухоли выявлена мутация в гене BRAF V600E. 4 июня 2013 г. в Израиле выполнена биопсия сторожевых лимфоузлов, обнаружены микрометастазы меланомы. В июле 2013 г. выполнена пахово-бедренная лимфаденэктомия справа.
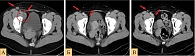
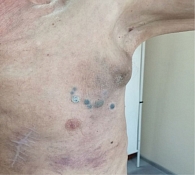
После оперативного лечения пациентке в течение года проводилась адъювантная иммунотерапия интерфероном альфа-2b в высоких дозах по 20 млн МЕ/м2 в/в капельно с первого по пятый дни, два дня перерыв, суммарно четыре недели. Далее до года – терапия интерфероном альфа-2b по 6 млн МЕ п/к три раза в неделю. С октября 2014 г. пациентка находилась под динамическим наблюдением. В 2017 г. самостоятельно отметила появление мягкотканных очагов на коже правой голени. В декабре 2017 г. было выполнено их иссечение (гистологически – метастазы меланомы). По данным обследования (компьютерная томография (КТ) органов грудной клетки (ОГК), органов брюшной полости (ОБП), органов малого таза (ОМТ) и головного мозга (ГМ) с в/в контрастированием от июня 2018 г.), были выявлены метастазы в наружные подвздошные лимфоузлы справа (размерами до 31 × 26 мм) с вовлечением правой наружной подвздошной вены, а также метастаз в паховый лимфоузел справа (размером до 20 × 11 мм) (рис. 5, А). Сумма коротких аксиальных d-таргетных очагов составила 26 мм. Пациентка также стала отмечать боли в паховой области небольшой интенсивности, которые беспокоили ее периодически.
В связи с распространенностью заболевания и наличием мутации в гене BRAF с июня 2018 г. по сентябрь 2021 г. проводилась комбинированная иммунотаргетная терапия по схеме «дабрафениб 150 мг два раза в сутки + траметиниб 2 мг в сутки ежедневно + анти-PD-1 (спартализумаб) 400 мг в/в капельно один раз в 28 дней» в рамках клинического исследования. В августе 2018 г. произошла непродолжительная приостановка терапии в связи с диареей 2-й степени тяжести, которая разрешилась самостоятельно. Далее терапия сопровождалась рядом нежелательных явлений (НЯ) 1–2-й степени тяжести, среди которых: утомляемость, повышение уровня креатинфосфокиназы, сухость кожи и слизистых оболочек, эписклерит, синдром сухого глаза, боли в конечностях, сыпь с зудом, которые контролировались при помощи симптоматической терапии и не требовали отмены терапии или снижения дозы.
При первом же контрольном обследовании (КТ с в/в контрастированием) в сентябре 2018 г. отмечен полный ответ с уменьшением пораженных лимфоузлов до нормальных размеров (короткий аксиальный диаметр < 1,0 см), который сохранялся при всех последующих обследованиях за 2018–2021 гг. (рис. 5, Б, В). Периодически в процессе терапии также проводилась магнитно-резонансная томография (МРТ) ГМ с в/в контрастированием для исключения интракраниального прогрессирования.
При сравнении данных КТ от июня 2018 г. (рис. 5, А) и от сентября 2018 г. (рис. 5, Б), апреля 2019 г. (рис. 5, В) отмечено, что на фоне терапии дабрафенибом, траметинибом и спартализумабом отмечается полный ответ в виде уменьшения пораженных лимфоузлов – наружных подвздошных справа, пахового лимфоузла справа – до нормальных размеров (на рис. 5 красные стрелки).
В апреле 2021 г. были получены результаты клинического исследования тройной комбинированной иммунотаргетной терапии. В связи с отсутствием доказанной эффективности тройной комбинации и по желанию пациентки отменена терапия спартализумабом. В связи с длительным полным ответом (три года), достигнутым на фоне комбинированной иммунотаргетной терапии, и по желанию пациентки терапия дабрафенибом + траметинибом была прекращена в сентябре 2021 г., далее осуществлялось динамическое наблюдение.
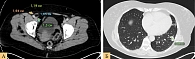
По данным контрольной позитронно-эмиссионной и компьютерной томографии (ПЭТ/КТ) всего тела с в/в контрастированием от июля 2022 г., отмечено увеличение размеров наружного подвздошного лимфоузла справа до 16 × 15 мм с SUV 5,5, пахового лимфоузла справа до 19 × 12 мм с SUV 2,31, появление очага в S8 левого легкого до 20 мм с SUV 3,8 (рис. 6). Сумма коротких аксиальных и максимальных d-таргетных очагов составила 35 мм.
С учетом прогрессирования заболевания пациентке была рекомендована комбинированная иммунотерапия. С июля по август 2022 г. проведено четыре введения ипилимумаба 3 мг/кг и ниволумаба 1 мг/кг. На фоне терапии отмечался конъюнктивит 1–2-й степени тяжести, который контролировался при помощи гормональных и противовоспалительных глазных капель. После четвертого введения развился гипофизит с вторичной надпочечниковой недостаточностью 3-й степени тяжести, который был купирован преднизолоном. Впоследствии проводилась поддерживающая терапия преднизолоном по 5 мг в сутки внутрь. При обследовании в октябре 2022 г. наблюдалась отрицательная динамика в виде увеличения размеров метастатических узлов. Учитывая стабильное состояние пациентки и возможность развития псевдопрогрессирования заболевания, иммунотерапия была продолжена с согласия пациентки. С октября по декабрь 2022 г. проведено четыре цикла анти-PD-1-терапии (монотерапия пролголимабом) 1 мг/кг один раз в 14 дней. По данным КТ ОГК, ОБП, ОМТ с в/в контрастированием от декабря 2022 г., отмечена дальнейшая отрицательная динамика с увеличением очага в S8 левого легкого до 36 мм, увеличением размеров правого наружного подвздошного лимфоузла до 49 × 30 мм, увеличением пахово-бедренных лимфоузлов справа до 24 × 12 мм, слева до 15 × 10 мм, появлением очага в S5 печени до 33 мм (рис. 7). Сумма коротких аксиальных и максимальных d-таргетных очагов достигла 130 мм. Появились болевые ощущения в паховой области справа умеренной интенсивности.
При сравнении КТ от июля 2022 г. (рис. 6, A, Б) и КТ от декабря 2022 г. (рис. 7, А, Б, В) отмечается прогрессирования заболевания после иммунотерапии (увеличение размеров наружного подвздошного лимфоузла справа, пахового лимфоузла справа, очага в S8 левого легкого, появление очага в S5 печени).
С учетом подтвержденного прогрессирования заболевания пациентке рекомендовано возобновление комбинированной таргетной терапии по схеме «дабрафениб 150 мг два раза в сутки + траметиниб 2 мг в сутки ежедневно». С декабря 2022 г. пациентка возобновила комбинированную таргетную терапию. По данным контрольной ПЭТ/КТ всего тела с в/в констатированием от марта 2023 г., отмечена выраженная положительная динамика в рамках частичного ответа по критериям RECIST 1.1 с уменьшением размеров правого наружного подвздошного лимфоузла до 17 × 15 мм, полным регрессом ранее определявшегося метастаза в нижней доле левого легкого, уменьшением размеров очага в S5 печени до 14 мм, уменьшением размеров пахового лимфоузла справа до 17 × 10 мм (рис. 8). Сумма mах d достигла 42 мм (–67%). На данный момент пациентка продолжает получать комбинированную таргетную терапию в прежнем режиме. Среди НЯ – конъюнктивит 1–2-й степени, который контролируется при помощи симптоматической терапии.
На серии снимков КТ от марта 2023 г. (рис. 8, А, Б, В) отмечен частичный ответ. Пациентка продолжает получать комбинированную таргетную терапию в прежнем режиме при удовлетворительной переносимости.
Данный случай подтверждает возможность повторного применения комбинированной таргетной терапии с эффектом. Обратите внимание: прогрессирование болезни зарегистрировано после отмены таргетной терапии при достижении длительного и стойкого полного ответа в первой линии терапии. На сегодняшний день не получено убедительных данных о точной подгруппе пациентов, у которых возможно «безопасно» (с низкой вероятностю развития прогрессирования) отменять таргетную терапию при достижении максимальной клинической эффективности с последующим динамическим наблюдением. Поэтому вопрос об отмене таргетной терапии и переходе пациента под динамическое наблюдение должен решаться индивидуально с каждым конкретным пациентом, с обсуждением всех возможных рисков и дальнейших сценариев. У данной пациентки при достижении длительного и стойкого полного ответа решение об отмене таргетной терапии было принято совместно с ней, принимая во внимание длительность полного ответа (три года), а также то, что пациентка получала в рамках первой линии не только таргетную терапию, но и тройную комбинацию – комбинированную таргетную терапию и иммунотерапию анти-PD-1. В большинстве случаев и в соответствии с инструкцией по применению комбинированная таргетная терапия должна проводиться длительно до прогрессирования заболевания или развития неприемлемой токсичности.
Клинический случай 2 (Казахстан)
Мужчина, 1951 г. рождения, пенсионер.
В августе 2020 г. произведено широкое иссечение новообразования кожи. При проведении морфологического исследования выявлена пигментная меланома кожи передней грудной клетки 3-й степени инвазии по Кларку. В декабре 2020 г. выявлено прогрессирование заболевания: увеличение подмышечных лимфоузлов с двух сторон (больше слева), метастаз в правом легком. Выполнена тонкоигольная аспирационная биопсия с цитологическим исследованием из лимфоузлов, заключение: меланома.
С января 2021 г. начато проведение первой линии химиотерапии дакарбазином, проведен один курс, осложнившийся гастроинтестинальной токсичностью. Клинически зарегистрировано прогрессирование (рис. 9). В феврале 2021 г. проведен второй курс с использованием темозоломида. 19 февраля 2021 г. получены результаты молекулярно-генетического исследования: в исследуемом образце обнаружена мутация в гене BRAF V600Е.
С 10 марта 2021 г. была назначена комбинированная таргетная терапия: дабрафениб 75 мг по две таблетки два раза в день + траметиниб 2 мг по одной таблетке один раз в день внутрь ежедневно. Клинически в первые несколько месяцев отмечено выраженное уменьшение размеров и объема метастатического поражения левой подмышечной области (рис. 10, 11).
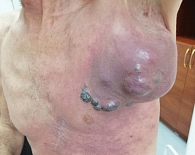
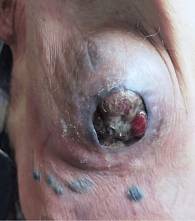
Однако уже с сентября 2021 г. пациент стал отмечать ухудшение самочувствия, быстрый рост образования в левой подмышечной области. При осмотре вновь выявлено образование в левой подмышечной области с зоной некроза в центре (рис. 12). К данному моменту общая длительность таргетной терапии составила шесть месяцев.
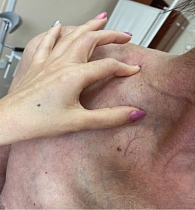
В октябре 2021 г. выполнено паллиативное хирургическое лечение – иссечение конгломерата подмышечных лимфатических узлов. Гистологическое заключение: в девяти выделенных лимфатических узлах метастазы меланомы; очаги некроза. По результатам выполненного обследования (КТ ОГК, МРТ ОБП, МРТ ГМ), отдаленные метастазы не выявлены. С учетом прогрессирования заболевания на фоне комбинированной таргетной терапии, после хирургического лечения пациенту была назначена иммунотерапия с использованием ингибиторов контрольных точек иммунного ответа. С ноября 2021 г. проводилась иммунотерапия пембролизумабом в дозе 200 мг в/в капельно каждый 21 день. После третьего введения клинически была отмечена отрицательная динамика: увеличился надключичный лимфоузел справа до 5 см в диаметре (рис. 13), появились образование в мягких тканях грудной клетки, гиперемия кожных покровов (рис. 14, 15), ухудшение общего состояния, выраженная слабость, болевой синдром.
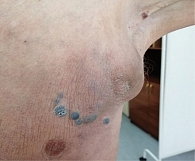
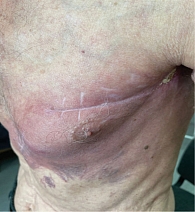
В феврале 2022 г. принято решение отменить терапию пембролизумабом в связи с прогрессированием болезни и в рамках четвертой линии терапии повторно назначить (rechallenge) таргетную терапию, которая ранее приносила пользу пациенту с метастатической меланомой. С 16 февраля 2022 г. пациент возобновил комбинированную таргетную терапию по схеме: дабрафениб 300 мг в сутки ежедневно длительно + траметиниб 2 мг в сутки ежедневно. На фоне терапии сразу было отмечено клиническое улучшение в виде исчезновения гиперемии кожных покровов и уменьшения размеров образования передней грудной клетки (рис. 16), а также уменьшения размеров лимфатического узла правой надключичной области и исчезновения образования передней грудной клетки (рис. 17).
Пациент продолжает принимать комбинированную таргетную терапию по прежней схеме: дабрафениб 75 мг по две таблетки два раза в день + траметиниб 2 мг по одной таблетке один раз в день внутрь ежедневно. Длительность таргетной терапии к моменту написания статьи составляет десять месяцев.
Приведенный клинический пример демонстрирует, что, с одной стороны, эффективность и длительность комбинированной таргетной терапии оказались выше при возврате к терапии в четвертой линии, чем при первом ее назначении, а с другой стороны, вероятно, этому способствовала мультидисциплинарность подхода в тактике ведения пациента с метастатической меланомой – с возможностью выполнения хирургического этапа лечения и удаления резистентного к комбинированной таргетной терапии клона опухолевых клеток. Переносимость лечения была удовлетворительной.
Приведенные данные и клинические примеры в очередной раз демонстрируют возможность и, самое главное, клиническую целесообразность возврата к комбинированной таргетной терапии, которая ранее была использована с эффектом.
Обсуждение
Несмотря на быстрый эффект на фоне комбинированной таргетной терапии, у половины пациентов наблюдается прогрессирование заболевания в течение примерно первого года лечения вследствие первичной или приобретенной лекарственной резистентности [11]. К наиболее часто встречающимся механизмам резистентности относится реактивация сигнального пути MAPK или пути PI3K-PTEN-AKT. Несколько механизмов резистентности могут быть обнаружены одновременно у одного и того же пациента (гетерогенность) или даже в одной и той же опухоли (внутриопухолевая гетерогенность) [12, 13].
В случаях, когда таргетная терапия была назначена в рамках первой линии терапии, иммунотерапия будет являться вариантом терапии второй линии у пациентов при прогрессировании заболевания. Однако у пациентов с прогрессированием заболевания на фоне комбинированной таргетной терапии (или при ее отмене по различным причинам: НЯ, достижение максимальной клинической пользы и др.) и при неэффективности терапии ингибиторами контрольных точек иммунитета прогноз остается неблагоприятным, а возможности терапии очень ограниченны.
Повторное назначение комбинации BRAFi и MEKi может быть рассмотрено в качестве третьей или последующей линии терапии у пациентов с мутацией в гене BRAF. На исходном уровне опухоли с BRAF-мутацией представляют собой гетерогенную популяцию чувствительных и резистентных к таргетной терапии клонов клеток. В ходе лечения клоны, чувствительные к таргетной терапии, погибают и в опухоли начинают преобладать резистентные клоны, что в конечном итоге ведет к прогрессированию или рецидиву заболевания. Во время периода без лечения или применения терапии, не нацеленной на BRAF, чувствительные клетки могут восстановить свою численность, что может возобновить у опухоли чувствительность к BRAFi + MEKi и обосновывает подход с возобновлением ТТ [14].
Данные ретроспективного анализа и проспективного исследования выявили возможность повторной индукции ответа более чем у 30% пациентов, при этом медиана ВБП составила примерно пять месяцев [15, 16].
В ретроспективное исследование S. Valpione и соавт. [15] было включено 116 пациентов с метастатической меланомой, которые получили терапию первой линии ингибиторами BRAF (58,6%) / BRAF + MEK (35,3%) / BRAF + IT (4,3%) и впоследствии получили терапию ингибиторами BRAF / BRAF + MEK в качестве терапии третьей линии. Медиана продолжительности первой линии терапии BRAFi ± MEKi составила 9,4 месяца. Было установлено, что длительность терапии первой линии была связана с частотой объективных ответов при повторном назначении таргетной терапии в третьей линии (14,8 месяца для пациентов, у которых развился ответ на терапию, против 9,7 месяца для пациентов, которые не ответили на лечение, p = 0,014). У пациентов, достигших контроля над заболеванием на фоне повторного назначения ТТ, отмечен более длительный интервал между первичным и повторным назначением BRAFi ± MEKi (8,8 месяца против 6,7 месяца соответственно, p = 0,011). Наиболее частыми причинами прекращения терапии были прогрессирование заболевания – у 83 больных (71,6%), НЯ – у 16 (13,8%), другие причины – у 9 (7,8%) пациентов. В интервале между назначением таргетной терапии 71,5% пациентов в качестве второй линии получили иммунотерапию, причем 22 (18,9%) пациентам проводилась последовательная иммунотерапия анти-CTLA-4 с последующим переходом на анти-PD-1-терапию. Другие методы лечения получили 17% пациентов, «лекарственные каникулы» были у 11% пациентов. Медиана продолжительности без лечения таргетными препаратами составила 7,7 месяца (95% ДИ 0,9–34,9). Большинство пациентов (62,9%), которые получили монотерапию BRAFi в первой линии, получили комбинированную таргетную терапию во второй линии (66,3%), что было связано с изменением рекомендаций по лечению. Частота объективных ответов при повторном применении BRAFi ± MEKi составила 42%: полный ответ наблюдался у 3% пациентов, частичный ответ – у 39%, стабилизация заболевания – у 24%, прогрессирование заболевания – у 30%, данные по 4% пациентов отсутствуют. Примечательно, что из 80 пациентов, ранее прекративших прием BRAFi ± MEKi по причине прогрессирования заболевания, у 30 пациентов ранее отмечался частичный ответ, а у одного – полный ответ. Медиана ОВ после повторного лечения составила 9,8 месяца (95% ДИ 0,2–34,4), медиана ВБП – 5 месяцев (95% ДИ от 0,2 до 31,7). Общая выживаемость составила 42,8%, однолетняя ВБП – 23,1%. Таким образом, при повторном назначении ТТ у четверти пациентов удается достичь 12-месячной ВБП.
В проспективное исследование II фазы COMBI-rechallenge M. Schreuer и соавт. [16] было включено 25 пациентов, которые в качестве первой линии получали таргетную терапию BRAFi/MEKi/BRАF + MEK. Все 25 пациентов прервали лечение таргетными препаратами вследствие прогрессирования заболевания. Медиана ВБП составила 6,9 месяца (95% ДИ 4,8–9,1). В интервале между назначением таргетной терапии 1 (4%) пациент получил анти-PD-1-терапию, 9 (36%) – анти-CTLA-4, 15 (60%) – последовательную анти-PD-1- и анти-CTLA-4-терапию. Медиана времени между первым применением таргетной терапии и повторным назначением составила 6,1 месяца (95% ДИ 4,6–7,8). Медиана ВБП во время повторного назначения ТТ составила 4,9 месяца (95% ДИ 3,6–6,2). Частота контроля над заболеванием составила 72% (рис. 18). Подтвержденный частичный ответ был задокументирован у 8 (32%) пациентов (при этом у шести пациентов было метастатическое поражение головного мозга), стабилизация заболевания – у 10 (40%) пациентов, у 7 (28%) пациентов было отмечено прогрессирование заболевания в течение двух месяцев после начала терапии. В данном исследовании не было обнаружено корреляции между продолжительностью интервала без терапии BRAFi/MEKi у пациентов с последующим ответом на лечение (29,5 недели, 95% ДИ 22,0–44,8) и без него (26,0 недели, 95% ДИ 15,0–32,5; p = 0,157). У четырех пациентов была достигнута более длительная выживаемость без прогрессирования во время повторного назначения ТТ по сравнению с ее назначением в первой линии. Разница в ВБП составила 0,3; 1,5; 2,3; 4,6 месяца. Медиана ОВ составила 19,9 месяца (95% ДИ 0–1,2). Данные, полученные в ходе исследования II фазы, сопоставимы с результатами нашего исследования, где медиана ВБП составила 5,0 месяца.
Заключение
Результаты опубликованных работ и наш собственный опыт демонстрируют, что повторное назначение (rechallenge) BRAFi и MEKi для пациентов можно считать оправданным в качестве варианта лекарственной терапии в третьей или последующих линиях. Данные ретроспективных и проспективных исследований подтверждают, что повторное применение таргетной терапии (преимущественно представлены данные для дабрафениба и траметиниба) дает клинические преимущества с возможностью достижения у четверти пациентов ВБП в течение одного года.
Остается ряд нерешенных вопросов. Каким должен быть минимальный период без таргетной терапии перед возобновлением лечения? Как сроки и причины прекращения лечения влияют на последующие результаты? Какие клинические данные или биомаркеры лучше всего позволяют идентифицировать пациентов, которые ответят на лечение?
Ответы на эти вопросы могут быть получены в будущих исследованиях, однако выбор в пользу наших пациентов мы делаем уже сегодня. Повторное назначение комбинированной таргетной терапии может быть рассмотрено у пациентов с метастатической/неоперабельной меланомой в качестве терапии третьей и последующих линий.
K.V. Orlova, PhD, N.N. Petenko, PhD, E.A. Nazarova, V.V. Nazarova, PhD, G.O. Kaidarova, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
A.I. Evdokimov Moscow State University of Medicine and Dentistry
East Kazakhstan Regional Multidisciplinary Center of Oncology and Surgery
Contact person: Kristina V. Orlova, krisman03@gmail.com
In this paper we review the existing data and our clinical experience of repeated use of combination therapy with BRAF/MEK inhibitors (BRAFi/MEKi) in the treatment of patients with BRAF-mutated metastatic melanoma of the skin. Recent advances in medical oncology significantly increased the life expectancy of patients with metastatic and/or unresectable melanoma of the skin. However, some patients develop resistance to therapy. Retreatment after interruption or "intermediate" therapy may be of clinical benefit. Contemporary drug therapy becomes more available and there are fewer challenges to chose the first and second line therapy for patients with metastatic and/or unresectable melanoma, but there are still questions on subsequent treatment options when BRAFi/MEKi therapy had been used after the disease progression following the initial objective response. In this article, we review the definitions of “retreatment” or “rechallenge”, give the overview of the literature data, and present our clinical experience.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.