Эффективность и безопасность ибандроната: доказательная база
- Аннотация
- Статья
- Ссылки
- English

Остеопороз (ОП) – хроническое прогрессирующее заболевание скелета, которое остается актуальной медико-социальной и экономической проблемой здравоохранения во всем мире, что обусловлено его широкой распространенностью, которая увеличивается с возрастом, поздней диагностикой и отрицательным влиянием на качество и продолжительность жизни [1–4].
В будущем данная проблема приобретет еще более глобальный характер, поскольку наблюдается тенденция старения населения. Так, согласно официальному демографическому прогнозу в 2030 г. количество лиц в возрасте 65 лет и старше увеличится до 18% [5].
При ОП снижается прочность кости, что приводит к переломам при минимальных травмах [1, 6–8].
Чаще всего ОП страдают женщины, поскольку у них исходно меньшая костная масса, прочность позвонков из-за их меньшего размера, большая средняя продолжительность жизни и соответственно потеря костной массы на протяжении жизни (вследствие менопаузы) [9–11].
Среди всех форм заболевания преобладает первичный ОП. С учетом клинических особенностей, гормональных изменений и связи заболевания с возрастом и менопаузой предложено различать несколько типов первичного ОП (постменопаузальный, сенильный, ювенильный и идиопатический).
Первичный ОП – самостоятельное заболевание, которое развивается в любом возрасте, однако наиболее часто у женщин старше 50 лет в постменопаузальном периоде [1, 3, 10].
В течение первых пяти лет после наступления менопаузы потеря костной массы у женщины может составить до одной трети общей массы костей, утраченной за всю жизнь, что повышает риск переломов в результате даже минимальных нагрузок [10, 12].
При продолжительном дисбалансе трабекулы истончаются, утрачивают свою пластинчатую структуру и становятся цилиндрическими, возрастают биомеханическая нагрузка и напряжение. Это приводит к перфорации и разрушению трабекул. Снижается минеральная плотность кости (МПК), ухудшается качество костной ткани [1, 4, 11].
На долю вторичных форм в общей структуре ОП приходится 15–20% случаев. Как правило, это проявление других заболеваний или следствие приема препаратов, отрицательно воздействующих на костную ткань [1, 13]. Потенциальный риск переломов при вторичных ОП сопоставим с таковым при первичном ОП [14].
Поздняя диагностика и несвоевременное начало терапии остеопороза отмечаются у 75% женщин и 90% мужчин [4]. По данным Национального комитета качества здравоохранения США, более 90% взрослых с сердечно-сосудистыми заболеваниями получают бета-блокаторы и только 19% взрослых с частыми переломами получают терапию по поводу остеопороза [8].
Поскольку ОП долгое время протекает бессимптомно, его называют безмолвной эпидемией. Первым проявлением, как правило, являются остеопоротические переломы без видимой причины или при минимальной физической нагрузке. Вне зависимости от показателей МПК наличие низкоэнергетического перелома позволяет поставить диагноз «тяжелый остеопороз» [3, 9].
Переломы могут быть причиной болевого синдрома, в частности боли в спине, усиливающейся после физической нагрузки, при длительном пребывании в одном положении. По поводу боли пациенты либо вообще не обращаются к врачу, либо в течение длительного времени неэффективно лечатся по поводу остеохондроза, радикулита и других заболеваний опорно-двигательной системы [4].
Характерным симптомом ОП считается постепенное снижение линейного роста и нарушение осанки.
Переломы, которые происходят спонтанно или связаны с падением с высоты роста (на пол), являются поздними проявлениями ОП. На переломы тел позвонков, возникающие, как правило, раньше остеопоротических переломов любой другой локализации, приходится около половины всех переломов [1, 6, 9]. Переломы дистального отдела лучевой кости, тел позвонков чаще наблюдаются при постменопаузальном ОП и некоторых формах вторичного ОП [3, 10]. Остеопороз является основной причиной перелома шейки бедра у женщин старше 65 лет [7, 12].
К сожалению, не всегда низкоэнергетическим переломам придают должное значение. Известно, что после первого перелома запускается «каскад» переломов, при этом риск повторного остеопоротического перелома позвонка повышается в четыре раза, перелома бедра – в два раза [3, 9, 12].
Механизм действия бисфосфонатов
В настоящее время терапия ОП предполагает использование немедикаментозных и медикаментозных методов. К первым относят прежде всего отказ от курения, сокращение потребления алкоголя, увеличение физической активности в зависимости от состояния [3].
Целью фармакотерапии является повышение МПК и снижение рисков переломов.
Для лечения ОП в настоящее время используется несколько групп препаратов разной направленности и с разным механизмом действия. В зависимости от влияния на костное ремоделирование выделяют антирезорбтивные и анаболические средства. Антирезорбтивные препараты уменьшают активность процессов ремоделирования и увеличивают минерализацию костной ткани [2, 15, 16].
Сегодня трудно представить антиостеопоротическую терапию без бисфосфонатов (БФ), которые успешно применяются уже в течение многих лет [15–17]. БФ продемонстрировали эффективность при постменопаузальном, сенильном, глюкокортикостероидном ОП и ОП у мужчин [10, 13, 16].
Бисфосфонаты – стабильные аналоги природных неорганических фосфатов. Атом кислорода в молекуле пирофосфата заменен на атом углерода (Р-С-Р) и в боковых цепях имеются два радикала: R1-ОН – группа, увеличивающая физико-химическое связывание БФ с гидроксиапатитом, и R2 – определяющая биологическое действие препаратов на костные клетки [15, 18].
Селективное действие БФ на костную ткань прежде всего связано с высоким сродством с кристаллами гидроксиапатита кости, что позволяет им откладываться в местах образования новой кости. БФ сохраняются в местах костеобразования до тех пор, пока не произойдет замена старой кости на новую [16, 19, 20].
Основной мишенью БФ являются остеокласты [21, 22]. Проникая в костную ткань и создавая высокую концентрацию в лакунах резорбции, БФ концентрируются вокруг остеокластов. В пределах этих клеток они вызывают многочисленные изменения, в частности потерю щеточной каймы, разрушение цитоскелета, неспособность к передвижению, уменьшение хемотаксиса к местам резорбции и индукцию апоптоза [15, 21]. Деятельность остеокластов замедляется, как следствие, снижается скорость костного ремоделирования с угнетением фазы резорбции [20, 22].
Однако антирезорбтивная активность разных БФ существенно различается в связи с особенностями химической структуры молекулы. Наиболее выражена она у азотсодержащих БФ (аминобисфосфонаты), которые блокируют синтез фарнезилдифосфатсинтазы [23, 24]. В результате снижается образование мевалоната – вещества, необходимого для поддержания нормальной цитоархитектоники и жизнедеятельности остеокластов [25].
Азотсодержащие БФ считаются более сильными ингибиторами активности остеокластов и остеолизиса, чем безазотные соединения [3, 16].
Структурные различия в азотсодержащей цепочке БФ также влияют на ингибирование костной резорбции. Присутствие в боковой цепи атома азота объясняет их способность ингибировать модификацию белков в остеокластах, что ведет к апоптозу зрелых клеток. Подтверждением служит появление специфических изменений в клетке и структуре ядра [19, 20, 26]. При этом клетки-предшественники остеокластов теряют способность к дифференцировке и созреванию, что также способствует уменьшению популяции остеокластов. Необходимо отметить, что некоторые детали механизма действия БФ продолжают изучаться.
Остеобласты являются потенциальной мишенью БФ. Данные исследований in vitro свидетельствуют, что под воздействием БФ остеобласты снижают секрецию остеокласт-стимулирующего фактора [15, 20].
Другие эффекты БФ носят анаболический характер. Препараты способны увеличивать выживаемость остеобластов и остеоцитов за счет блокады их апоптоза, повышать синтез остеобластами коллагена типа 1, что приводит к изменению микроархитектоники (в частности, утолщению трабекул кости) и увеличению минерального компонента кости. В результате предупреждается потеря костной массы и снижается риск остеопоротических переломов [19, 27].
Эффективность и приверженность терапии
При лечении любого хронического заболевания, включая ОП, существует значимая проблема – тщательность соблюдения рекомендаций по приему препаратов, что в свою очередь влияет на эффективность проводимой терапии. Установлено, что риск остеопоротических переломов возрастает на 40% у больных, принимавших менее половины рекомендованной курсовой дозы, по сравнению с теми, у кого приверженность терапии составляла 90% [28].
Согласно определению Всемирной организации здравоохранения приверженность терапии – это соответствие поведения пациента рекомендациям врача, включая прием препаратов, диету и/или изменение образа жизни. В таблице представлены факторы, которые могут оказать влияние на выполнение пациентами рекомендаций врача.
Один из эффективных способов повышения приверженности пациентов антиостеопоротической терапии – упрощение схемы фармакотерапии, простой режим [29, 30]. Следовательно, снижение кратности приема препарата при сохранении терапевтического эффекта представляет собой одну из действенных стратегий, поскольку ограничивает возможность отклонений от рекомендованного режима приема.
Клинические возможности первого бисфосфоната для ежемесячного применения
Широкие перспективы имеют БФ нового поколения. Их преимущества заключаются не только в большей антирезорбтивной активности, но и в возможности прерывистых режимов терапии [16].
Азотсодержащий БФ третьего поколения ибандронат (Бонвива) является одним из современных и высокоэффективных антиостеопоротических средств [23, 31–33]. Данный препарат обладает пролонгированным действием, поэтому его применяют не ежедневно, не еженедельно, а один раз в месяц по 150 мг [34, 35]. Кроме того, в России зарегистрирована еще одна лекарственная форма для внутривенной инфузии в дозе 3 мг, режим применения – один раз в три месяца.
На этапе доклинических исследований показано, что относительная активность ибандроната выше в два, десять и 50 раз активности ризедроната, алендроната и памидроната соответственно [36].
Ибандронат – это первый БФ, длительное лечение которым в прерывистом режиме оказалось эффективным [31, 37, 38].
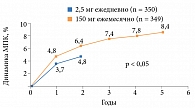
Эффективность Бонвивы подтверждена данными крупных клинических исследований, в которых изучалось влияние терапии на МПК и качество кости, риск развития новых переломов, безопасность терапии и др., с участием более 13 тыс. пациентов из разных стран [23, 32, 33, 35, 38–42]. Доказано, что Бонвива положительно воздействует на МПК не только позвоночника, но и шейки бедра, предотвращая развитие неблагоприятных для жизненного прогноза остеопоротических переломов (рис. 1). Кроме того, отмечены безопасность и хорошая переносимость ибандроната [23].
Большой интерес представляют результаты исследования MOBILE. Это многоцентровое рандомизированное двойное слепое исследование, которое включало 1609 женщин (возраст 55–80 лет) с продолжительностью постменопаузы пять лет и более, имевших ОП в поясничном отделе позвоночника (Т-критерий МПК от -2,5 до -5,0 CO) [38]. Согласно дизайну исследования пациентам назначались Бонвива или плацебо. При этом существовало несколько вариантов режима их приема: 2,5 мг Бонвивы в сутки внутрь и плацебо один раз в месяц; 100 мг Бонвивы внутрь один раз в месяц и ежедневный прием плацебо; 100 мг Бонвивы внутрь один раз в месяц по 50 мг в сутки два дня подряд (50 мг/50 мг) и ежедневный прием плацебо; 150 мг Бонвивы внутрь один раз в месяц и ежедневный прием плацебо. Все участники исследования ежедневно принимали также препараты кальция (500 мг) и витамина D (400 МЕ).
Первичной конечной точкой при оценке эффективности ибандроната было изменение показателей МПК поясничных позвонков через год лечения по сравнению с исходным уровнем. Дополнительно изучалось изменение МПК поясничных позвонков через два года терапии, в проксимальном отделе бедра через один и два года, изменение уровня маркеров костного обмена (С-концевого пептида проколлагена I типа (СТХ)) через один и два года.
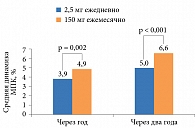
Через год отмечено достоверное повышение на 4,3% МПК поясничного отдела позвоночника относительно исходных показателей при приеме 50 мг/50 мг Бонвивы, на 4,1% – при приеме 100 мг, на 4,9% – при ежемесячном приеме 150 мг и на 3,9% – при ежедневном приеме 2,5 мг Бонвивы [38]. Прирост МПК поясничных позвонков через два года исследования составил 5,3, 5,6 и 6,6% при приеме 50 мг/50 мг, 100 мг и 150 мг Бонвивы соответственно и 5,0% при ежедневном приеме препарата (рис. 2). Подобные результаты получены и для МПК бедра. Достоверное увеличение МПК общего показателя бедра, шейки бедра и области большого вертела отмечалось во всех группах лечения через год терапии и сохранялось в течение второго года лечения.
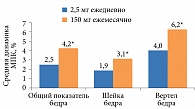
Прием 150 мг Бонвивы один раз в месяц по сравнению с ежедневным приемом сопровождался самым большим и прогрессивным увеличением показателей МПК во всех точках обследования проксимальных отделов бедренной кости (p < 0,05 через два года) (рис. 3).
Изучение уровня маркеров костного обмена показало снижение их уровня уже через три месяца лечения, которое продолжалось в течение всего периода наблюдения. В частности, через два года в группах лечения концентрация CTХ в крови уменьшилась на 56,1–61,5%. Наибольшее снижение показателя наблюдалось в группе, получавшей 150 мг ибандроната. Исследование также показало хороший профиль безопасности терапии Бонвивой один раз в месяц.
Следует подчеркнуть, что Бонвива стала первым препаратом для однократного ежемесячного применения при ОП. Результаты исследования MOBILE продемонстрировали, что применение Бонвивы в дозе 150 мг один раз в месяц обеспечивает не только высокую терапевтическую эффективность (восстановление костного метаболизма до пременопаузальных значений), уменьшение риска патологических переломов, но и точное соблюдение назначений врача в долгосрочной перспективе. Положительный эффект отмечался уже через год применения ибандроната. В частности, у 9 из 10 пациенток, получавших препарат, зафиксирован прирост МПК либо в поясничных позвонках, либо в поясничных позвонках и бедре [38]. Результаты продленной фазы исследования свидетельствуют о целесообразности применения Бонвивы не менее пяти лет (рис. 1) [35, 41, 42].
В исследовании BONE подтверждена эффективность ибандроната по предупреждению позвоночных и внепозвоночных переломов в течение трех лет наблюдения [33]. При этом терапия Бонвивой способствовала снижению риска развития позвоночных переломов на 62% по сравнению с другими БФ. Эффективность аналогичного курса алендроната в отношении данного показателя составила около 50%.
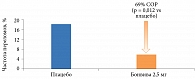
Другое важное доказательство эффективности ибандроната получено при ретроспективном анализе результатов исследования BONE, включавшем 375 пациенток с высоким риском внепозвоночных переломов (исходный Т-критерий МПК шейки бедра < -3,0 СО). Установлено, что препарат достоверно снижает риск указанных переломов на 69% (рис. 4) [31].
Качество костной ткани является важной характеристикой, определяющей прочность кости. В этой связи представляет интерес последующий гистологический и гистоморфометрический анализ костных биоптатов в подгруппе пациенток исследования BONE, участвовавших в программе по оценке влияния интермиттирующего и ежедневного приема ибандроната на качество и микроархитектонику костной ткани [33]. Обследовано 110 женщин, рандомизированных для проведения биопсии крыла подвздошной кости (на 22-м и 34-м месяцах терапии). Результаты биопсии показали, что оба режима перорального приема Бонвивы способствуют формированию новой кости без признаков нарушения минерализации костного матрикса, причем улучшение микроархитектоники кости было явным.
Показательными стали результаты многоцентрового исследования BALTO, в котором сравнивались разные режимы терапии, анализировались предпочтения пациентов и удобство применения антиостеопоротических средств. 66,1% пациенток с постменопаузальным ОП предпочли ежемесячный прием 150 мг ибандроната еженедельному приему 70 мг алендроната [39].
О практических преимуществах применения ибандроната свидетельствует и опрос участников исследования BALTO. Они отмечали, что ежемесячное применение препарата более удобно: такой режим терапии легче соблюдать в течение длительного времени, он более приемлем для привычного образа жизни. Это обеспечивает большую приверженность терапии, а значит – лучшие исходы ОП.
Интересны результаты ретроспективного когортного исследования VIBE, одной из целей которого было определить риск развития переломов у приверженных лечению пероральными БФ пациентов, получавших либо ибандронат (150 мг/мес) или любой другой БФ (алендронат в дозах 35 и 70 мг/нед, ризедронат в дозе 35 мг/нед) [40]. В первичный анализ включено 64 182 пациентки, которые принимали более 90 дней ибандронат (n = 7345), БФ еженедельно (n = 56 837). Средняя длительность терапии составила семь месяцев. Риски внепозвоночных переломов, переломов бедра и всех клинических переломов оказались сопоставимыми в обеих группах. В частности, частота переломов в группе, получавшей БФ еженедельно, составила 1,5%, в группе, получавшей ибандронат, – 1,4%, то есть была минимальной. Показательно, что количество позвоночных переломов при приеме ибандроната оказалось вдвое меньше (0,11 против 0,24% соответственно, р < 0,006). После поправки на возраст, предшествующие переломы, показатели МПК и предшествующую лекарственную терапию результаты анализа не изменились: риск позвоночных переломов на фоне применения ибандроната был достоверно меньше, чем на фоне приема других пероральных БФ (скорректированный относительный риск 0,36, p = 0,006).
В недавно опубликованном сравнительном исследовании оценивали эффективность применения разных БФ в течение двух лет [43]. Пациенток с постменопаузальным ОП (n = 172) рандомизировали на три группы: ибандроната (150 мг/мес), алендроната (70 мг/нед), ризедроната (35 мг/нед). Все участницы получали ежедневно препараты кальция (1200 мг) и витамина D (800 ME). Большее увеличение МПК поясничных позвонков достигнуто в группах, получавших ибандронат и алендронат.
В целом результаты всех клинических исследований продемонстрировали, что относительно большая доза, которая была необходима для приема ибандроната в режиме один раз в месяц, не оказывала существенного влияния на его переносимость. Пероральную лекарственную форму Бонвивы отличает низкий риск побочных явлений со стороны желудочно-кишечного тракта [18, 23, 32, 33, 35, 37, 44].
Особенности применения
Бонвиву следует принимать в дозе 150 мг (одна таблетка) один раз в месяц натощак, за 60 минут до приема пищи, жидкостей (кроме воды) или других медикаментозных средств, чтобы обеспечить максимальное всасывание. Изменять дозу препарата у лиц пожилого возраста не требуется. Нет необходимости в коррекции дозы при слабом и умеренно выраженном нарушении функции почек (скорость клубочковой фильтрации > 30 мл/мин/1,73 м2), нарушении функции печени.
Важно помнить, что одним из условий эффективного лечения ОП ибандронатом, как и любым другим БФ, при наличии гипокальциемии является обязательная коррекция этого сдвига до начала терапии. Дополнительно пациентам следует рекомендовать прием препаратов кальция и витамина D.
Заключение
Бонвива – высокоэффективное средство для лечения ОП, которое может приниматься один раз в месяц. Такой режим применения обусловливает повышение приверженности терапии и, как следствие, ее эффективности.
Ye.V. Biryukova
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
Contact person: Yelena Valeryevna Biryukova, lena@obsudim.ru
Osteoporosis is a chronic disease related to development of pathological fractures, prevention of which represents an important task for modern medicine. Pathophysiologically-evidenced approaches to treatment of osteoporosis including medications aimed at inhibiting bone resorption are discussed in the paper. It is emphasized that in order to increase therapeutic efficacy patients should display compliance for treatment. There are presented results from the major international studies (BONE, MOBILE etc.) demonstrating efficacy and safety of using extended-release once-monthly ibandronate.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.