Влияние сахароснижающих препаратов на костное ремоделирование
- Аннотация
- Статья
- Ссылки
- English
Помимо основных механизмов – дефицита инсулина и глюкозотоксичности немаловажное значение в развитии патологий костной ткани при сахарном диабете 2 типа отводится выбору пероральных сахароснижающих препаратов.
В последнее время активно обсуждается регуляция метаболизма костной ткани инкретинами. В этой связи особый интерес представляют препараты из группы инкретиномиметиков, в частности ситаглиптин (Янувия).
Помимо основных механизмов – дефицита инсулина и глюкозотоксичности немаловажное значение в развитии патологий костной ткани при сахарном диабете 2 типа отводится выбору пероральных сахароснижающих препаратов.
В последнее время активно обсуждается регуляция метаболизма костной ткани инкретинами. В этой связи особый интерес представляют препараты из группы инкретиномиметиков, в частности ситаглиптин (Янувия).


Введение
Сахарный диабет (СД) – одна из важнейших социально значимых проблем здравоохранения. По оценкам Международной диабетической федерации, в 2013 г. в мире насчитывалось около 382 млн пациентов с СД, в 2015 г. – 415 млн [1].
При СД отмечаются различные метаболические изменения. Некоторые из них приводят к нарушениям процессов костного ремоделирования и хрупкости костной ткани.
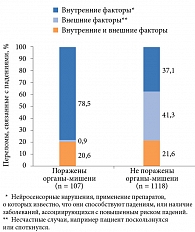
Высокая распространенность среди пациентов с СД нарушений костного метаболизма и остеопороза стала основанием признать последний недооцененным осложнением СД [2]. Так, частота встречаемости остеопении среди больных СД составляет 30–67%, остеопороза – 7,0–47% [3–7]. Метаанализ 15 обсервационных исследований (11 когортных и четыре поперечных, 263 006 пациентов с диабетом и 502 115 – без диабета) показал, что заболевание повышает риск перелома бедра – относительный риск (ОР) 1,296 при 95%-ном доверительном интервале (ДИ) 1,069–1,571, но не перелома тел позвонков – ОР 1,134 (95% ДИ 0,936–1,374) [5]. При этом наблюдалась значительная гетерогенность исследований переломов бедра.
Сахарный диабет 2 типа и хрупкость костной ткани
Остеопороз, развившийся вследствие СД, характеризуется не только снижением массы костной ткани, но и нарушением ее микроархитектоники.
У пациентов с СД выделяют несколько факторов риска развития остеопороза и переломов.
Эпидемиологические факторы (возраст и пол)
Наиболее подвержены переломам лица старше 50 лет и женщины (рис. 1) [7]. Установлено, что риск перелома проксимального отдела бедренной кости у пациенток с СД 1 и 2 типов в 12 и 1,7 раза выше, чем у пациенток без СД [3].
Падения
У пожилых пациентов почти 90% переломов бедра и запястья происходят в результате падения. При СД риск падений возрастает. Это обусловлено снижением остроты зрения вследствие диабетической ретинопатии и катаракты, нарушением равновесия, мышечной слабостью вследствие изменения нервно-мышечной/скелетной регуляции, ортостатической гипотензией, выраженными гипо- и гипергликемическими состояниями, неотложными позывами с недержанием мочи и т.д. при нейропатии, нефропатии, неадекватной сахароснижающей терапии, ограничением двигательной активности при синдроме диабетической стопы (нейроишемические, трофические язвы, постампутационные изменения), ожирении, остеоартите и пр. (рис. 2) [8, 9].
Специфические факторы
На хрупкость костей влияют неферментативное гликозилирование коллагена, снижение костного метаболизма, провоспалительное состояние, потеря инкретинового эффекта, жировое перерождение костного мозга, нарушение регуляции адипокинов, сигнального пути инсулина, дефицит инсулина, изменение уровня инсулиноподобного фактора роста 1 и метаболизма кальция.
Дефицит инсулина и/или инсулинорезистентность. Инсулин – универсальный гормон, который участвует во всех видах обмена веществ. Абсолютный или относительный дефицит инсулина, инсулинорезистентность приводят к снижению уровня инсулиноподобных и других факторов роста и белков, связывающих их, а также анаболического эффекта инсулина на остеобласты и синтез коллагена 1-го типа – основного компонента белкового матрикса кости и гиалуроната [10].
Исследование маркеров костного метаболизма при СД 1 типа показало снижение уровня остеокальцина и повышение – дезоксипиридинолина [11–13], что свидетельствует о преобладании процессов разрушения костной ткани над процессами ее образования. Увеличение уровня инсулина натощак на каждые 10 мкЕд/мл способствовало приросту минеральной плотности лучевой кости и позвонков на 0,33 и 0,57 г/см2 соответственно [14]. У пациентов с впервые выявленным СД 2 типа (после поправки на индекс массы тела) показатели минеральной плотности костной ткани были выше, чем у пациентов контрольной группы [15].
Гипергликемия. Прямое влияние гликемии на костный метаболизм остается дискутабельным. В частности, обсуждается роль конечных продуктов гликирования (КПГ). Снижение упругости и прочности костной ткани при стрептозотоцин-индуцированном СД у животных было связано с накоплением КПГ и нарушением функции остеобластов, структуры коллагеновых волокон [16]. Конечные продукты гликирования и их рецепторы инициируют окислительный стресс. Это вызывает воспаление в остеобластах и остеокластах, клетках сосудистой стенки, вовлеченных в кальцификацию у пациентов с СД [17].
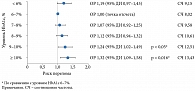
При проведении мультивариантного анализа (n = 20 025) с поправками на возраст, пол, курение, употребление алкоголя, продолжительность диабета, группу гипогликемического препарата, применение антигипертензивных препаратов, ожирение, исходный уровень глюкозы натощак, ишемическую болезнь сердца, застойную сердечную недостаточность, инсульт, рак, гиперлипидемию, гипертензию, фибрилляцию предсердий, хронический гепатит, хроническую обструктивную болезнь легких, диабетическую ретинопатию, гипогликемию, периферическую нейропатию выявлено, что у пожилых пациентов с СД 2 типа и высоким уровнем гликированного гемоглобина (HbA1c) риск переломов бедренной кости возрастает (рис. 3) [18].
Гипергликемия способствует также повышенной секреции кальцийтропных гормонов – паратиреоидного и кальцитонина в результате гиперкальцийурии (на фоне глюкозурии) с развитием гипокальциемии. Вторичный гиперпаратиреоз, развившийся на фоне гипокальциемии, в сочетании с дефицитом инсулина приводит к снижению плотности костной ткани. Повышение уровня кальцитонина, скорее всего, носит компенсаторный характер – снизить резорбцию костной ткани [19].
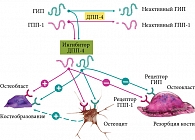
Дисбаланс инкретинов. В норме в ответ на поступление пищи или глюкозы в кишечнике синтезируются основные инкретины – глюкозозависимый инсулинотропный пептид (ГИП) и глюкагоноподобный пептид 1 (ГПП-1), которые стимулируют секрецию инсулина бета-клетками поджелудочной железы.
У пациентов с СД 2 типа, ожирением и инсулинорезистентностью наблюдается значительный адипоцитокиновый дисбаланс: снижение секреции ГПП-1 при сохранной секреции ГИП [20]. В то же время при СД и постменопаузальном остеопорозе отмечается повышенная активность дипептидилпептидазы 4 (ДПП-4), а также изменение уровня ее экспрессии.
Снижение примерно через 20 минут после приема пищи маркеров костной резорбции служит доказательством одного из экстрапанкреатических эффектов ГИП и ГПП-1 – влияния на костный метаболизм [21].
Установлено, что эндогенные ГИП и ГПП-1 препятствуют развитию остеопороза и остеопении. У экспериментальных мышей с дефицитом рецепторов ГПП-1 констатировали остеопению кортикальной ткани, ломкость костей и увеличение количества остеокластов и маркеров костной резорбции.
В отличие от ГИП, который подавляет апоптоз остеобластов, ГПП-1 не оказывает прямого влияния на остеобласты и остеокласты. Поскольку резорбтивные эффекты устранялись в присутствии кальцитонина, предположили, что протективное воздействие ГПП-1 осуществляется посредством кальцитонин-зависимого механизма [22, 23].
У человека экспрессия рецептора ГПП-1 обнаружена на клетках-предшественниках остеобластов. Это позволяет модулировать активность последних.
В костном мозге ГПП-1, влияя на стромальные клетки, вызывает клеточную пролиферацию и усиление дифференцировки клеток по пути остеобластов, что предотвращает дифференцировку в адипоциты [24].
Возможно, ГИП также увеличивает депонирование кальция в костной ткани в ответ на поступление пищи – у мышей с дефицитом рецепторов ГИП наблюдалось постпрандиальное повышение кальциемии [22, 25].
Ятрогенный фактор. Сахароснижающие препараты могут оказывать негативное влияние на костный метаболизм.
Известно, что к развитию остеопороза приводит терапия тиазолидиндионами (ТЗД). Их отрицательный эффект связан с активацией рецепторов, активируемых пероксисомными пролифераторами, что обусловливает изменения на уровне мезенхимальных стволовых клеток костного мозга: усиление адипогенеза и снижение остеобластогенеза. В результате резорбция доминирует над костеобразованием и повышается риск переломов [26].
Препараты сульфонилмочевины (СМ) также повышают риск переломов. Ретроспективный анализ показал более высокую частоту переломов за три года наблюдения в основной группе по сравнению с группой контроля [27]. Ингибиторы натрий-глюкозного котранспортера 2-го типа в краткосрочных исследованиях также продемонстрировали отрицательное влияние на частоту переломов. Снижение минеральной плотности костной ткани, повышение маркеров костного метаболизма, снижение уровня эстрадиола крови, увеличение кальциурии и отрицательный кальциевый баланс выявлены у пациентов, получавших канаглифлозин. Кроме того, у них повышалась частота переломов верхних конечностей [28].
Препараты, положительно влияющие на костный метаболизм
Существуют препараты, положительно воздействующие на костный метаболизм. Так, метформин (МЕТ) влияет на метаболизм глюкозы посредством активации АМФ-активируемой протеинкиназы, альфа-1-субъединица которой экспрессируется в костной ткани в остеобластах и остеокластах. В условиях in vitro показано, что метформин, активируя AMФК-сигнальный путь, способствует дифференцировке и минерализации остеобластов, повышает уровень костной щелочной фосфатазы и стимулирует продукцию коллагена 1-го типа [29].
Учитывая механизмы влияния дефицита инкретинов на костную ткань, костный метаболизм способны улучшать инкретиномиметики (агонисты рецепторов ГПП-1 (аГПП-1), ингибиторы ДПП-4 (иДПП-4)). В экспериментальных исследованиях назначение аГПП-1 и иДПП-4 ассоциировалось с усилением костеобразования и снижением резорбции [21]. Однако в клинических исследованиях продемонстрирован нейтральный остеопротективный эффект аГПП-1. В отличие от препаратов этой группы, которые усиливают только эффекты ГПП-1, иДПП-4 воздействуют и на другие субстраты, играющие роль в костном метаболизме: инкретины, пептиды желудочно-кишечного тракта (ГПП-1, ГИП, ГПП-2), нейропептиды и т.д. (рис. 4) [24]. В настоящее время еще не все эффекты иДПП-4 исследованы [24].
Результаты общенационального когортного исследования с участием 207 558 пациентов в возрасте 50 лет и старше, начавших применение сахароснижающих препаратов с 2008 по 2011 гг., свидетельствуют, что иДПП-4 в отличие от препаратов СМ оказывают защитное воздействие на метаболизм костной ткани при добавлении к МЕТ (рис. 5) [30].
Метаанализ, проведенный в 2011 г. M. Monami и соавт., показал, что иДПП-4 по сравнению с плацебо и другими сахароснижающими препаратами снижают риск переломов (ОР 0,6, р = 0,045). Из 63 переломов 26 произошли в группе иДПП-4, 37 – в группах контроля [31].
Ситаглиптин (Янувия)
Первый селективный иДПП-4 ситаглиптин (Янувия) был одобрен к применению в 2006 г. Уже в 2007 г. появилась фиксированная комбинация ситаглиптина и метформина – препарат Янумет.
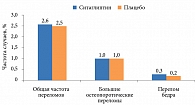
В исследовании TECOS (более 14 тыс. пациентов из 38 стран) по оценке сердечно-сосудистой безопасности ситаглиптина по сравнению с плацебо при их добавлении к стандартной терапии СД также изучалось влияние терапии на риск переломов [32]. Полученные результаты продемонстрировали отсутствие увеличения риска переломов на фоне применения ситаглиптина: как в отношении общей частоты переломов – 2,6 vs 2,5% случаев, р = 0,944, больших остеопоротических переломов – 1,0 vs 1,0%, р = 0,779, так и в отношении перелома бедра – 0,3 vs 0,2% случаев, р = 0,747 соответственно (рис. 6).
Скорректированная частота этих переломов на 1000 пациенто-лет составила 8,7 и 8,6, 3,5 и 3,3, 0,8 и 0,7 соответственно.
Результаты исследования TECOS, представленные 8 июня 2015 г. на конгрессе Американской диабетической ассоциации, позволили предположить, что ситаглиптин не оказывает влияния на риск развития сердечно-сосудистых событий, и подтвердили отсутствие повышения риска переломов на фоне такой терапии.
В американском популяционном когортном исследовании оценивалась связь между началом применения ситаглиптина и частотой остеопоротических переломов у 72 738 пациентов с СД 2 типа [33]. Средний возраст участников – 52 года, уровень HbA1c – 7%.
Исследователи сравнивали частоту переломов бедра, позвонков, проксимального отдела плечевой кости и дистального отдела лучевой кости в группе ситаглиптина и контрольной группе.
Средняя продолжительность наблюдения составила 2,2 года.
Многомерный анализ показал, что терапия ситаглиптином не влияет на риск новых переломов (скорректированное ОР 1,1 (95% ДИ 0,8–1,4, р = 0,7). Однако терапия инсулином (р < 0,001), препаратами СМ (р < 0,008) и ТЗД (р = 0,019) ассоциировалась с увеличением такового.
Заключение
Нарушение плотности и микроархитектоники костной ткани является недооцененным или незамеченным осложнением СД 2 типа, требующим ранней диагностики и коррекции.
При выборе сахароснижающей терапии необходимо учитывать эффективность снижения уровня глюкозы, профиль побочных эффектов, дополнительные ожидаемые преимущества и отдавать предпочтение препаратам, не повышающим риск переломов.
Анализ литературы свидетельствует о нейтральном и положительном влиянии иДПП-4 на метаболизм костной ткани. Однако для более подробного изучения воздействия препаратов данной группы на костную ткань и риск переломов требуется проведение дальнейших долгосрочных исследований.
На сегодняшний день результаты крупных рандомизированных исследований и анализ данных пациентов с СД 2 типа подтверждают, что ситаглиптин (Янувия) не увеличивает риск переломов.
A.M. Mkrtumyan, L.V. Yegshatyan
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
The article examines various metabolic disturbances observing in diabetes and leading to changes in bone remodeling.
Besides the main mechanisms – insulin deficiency and glucosetoxicity – the choice of oral glucose-lowering drugs is of great importance in the development of pathologies of bone tissue in diabetes mellitus type 2.
Lately the regulation of bone metabolism with incretins was actively discussed. In this regard, of particular interest are drugs from the group of incretin agonists, in particular sitagliptin (Januvia).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.