Бонвива – мощный антиостеопоротический бисфосфонат
- Аннотация
- Статья
- Ссылки
- English
Остеопороз (ОП) – системное метаболическое заболевание скелета, характеризующееся снижением костной массы и нарушением ее качества (микроархитектоники), что приводит к снижению прочности кости и повышению риска переломов. На долю первичного ОП, преимущественно постменопаузального, приходится 85% случаев.
При ОП отсутствуют характерные ранние патогномоничные симптомы, кроме уже перенесенных переломов [1]. Эпидемиологические исследования показывают более низкую частоту переломов шейки бедра и костей предплечья у мужчин по сравнению с женщинами [2]. В то же время распространенность переломов позвонков одинакова у пациентов обоих полов. Показатели смертности вследствие остеопоротических переломов выше у мужчин.
Состояние костной массы отражает показатель «минеральная плотность кости» (МПК). Низкая МПК в пожилом возрасте может быть следствием как недостаточного набора пика костной массы в юности, так и ускоренной ее потери в более поздние возрастные периоды.
В среднем пик костной массы (максимальные значения плотности кости) достигается к 25–30 годам, затем наступает период плато. Согласно данным Г.П. Котельникова и С.В. Булгаковой (2010), скорость костного обмена скелета в год составляет 8–10%. При этом скорость костного обмена кортикальной кости в семь раз меньше, чем трабекулярной (4 и 28% соответственно) [3]. С 35–40 лет начинается возрастная физиологическая потеря костной массы, которая у мужчин достигает 0,5–2% в год. На кортикальную костную ткань приходится 20%, на трабекулярную – до 30% [4].
Трабекулярная кость наиболее подвержена патологическим изменениям, поскольку метаболические процессы в ней происходят более активно [5]. Так, снижение МПК на единицу объема в трабекулярной кости начинается раньше, чем в кортикальной.
Существует предположение, что высокая скорость костного обмена губчатого слоя наряду с поддержанием механической прочности (достаточная толщина и плотность вертикальных и горизонтальных трабекул) обусловливают адекватную сопротивляемость стандартной нагрузке, играют важную роль в костном гомеостазе [6].
При ОП трабекулы губчатого вещества истончаются и перфорируются, нарушается интеграция костных структур вплоть до их исчезновения на отдельных участках. Свободные костные балки не несут функциональной нагрузки и подвергаются аутолизису.
Патогенез
Рарефикация костных структур, уменьшение костной массы, а также нарушение микроархитектоники кости – следствие изменения функции остеобластов (ОБ), остеоцитов (ОЦ) и снижения их ферментативной активности.
Дисбаланс процессов костного ремоделирования может выражаться повышенной активностью остеокластов (ОК) при нормальной функции ОБ (высокая скорость обмена), нормальной активностью ОК при сниженной функциональной активности ОБ (низкая скорость обмена), сниженной активностью ОК и ОБ. Чаще всего при ОП наблюдается повышение пула активных ОК, сопровождающееся интенсификацией костной резорбции и снижением костной массы [7, 8].
Кроме того, костная ткань является мишенью для системных половых гормонов, а также для их локального метаболизма и синтеза. Андрогены и эстрогены напрямую регулируют активность остеогенных клеток и опосредованно (через метаболизм гормона D) – ингибирование паратиреоидного гормона [5].
Рецепторы к эстрогенам выявлены как на ОБ, так и на ОК [9]. Результаты многих исследований подтверждают положительное влияние эстрогенов на дифференцировку, пролиферацию и функциональную активность ОБ. Эстрогены стимулируют синтез коллагеновых белков, способствуя повышению массы трабекулярной кости [10]. Эти стероиды ингибируют дифференцировку и активность ОК, вплоть до апоптоза [11, 12].
E.P. Paschalis и соавт. (2003) с помощью гистоморфометрии подтвердили положительный эффект эстрогенов на костный матрикс. А именно: увеличение процента минералов в трабекулярной структуре кости и количества поперечных связей коллагена. Продемонстрированы также достоверные признаки подавления резорбтивной активности с уменьшением количества остеокластических резорбтивных лакун [13].
Наличие андрогеновых рецепторов (AР) в различных клетках костной ткани (на ОБ, ОЦ и клетках-предшественниках) [14] предполагает наличие широкой андрогенной активности. Андрогены стимулируют пролиферацию и дифференцировку ОБ, способствуют минерализации кости посредством увеличения продукции этими клетками щелочной фосфатазы и коллагена [15]. Получены данные, что возможное опосредованное действие андрогенов связано с влиянием на синтез факторов роста (трансформирующего фактора роста и инсулиноподобного фактора роста 1), что также свидетельствует об активации функции ОБ [16].
Экспрессия АР на ОК человека не выявлена. Поэтому сделано предположение, что андрогены воздействуют на ОК опосредованно – через клетки остеобластического фенотипа [17]. В то же время в ряде исследований показано, что половые стероиды могут оказывать и прямой эффект, вызывая апоптоз ОК. Так, A.G. Ruetsche и соавт. (2005) продемонстрировали, что андрогены способствуют периостальному росту кости у мужчин [18]. Андрогены также снижают остеокластогенез через ингибирование продукции интерлейкина 6 стромальными клетками костного мозга, что препятствует созреванию и дифференцировке ОК [15].
В костной ткани андрогены могут быть конвертированы в эстрогены с помощью фермента ароматазы и оказывать на нее влияние как через АР, так и через рецепторы эстрогенов [15].
Лечение
Лечение ОП направлено:
- на предотвращение новых переломов;
- замедление или прекращение потери костной массы (в идеале – на ее прирост);
- нормализацию процессов костного ремоделирования;
- уменьшение болевого синдрома, расширение двигательной активности;
- улучшение качества жизни пациента.
Немедикаментозное лечение
Немедикаментозное лечение ОП включает образовательные программы, ходьбу и упражнения с нагрузкой весом тела, силовые, на тренировку равновесия (прыжки и бег противопоказаны), коррекцию питания (употребление продуктов, богатых кальцием (Ca)), отказ от курения и злоупотребления алкоголем, при высоком риске падений – мероприятия, направленные на его снижение (лечение сопутствующих заболеваний, коррекция зрения, изменение домашней обстановки, обучение правильному стереотипу движений, пользование тростью, ношение устойчивой обуви и т.д.).
К немедикаментозному лечению также относится прием препаратов кальция и витамина D. Указанные препараты используют для профилактики ОП и дополняют базовую терапию.
Кальций активно участвует в физиологических процессах, протекающих в костной ткани (минерализации, ремоделировании). Согласно клиническим рекомендациям адекватное потребление данного микроэлемента с пищей способствует поддержанию МПК, замедляет возрастзависимую потерю костной массы, усиливает антирезорбтивный эффект половых стероидов, следовательно, должно являться важной составной частью лечения и профилактики ОП [1, 5, 19]. В ходе скрининговой программы, проведенной в нескольких регионах России О.А. Никитинской и Н.В. Торопцовой (2012), установлено, что в обычном суточном рационе человека содержится недостаточно Са2+ – не более 600–800 мг [20]. Аналогичные данные получены в других европейских странах [21, 22]. При этом самый низкий уровень потребления микроэлемента с пищей зарегистрирован у мужчин и женщин старше 55 лет [23].
L.D. McCabe и соавт. (2004) показали, что применение добавок Са2+ лицами старше 60 лет снижает потерю костной массы в области бедренной кости [24]. Работа B.L. Riggs и соавт. (1998) продемонстрировала, что прием Са2+ в дозе 1600 мг в сутки в течение четырех лет уменьшает скорость потери костной массы в проксимальном отделе скелета [25]. F. Scopacasa и cоавт. (1998) установили, что назначение 1000 мг Са2+ в сутки способствует снижению уровня маркеров костной резорбции и может оказывать эффект на МПК при длительном использовании [26].
Необходимо отметить, что к настоящему времени проведено большое количество исследований по определению дозы кальция, вызывающей побочные эффекты: образование камней, кальцификацию сосудистой стенки. Данные последних системных обзоров свидетельствуют: дополнительное потребление Са2+ не вызывает образования камней в органах, а процесс кальцификации сосудистой стенки не зависит от уровня Са2+ в крови или его потребления, он является следствием пассивного отложения в местах активного воспаления. Такое протективное действие, по мнению авторов, обусловлено связыванием кальцием оксалатов и фосфатов в кишечнике, предотвращением избыточного их выведения с мочой, способствующего формированию камней [27].
Доказано, что монотерапия Са2+ менее эффективна в отношении предотвращения потери костной массы, чем комбинированная терапия с витамином D. Препараты витамина D способствуют лучшему усвоению солей кальция. При их отсутствии может быть абсорбировано не более 10% поступающего в организм макроэлемента [28].
Витамин D является жирорастворимым и накапливается в жировой ткани. Увеличение числа лиц с избыточной массой тела приводит к повышению распространенности дефицита витамина D, что объясняется его депонированием в подкожно-жировой клетчатке и недоступностью для центрального кровотока.
Кроме того, мировая тенденция к уменьшению времени пребывания на солнце и применению солнцезащитных кремов, а также низкая степень инсоляции в некоторых регионах проживания снижают синтез витамина D в коже на 95–98%.
Медикаментозное лечение
Многие рекомендованные ранее при ОП лекарственные средства ограничены в применении (стронция ранелат) или сняты с производства (препараты кальцитонина) в связи с несоответствием современным критериям безопасности.
В настоящее время золотым стандартом медикаментозного лечения ОП считаются бисфосфонаты.
Бисфосфонаты разработаны в начале XIX в., однако только в 1960 г. было проведено первое исследование их влияния на метаболизм костной ткани, с 1990 г. они включены в схемы лечения ОП [29].
Механизм действия бисфосфонатов заключается в физико-химическом связывании с гидроксиапатитом на резорбтивной поверхности; накапливании вокруг ОК и создании высокой концентрации в лакунах резорбции. Поглощение ОК бисфосфонатов приводит к подавлению мевалонового пути биосинтеза холестерина. При этом нарушается формирование цитоскелета и гофрированной каемки и подавляется адгезия к костному матриксу и снижается секреция лизосомальных ферментов. Как следствие, ингибирование миграции ОК, нарушение метаболизма, функциональной активности, уменьшение хемотаксиса к местам резорбции и индукция их апоптоза [30–33].
Таким образом, основной фармакологический эффект этой группы лекарственных средств заключается в снижении скорости костного ремоделирования с угнетением фазы резорбции [34, 35].
Среди анаболических эффектов бисфосфонатов выделяют способность увеличивать выживаемость ОЦ и ОБ за счет блокады их апоптоза, повышать синтез ОБ коллагена типа 1. Это сопровождается положительными изменениями микроархитектоники кости и увеличением минерального компонента. Как следствие, утолщаются костные трабекулы и предупреждается потеря костной массы [36, 37].
Э.В. Руденко и соавт. (2011) показали, что в костной ткани депонируется 20–50% поступившего в организм препарата [28].
Бисфосфонаты обладают протективным действием в отношении сосудистой стенки: подавляют захват липопротеинов низкой плотности, участвующих в развитии атеросклероза [7].
Возможностям использования бисфосфонатов при ОП было посвящено большое количество крупных рандомизированных клинических исследований. Установлено, что на фоне их применения значительное повышение МПК наблюдается уже через три месяца в области тел позвонков и через год в области бедренной кости [34]. В исследованиях D.M. Black и соавт. (2006–2007) лечение бисфосфонатами в течение трех – пяти лет ассоциировалось с достоверным увеличением МПК и снижением переломов позвоночника на 70%. Напротив, прекращение терапии приводило в следующие пять лет к росту маркеров костного обмена [35].
На сегодняшний день азотсодержащие бисфосфонаты (алендронат, ибандронат) признаны одними из самых эффективных препаратов при ОП как у женщин, так и у мужчин [34]. Присутствие атома азота в боковой цепи препаратов определяет их способность ингибировать модификацию белков в ОК, что приводит к специфическим изменениям и апоптозу последних. Кроме того, преостеокласты под действием азотсодержащих ибандронатов теряют способность к дифференцировке и созреванию, вследствие чего популяция ОК уменьшается.
Антирезорбтивная активность отдельных препаратов указанной группы существенно различается, что связано с особенностями их химической структуры и отражает уровни эффективных фармакологических и терапевтических доз [7, 38]. В соответствии с возрастанием антирезорбтивного потенциала относительная активность алендроната составляет 100–1000, ибандроната – 1000–10 000.
Мониторирование эффективности лечения
Оценка эффективности лечения проводится с помощью двухэнергетической рентгеновской абсорбциометрии через один – три года после начала терапии, но не чаще одного раза в год (рекомендуется использовать аппарат одного и того же производителя). Периферическая двухэнергетическая рентгеновская абсорбциометрия не должна использоваться для мониторирования.
Кроме того, анализируются маркеры костной резорбции.
Лечение признается эффективным, если МПК увеличилась или осталась на исходном уровне. Продолжающаяся потеря МПК по результатам двухэнергетической рентгеновской абсорбциометрии или новый перелом могут свидетельствовать о низкой приверженности пациента лечению.
Бонвива
Бонвива (ибандронат) относится к азотсодержащим бисфосфонатам третьего поколения. Препарат принимается перорально в дозе 150 мг один раз в месяц. После всасывания 40–50% дозы препарата, находящегося в системной циркуляции, связывается с костной тканью и накапливается в ней, что соответствует концепции о высоком сродстве препарата с гидроксиапатитом кости. После связывания высвобождение препарата происходит крайне медленно.
Необходимо отметить, что при приеме Бонвивы за час до еды значимого снижения биодоступности не наблюдается.
Как и другие бисфосфонаты, Бонвива не метаболизируется в организме и в неизмененном виде экскретируется с мочой. Клиренс ибандроната зависит от функции почек. Часть препарата, связавшаяся с костной тканью, не элиминируется из организма до тех пор, пока в участке кости не завершится процесс ремоделирования. Период полувыведения Бонвивы из костей – около года.
Клиническая эффективность ибандроната подтверждена данными ряда многоцентровых исследований, изучавших его влияние на МПК и качество кости, риск развития новых переломов, переносимость. Всего в них приняло участие 13 000 пациентов.
Через год ежемесячного приема Бонвивы в дозе 150 мг МПК в поясничном отделе позвоночника достоверно повысилась на 4,3%, через два года – на 6,6%. Достоверное увеличение МПК в общем показателе бедра, шейке бедра и области большого вертела отмечено через год терапии. Достигнутые значения сохранялись и в течение второго года лечения. Так, в среднем МПК относительно исходного уровня через два года в области шейки бедра увеличилась на 3,1%, большого вертела – на 6,2%, в общем показателе бедра – на 4,2%. Снижение уровня маркеров костного обмена зафиксировано уже через три месяца лечения и продолжалось в течение всего периода наблюдения.
Результаты многоцентрового рандомизированного двойного слепого исследования MOBILE показали, что МПК в поясничном отделе позвоночника у пациенток с постменопаузальным ОП при введении ибандроната один раз в месяц повышается так же эффективно, как и при ежедневном приеме препарата в дозе 2,5 мг [39].
Прием 150 мг Бонвивы один раз в месяц сопровождается самым большим и прогрессивным увеличением МПК во всех точках обследования проксимального отдела бедренной кости (через два года p < 0,05). При этом снижение маркеров костного обмена отмечалось уже через три месяца лечения и продолжалось в течение всего периода наблюдения. Через два года уровень маркера костной резорбции С-телопептида коллагена типа 1 в сыворотке крови уменьшился на 56,1–61,5%.
Через три года терапии ибандронатом прирост МПК в шейке бедра составил 3,5%, в большом вертеле – 6,2%, в общем показателе бедра – 4,1%, в поясничном отделе позвоночника – 7,6%.
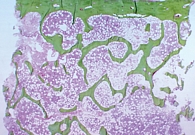
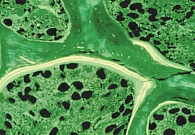
В рамках исследования BONE для оценки влияния ибандроната на качество и микроархитектонику костной ткани проводился гистологический и гистоморфометрический анализ костных биоптатов [40]. Пероральный прием Бонвивы ассоциировался с формированием новой кости без признаков нарушения минерализации костного матрикса (рис. 1). При этом отмечалось улучшение ее микроархитектоники (рис. 2).
Результаты многочисленных исследований доказали, что прием аминобисфосфонатов повышает МПК в поясничном отделе позвоночника и проксимальном отделе бедренной кости и снижает частоту переломов на 40−70% [38, 41]. Повышение МПК, сокращение потерь костной массы в значительной степени связаны с увеличением минерального компонента кости, что способствует утолщению трабекул [37, 42].
Необходимо отметить, что эффективность терапии любого хронического заболевания во многом обусловлена приверженностью пациента лечению. Результаты многоцентрового исследования BALTO по сравнительной оценке приверженности пациентов лечению показали, что 66,1% пациенток с постменопаузальным ОП предпочитали ежемесячный прием препарата Бонвива в дозе 150 мг еженедельному приему алендроната в дозе 70 мг [43].
Результаты проведенных исследований показали, что относительно большая доза Бонвивы не оказывала существенного влияния на переносимость терапии. Кроме того, прием Бонвивы не ассоциировался с повышением риска развития побочных эффектов со стороны верхних отделов желудочно-кишечного тракта [44].
В литературе описаны случаи остеонекроза челюсти у пациентов, получавших бисфосфонаты. Их частота составляет 6,5–12,5% [45–47]. Остеонекроз челюсти – состояние, характеризующееся обнажением кости нижней и/или верхней челюсти и сохраняющееся как минимум восемь недель, при отсутствии предшествующего облучения или метастазов в челюсть [48]. При этом только 4% всех случаев остеонекроза челюсти зафиксированы у пациентов с ОП [7]. Данное осложнение чаще отмечалось при внутривенном введении препаратов пролонгированного действия (памидронат, золедроновая кислота), чем при пероральном применении [47, 49].
Патогенез остеонекроза челюсти до конца не изучен. Одни авторы связывают его развитие с дисбалансом процессов костного ремоделирования, повышенным образованием провоспалительных цитокинов, наличием патогенной микрофлоры в полости рта [46, 47]. Другие авторы считают, что при длительном применении бисфосфонаты блокируют функцию ОБ посредством ингибирования активности ОК [50].
Причинно-следственная связь между некротическими изменениями челюсти и лечением ОП бисфосфонатами не установлена [48, 51].
Одним из преимуществ аминобисфосфонатов является минимальный риск развития некроза челюсти [34].
Сказанное выше позволяет сделать вывод: Бонвива является эффективным препаратом для терапии ОП. Длительное его применение способствует приросту МПК в поясничном отделе позвоночника и проксимальном отделе бедренной кости, а также снижению риска переломов.
A.M. Mkrtumyan, M.V. Kozlova, A.S. Belyakova
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
Here we discuss pathogenesis of osteoporosis as well as medicated and non-medicated methods for its treatment, and ways for assessing therapeutic efficacy. We present the results of clinical studies on efficacy and tolerability of the third-generation nitrogen-containing bisphosphonate Bonviva during osteoporosis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.