Эффективность применения суппозиториев Генферон в комплексной терапии нарушений репродуктивной функции у женщин
- Аннотация
- Статья
- Ссылки

Известно, что нарушения репродуктивной функции у женщин существуют в виде двух клинических форм: бесплодие и невынашивание беременности, которые фактически являются различными степенями тяжести расстройства репродуктивного здоровья, имеющими одинаковые причины (3).
Из всех известных причин, приводящих к утрате репродуктивной функции у женщин, наибольшее практическое значение имеют генитальные инфекции (ГИ), объединенные в группу заболеваний, передаваемых половым путем (ЗППП). Они приводят к нарушениям детородной функции как самостоятельно, так и опосредованно, формируя трубно-перитонеальные факторы бесплодия (3, 5). Наиболее частыми возбудителями ГИ являются уреаплазмы, микоплазмы, хламидии, гарднереллы, вирусы простого герпеса и папилломы. При бесплодии и невынашивании беременности высока доля микстных форм генитальных инфекций (1, 4).
Эндокринные причины утраты репродуктивной функции у женщин фертильного возраста можно рассматривать в виде двух клинических форм, различающихся по степени тяжести. Наиболее тяжелым вариантом дисфункции репродуктивной системы является синдром хронической ановуляции (СХА). Менее тяжелым клиническим вариантом инфертильности считают лютеиновую недостаточность (ЛН), которая сопровождается как бесплодием, так и невынашиванием беременности в первом триместре гестации (5).
Нередко инфекционные и эндокринные причины нарушений репродуктивной функции у женщин носят сочетанный характер (6). При эндокринных причинах этих нарушений у женщин возникают реальные предпосылки для присоединения ГИ, которые дополнительно усугубляют состояние репродуктивного здоровья (8).
Современная терапия нарушений репродуктивной функции у женщин строится на принципах дифференцированного подхода с учетом выявленных причин. Процесс реабилитации репродуктивной функции можно разделить на несколько стадий. Первый этап лечения – устранение причины, вызвавшей нарушение репродуктивного здоровья (элиминация возбудителей ГИ из родового канала, восстановление овуляции или функции желтого тела). На втором этапе выполняется подготовка к планируемой беременности. Третий этап – проведение «рабочих» циклов, обеспечивающих зачатие и полноценную гестацию.
На первых двух этапах реабилитации репродуктивной функции традиционно применяют антимикробные препараты, индукторы овуляции, половые стероиды, антикоагулянты, витамины, что в конечном итоге, обеспечивает терапевтический эффект.
До настоящего времени не нашло своего обоснования применение препаратов для иммунокоррекции, в том числе и препаратов интерферона в комплексной терапии нарушений репродуктивной функции у женщин. И если сведения о целесообразности применения стимуляторов как клеточного, так и гуморального иммунитета при лечении ЗППП представлены в доступной литературе, то информация по вопросам применения препаратов интерферона при подготовке к беременности немногочисленна и противоречива.
Интерфероны (ИНФ), в зависимости от источника продукции, подразделяются на 1-ый тип – неиммунный (α-ИНФ и β-ИНФ) и 2-ой тип – иммунный (γ- ИНФ).
В основе полноценной функции репродуктивной системы лежит адекватное сочетание продукции и концентрации различных типов интерферонов в крови и межклеточной жидкости органов репродуктивной системы (2, 5).
Для хронических ГИ характерно состояние дефицита интерферонов по всем известным типам. Выявленные закономерности делают теоретически обоснованным применение препаратов интерферона в комплексной терапии нарушений репродуктивной функции, обусловленных ЗППП у женщин, как на этапе лечения ГИ, так и при подготовке к беременности.
В настоящее время среди препаратов, обладающих интерфероновой активностью, хорошо зарекомендовал себя Генферон® («Биокад», Россия), который соответствует Международным стандартам качества (GMP). В состав суппозиториев Генферон® входят активные вещества: интерферон человеческий рекомбинантный альфа-2 в дозировке 250000 МЕ, 500000 МЕ и 1000000 МЕ; таурин – 0,01 г. и анестезин – 0,055 г. (4).
Мы поставили перед собой задачу выяснить целесообразность включения в протокол комплексной терапии репродуктивных нарушений у женщин препарата Генферон® на различных этапах реабилитации репродуктивной функции.
Материалы и методы
Под наблюдением находились 82 женщины, которых разделили на две клинические группы.
Первую группу составили 40 пациенток, обратившихся за медицинской помощью по причине бесплодия (15 наблюдений) и невынашивания беременности (25 наблюдений). Средний возраст пациенток в группе составил 24,3±2,9 года.
Во вторую клиническую группу были объединены 42 женщины, которые нуждались в реабилитации репродуктивной функции по поводу бесплодия (25 наблюдений) и невынашивания беременности (17 наблюдений). Средний возраст женщин 2-ой клинической группы был равен 25,1±1,3 года.
С целью выявления причин нарушения детородной функции, женщин обеих клинических групп подвергли предварительному обследованию, которое включало в себя анализ анамнестических сведений о длительности заболевания, становлении специфических функций женского организма, предшествовавших беременностях и их исходах. Кроме традиционных методов (осмотр, антропометрия, бимануальное исследование, мазки на флору и атипичные клетки), применялась пельвиосонография, рентгеногистеросальпингография, диагностическая лапаро- и гистероскопия.
Выявление ЗППП проводили с помощью полимеразной цепной реакции (ПЦР) в отделяемом из цервикального канала и посевов на отдельные виды микроорганизмов при наличии показаний.
Оценку менструального цикла выполняли, исследуя в одном менструальном цикле базальную температуру, а также путем определения показателей функции щитовидной железы (тиреотропный гормон гипофиза, свободный тироксин), уровня гипофизарных гонадотропинов (фоллитропин, лютеотропин, пролактин), половых стероидов в сыворотке крови радиоиммунным методом (эстрадиол, прогестерон, тестостерон). Помимо этого определялась морфологическая характеристика биоптатов эндометрия, полученных методом аспирационной биопсии, накануне предполагаемой менструации. При наличии показаний были выполнены лекарственные пробы с дексаметазоном и хориогонином, синактеном.
Лечение выявленных нарушений было выполнено в три этапа. На первом этапе проводили санацию родового канала при обнаружении ГИ, используя комплексную терапию в течение 14-и дней. В протокол лечения были включены антимикробные препараты, стимуляторы клеточного иммунитета, антимикотические средства, дезагреганты, ферменты, витамины. Лечение проводили параллельно у женщин и их половых партнеров. Контроль после лечения осуществляли методом ПЦР.
Коррекция выявленных нарушений менструального цикла проводилась с помощью антиэстрогенов центрального действия, эстрогенов, гестагенов, глюкокортикоидов. При наличии показаний выполнялась лапароскопическая каутеризация яичников.
На втором этапе была осуществлена подготовка эндометрия препаратами для цикловой гормонотерапии в сочетании с витаминами и антикоагулянтами. Контроль за эффективностью подготовки проводился с помощью УЗ-мониторинга в течение менструального цикла. В качестве критерия адекватного состояния эндометрия выступала достаточная ширина М-эха.
На третьем этапе лечения проводились «рабочие» циклы с коррекцией выявленных нарушений регуляции менструального цикла в сочетании с витаминами и энзимотерапией.
Отличительной особенностью между клиническими группами было включение в протокол терапии женщин первой клинической группы суппозиториев Генферон® на первом и втором этапах лечения. Препарат назначали интравагинально по 500000 ЕД два раза в сутки, в течение 10 дней.
Результаты
При обследовании женщин первой клинической группы было установлено, что среди причин утраты репродуктивной функции было бесплодие в 15 клинических наблюдениях (первичное бесплодие – 10, вторичное – 5). При этом СХА как причина бесплодия был зарегистрирован у 8 женщин, а ЛН у 7 пациенток. Среди причин эндокринного бесплодия был обнаружен адреногенитальный синдром (5 наблюдений), болезнь поликистозных яичников (7 наблюдений), гиперпролактинемия (1 наблюдение), гипотиреоз на фоне аутоиммунного тиреоидита (2 наблюдения). Сочетание нарушений регуляции менструального цикла и ГИ было обнаружено у 12 женщин. Таким образом, у большинства пациенток первой клинической группы с эндокринным бесплодием в цервикальном канале были обнаружены возбудители ЗППП. Для женщин с выявленными ГИ была характерна морфологическая характеристика метроаспиратов, в которых кроме дисгормональных нарушений (уменьшение количества, объема, кровенаполнения спиралевидных артерий; уплотнение стромы, отсутствие децидуоподобной трансформации; незавершенная секреторная перестройка желез), были обнаружены признаки хронического эндометрита (мононуклеарная очаговая инфильтрация, склерозирование отдельных участков стромы, наличие «пестрой», перемежающейся картины в структуре соединительной ткани функционального слоя эндометрия).
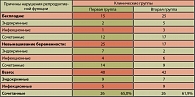
У 25 женщин с невынашиванием беременности, обследованных в первой клинической группе (наличие в анамнезе от трех до пяти самопроизвольных выкидышей при беременности малого срока) эндокринные причины невынашивания беременности, обусловленные ЛН, были зарегистрированы в 21 наблюдении, а ГИ были выявлены у 18 пациенток. Сочетание нарушений регуляции менструального цикла и ГИ у женщин первой клинической группы, страдавших невынашиванием беременности, было обнаружено в 14 случаях из 25. Проведенными исследованиями было установлено, что в первой клинической группе сочетание эндокринных причин нарушения репродуктивной функции с ЗППП имело место у 26 женщин и составило 65,0% общей численности клинической группы. Причины нарушения репродуктивной функции в клинических группах представлены в таблице 1.
Среди пациенток второй клинической группы (42 наблюдения), бесплодие как причина нарушения репродуктивной функции было обнаружено в 25 клинических наблюдениях. При этом СХА был зарегистрирован у 10 женщин, а ЛН была выявлена в 15 клинических наблюдениях. Первичным бесплодием страдали 17 женщин, вторичное бесплодие имело место у 8 пациенток. Причины эндокринного бесплодия у женщин второй клинической группы были аналогичными первой группе. Так, адреногенитальный синдром обнаружили у 9 больных, болезнь поликистозных яичников у 11, синдром гиперпролактинемии у 2, гипотиреоз на фоне аутоиммунного тиреоидита у 3 женщин.
Следует отметить, что только эндокринные причины бесплодия были обнаружены у 5 пациенток второй клинической группы, а в 17 наблюдениях нарушения регуляции менструального цикла при бесплодии сочетались с ГИ.
Невынашивание беременности у женщин второй клинической группы было зарегистрировано несколько реже, чем бесплодие и было обнаружено у 17 пациенток. Среди больных второй клинической группы исключительно эндокринные причины приводили к привычной потере беременности у двух женщин, только инфекционные причины спонтанного прерывания беременности наблюдались у 6 человек, а основную массу (9 наблюдений) составили женщины с сочетанием эндокринных причин и ГИ.
Таким образом, среди женщин второй клинической группы, наибольшая часть больных (26 человек, 61,9%) имели сочетание эндокринных и инфекционных причин нарушения репродуктивной функции.
Возбудители ЗППП, обнаруженные у женщин клинических групп при сочетании ГИ и эндокринных причин нарушения репродуктивной функции, представлены в таблице 2.
Согласно результатам проведенного исследования, в большинстве случаев (17 из 26 и 15 из 26) ГИ носили сочетанный, микстный характер. При этом количество одновременно идентифицированных возбудителей ЗППП варьировало от двух до пяти. Выявление моноинфекций было отмечено в единичных случаях.
Таким образом, на этапе предварительного обследования в обеих клинических группах были получены одинаковые результаты по частоте причин нарушения репродуктивной функции, основную массу которых составили сочетания эндокринных нарушений регуляции менструального цикла и ГИ (65,0% и 61,9% для первой и второй клинических групп соответственно). Среди возбудителей ЗППП преобладали микстные варианты.
После проведения поэтапной терапии, согласно протоколу реабилитации репродуктивной функции в клинических группах было установлено, что элиминацию возбудителей ЗППП в первой клинической группе удалось получить после первого курса проведенной терапии. Во второй клинической группе у 9,5% пациенток, прошедших курс лечения ГИ, в контроле вновь были обнаружены возбудители ЗППП, что потребовало проведения дополнительного лечения.
На втором этапе реабилитационных мероприятий у пациенток первой группы подготовка эндометрия занимала не более трех менструальных циклов, в то время как во второй группе для достижения нормативных показателей М-эха требовалось от четырех до восьми менструальных циклов.
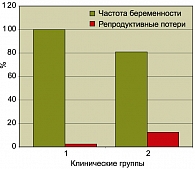
Среди пациенток первой клинической группы беременность наступила во всех случаях, а репродуктивные потери составили 2,5%. Во 2-ой клинической группе беременность удалось получить у 80,9% женщин, а репродуктивные потери при этом составили 12,5%. Полученные результаты иллюстрирует рисунок 1.
Выводы
Суппозитории Генферон® эффективно дополняют терапию реабилитации репродуктивной функции у женщин с сочетанием эндокринных и инфекционных причин инфертильности.
Интравагинальное применение препарата Генферон® на первом этапе реабилитации репродуктивной функции у женщин с сочетанными причинами нарушения репродуктивного здоровья ускоряет элиминацию возбудителей ЗППП из родового канала.
Дополнение протокола подготовки к беременности препаратом Генферон® у женщин с сочетанными причинами нарушения репродуктивной функции сокращает продолжительность подготовительной терапии.
Назначение препарата Генферон® в комплексе реабилитационных мероприятий при нарушениях репродуктивной функции, обусловленных сочетанием эндокринных и инфекционных факторов, приводит к эффективному восстановлению репродуктивного здоровья и сокращению репродуктивных потерь при устранении инфертильности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.