Этиопатогенетическое лечение гриппа у детей младшего возраста
- Аннотация
- Статья
- Ссылки
- English

Введение
Несмотря на достижения современной медицины, острые респираторные инфекции (ОРИ) остаются серьезной проблемой здравоохранения всех стран мира. Это обусловлено высокой распространенностью ОРИ верхних отделов дыхательного тракта, на долю которых приходится до 90% всех инфекционных заболеваний. Повышенная заболеваемость наблюдается среди детей от двух до пяти лет жизни, что, как правило, связано с посещением детских учреждений, значительным увеличением числа контактов. Ребенок, посещающий детский сад, в течение первого года может болеть острыми респираторными вирусными инфекциями (ОРВИ) до 10–15 раз, второго года – пять – семь раз, в дальнейшем – от трех до пяти раз в год. Снижение заболеваемости обусловлено приобретением специфического иммунитета после перенесенных ОРВИ.
Столь высокая заболеваемость ОРВИ в детском возрасте делает эту проблему одной из наиболее актуальных в педиатрии. Повторные заболевания существенно влияют на развитие ребенка и приводят к ослаблению защитных сил организма, способствуют формированию хронических очагов инфекции, вызывают аллергизацию, препятствуют проведению профилактических прививок, отягощают преморбидный фон и задерживают физическое и психомоторное развитие. Во многих случаях частые ОРВИ патогенетически связаны с астматическим бронхитом, бронхиальной астмой, хроническим пиелонефритом, полиартритом, хроническими заболеваниями носоглотки и многими другими заболеваниями.
Стабильно высокая заболеваемость респираторными инфекциями обусловлена прежде всего многообразием инфекционных агентов. Известно свыше 200 возбудителей респираторных инфекций, среди которых лидирующие позиции занимают вирусы – более 90% всех случаев заболеваний. С большим количеством возбудителей связано отсутствие средств специфической профилактики и этиотропной терапии, реализация которых осложняется высокой изменчивостью вирусов, а также способностью некоторых из них к латентному персистированию и формированию устойчивости к лекарственным средствам.
К наиболее распространенным возбудителям ОРВИ относятся вирусы гриппа и парагриппа, респираторно-синцитиальный вирус, адено-, рино-, корона-, бока- и энтеровирусы. Перечисленными агентами, разумеется, не исчерпывается весь спектр возбудителей респираторных заболеваний. Между тем доля в этиологической структуре ОРВИ каждого из них зависит от региона, сезона, возраста и др. В разных регионах в зависимости от эпидемиологической обстановки помимо вирусов гриппа могут доминировать риновирусы, аденовирусы.
Вирусы гриппа относятся к ортомиксовирусам. Внутренняя часть вируса состоит из полимеразного комплекса, рибонуклеопротеида и матриксного протеина. Снаружи вирус, имеющий сферическую форму, покрыт оболочкой, на которой представлены два вида поверхностных антигенов – гемагглютинин и нейраминидаза. За счет этих образований происходит прикрепление и внедрение вируса внутрь клетки хозяина. Для поверхностных антигенов характерна изменчивость, с чем связано появление новых штаммов вирусов гриппа.
Вирусы гриппа поражают обширные области эпителия слизистой оболочки носа, глотки и трахеи, адсорбируясь на поверхности клеток с помощью соответствующих рецепторов. Они присоединяются к молекулам внутриклеточной адгезии – рецепторам, постоянно экспрессированным на клетках респираторного эпителия. Вирусы имеют разные рецепторы и соответственно могут адсорбироваться только на определенных клетках респираторного тракта, чем обусловлена область поражения. В процессе репродукции вирусов клетки мерцательного респираторного эпителия (где происходит репродукция вирусов) разрушаются и удаляются вместе с продуктами взаимодействия вирусов и клеток и вновь образовавшимися патогенами, находящимися в слизистом секрете. Областью поражения определяется клиническая картина ОРВИ. Среди наиболее частых проявлений – острые ринит и фарингит. Их выраженность зависит в том числе от вида возбудителя.
Как известно, грипп проявляется двумя основными клиническими симптомами – интоксикацией и поражением дыхательных путей. В тяжелых случаях грипп протекает с выраженным нейротоксикозом, менингоэнцефалическим и геморрагическим синдромами, которые могут приводить к летальному исходу.
Гриппу свойственно острое начало заболевания, повышение температуры тела до фебрильной (38–40 оС). На этом фоне возможно развитие судорожного синдрома. Больные предъявляют жалобы на сильную головную боль, озноб, ломоту в мышцах, боль в суставах и глазных яблоках. Симптомы поражения носоглотки при гриппе в отличие от интоксикации и лихорадочной реакции в первые часы обычно выражены нерезко. Респираторный синдром проявляется сухостью слизистых оболочек, першением, саднением в горле, заложенностью носа со скудным слизисто-серозным отделяемым и сухим кашлем. Постепенно кашель усиливается, становясь навязчивым, иногда (у детей старшего возраста) грубым трахеитным, с болью за грудиной. Примерно у трети больных гриппом слизисто-серозное отделяемое из носовых ходов и сухой кашель появляются на третий-четвертый день болезни. Еще в трети случаев названные симптомы беспокоят больных с первых дней заболевания. Иногда они отсутствуют в течение всей болезни. В ряде случаев имеет место диарея с нечастым жидким или разжиженным стулом без патологических примесей, сопровождаемая болями в животе. Под влиянием вирусных токсинов происходит поражение сосудов – повышается их проницаемость, что клинически проявляется развитием геморрагического синдрома с носовыми кровотечениями, геморрагиями на слизистых оболочках и коже, гематурией, геморрагическим отеком легких.
При неосложненном течении гриппа лихорадочный период длится от двух до пяти дней. Более длительная лихорадка может свидетельствовать о развитии осложнений, как специфических, связанных с действием самого вируса, так и обусловленных присоединением бактериальной флоры, чаще стрептококковой или стафилококковой.
У детей клиническая картина гриппа аналогична таковой у взрослых, но имеются некоторые возрастные особенности. У детей чаще наблюдается лихорадка с фебрильными судорогами. В ранние сроки болезни появляются миалгии, беспокоят боли в ногах и спине. У половины больных детей в возрасте до четырех лет наблюдается выраженная сонливость. В период реконвалесценции (не очень частое осложнение) не исключено развитие миозита, сопровождающегося миоглобинурией с нарушением функции почек или без него. Миозит обычно возникает при гриппе B, длится от одного до пяти дней.
Грипп у новорожденных и детей первого года жизни обычно начинается постепенно, с незначительного подъема температуры тела, симптомы гриппозной интоксикации отсутствуют или неярко выражены. Новорожденные отказываются от груди, у них снижается масса тела. Могут иметь место слабо выраженные катаральные явления в виде кашля, заложенности носа, сопения, часто наблюдается повторная рвота. Синдром крупа у детей первого полугодия жизни развивается редко. Сегментарное поражение легких нехарактерно. Несмотря на слабо выраженные начальные клинические проявления, течение гриппа у детей первого года жизни значительно тяжелее из-за частого присоединения бактериальной инфекции и возникновения гнойных осложнений (отит, пневмония и др.). Летальность в три раза выше, чем у детей старшего возраста.
У детей в возрасте от года до трех лет грипп протекает особенно тяжело – с выраженной интоксикацией, поражением центральной нервной системы, развитием менингоэнцефалического синдрома. Катаральные явления выражены слабо. Нередко наблюдаются сегментарное поражение легких, синдром крупа и астматический синдром. Из осложнений возможны гнойный отит, синусит, очаговая пневмония.
Для детей характерно также более продолжительное выделение вируса – в течение 10–14 дней (у взрослых обычно четыре – шесть дней).
Сегодня даже при наличии современных методов лабораторной диагностики удается определить лишь около 70% возбудителей острых заболеваний респираторного тракта. Польза от выявления конкретного возбудителя ОРВИ для рутинной клинической практики, за исключением вируса гриппа, незначительна. Данная процедура, во-первых, требует времени, а назначать лечение необходимо с первых проявлений заболевания, во-вторых, мало что меняет в лечебных подходах из-за недостаточности средств этиотропной терапии ОРИ вирусной этиологии. На практике дифференциальная диагностика проводится с учетом клинической картины заболевания. Ее особенности, характерные для тех или иных вирусов, позволяют предположить потенциального возбудителя.
В настоящее время для лечения ОРВИ доступен широкий спектр лекарственных препаратов патогенетической направленности, активирующих иммунный ответ, обеспечивающих устранение симптомов заболевания, оказывающих общеукрепляющее действие. При этом арсенал специфических средств с прямой противовирусной активностью крайне мал, особенно для детей раннего возраста, и ограничен препаратами, предназначенными только для лечения гриппа.
Несмотря на то что в составе вириона и жизненном цикле вируса гриппа присутствует много уникальных компонентов и стадий, способных служить мишенями для лекарственного вмешательства, лишь два из них используются в клинической практике. Признанными во всем мире противогриппозными препаратами являются химические соединения двух групп – производные адамантана (амантадин и его аналог в России – римантадин) [1], активные в отношении вирусов гриппа А, и ингибиторы вирусной нейраминидазы – осельтамивир (Тамифлю®) и занамивир (Реленза®) [2]. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) разрешены к использованию еще два ингибитора нейраминидазы – перамивир (Рапиваб®) внутривенно [3] и ланинамивир (Инавир®) ингаляционно [4]. В России ни перамивир, ни ланинавир не сертифицированы. Известно, что нейраминидазные ингибиторы приводят к многочисленным побочным эффектам, таким как аллергические реакции, осложнения со стороны желудочно-кишечного тракта, тошнота [5], а также неврологическим расстройствам [6]. К тому же они имеют высокую стоимость, что ограничивает их применение в большинстве стран мира.
В целом современные фармацевтические препараты, удовлетворяющие требованиям доказательной медицины, оптимизированы для селективного взаимодействия с определенной мишенью. Однако для противовирусных соединений точная подгонка под определенную мишень приводит к быстрому появлению резистентных штаммов при недостаточной консервативности выбранного рецептора. Так, устойчивость к адамантановым препаратам достигает 90–100% [7]. Процент Тамифлю-устойчивых штаммов еще недавно был невысок. Но с ноября 2007 по март 2009 г. этот показатель среди вирусов подтипа H1N1 возрос до 100% [8]. И если бы эти вирусы не были вытеснены пандемическими штаммами A(H1N1)pdm09, чувствительными к осельтамивиру, это существенно осложнило бы ситуацию со средствами химиотерапии гриппа.
В 2010 г. были опубликованы данные о новом эффективном препарате нуклеозин, направленном против белка NP вируса гриппа [9]. Несмотря на активность этого соединения в отношении вирусов гриппа подтипов H1N1 и H3N2 в культуре клеток и на животных моделях, пандемические штаммы, появившиеся в 2009 г., также продемонстрировали устойчивость к нему [10].
В тяжелых случаях гриппа в клинической практике применяется рибавирин, эффективный не только против гриппа, но и других РНК-геномных вирусов. Однако из-за высокой токсичности его рекомендуют лишь в далеко зашедших стадиях инфекции, что ограничивает его применение как средства широкомасштабной борьбы с эпидемиями и пандемиями гриппа.
Целью настоящего исследования стала оценка эффективности и резистентности к штаммам вируса гриппа А, а также противогриппозной активности препарата Орвирем® в эксперименте как в виде комплексного препарата, так и в виде составляющих – римантадина и альгината натрия.
Материал и методы исследования
Исследования проводили на следующих вирусах:
- вирус гриппа A/Puerto Rico/8/34 (H1N1);
- вирус гриппа A/California/07/09 (H1N1)pdm09;
- вирус гриппа A/Aichi/2/68 (H3N2);
- вирус гриппа A/mallard/Pennsylvania/10218/84 (H5N2).
Для определения прямой противовирусной активности соединений из исследуемых препаратов готовили серию последовательных разведений от 300 до 3 мкг/мл на среде для культивирования клеток и вносили в культуру клеток за час до инфицирования их вирусами. Культивирование вирусов проводили при температуре 37 °С в атмосфере 5% CO2 в течение 48 часов. По окончании срока инкубации культуральную жидкость переносили в лунки планшета для иммунологических реакций, после чего добавляли равный объем 1% куриных эритроцитов в физиологическом растворе.
Уровень репродукции вируса в лунках панели оценивали по реакции гемагглютинации эритроцитов. За титр вируса принимали величину, обратную наибольшему разведению вируса, способному вызвать положительную реакцию гемагглютинации, и выражали в количестве 50% инфекционных доз вируса в 0,2 мл (lg ИД50/0,2 мл).
Для оценки токсичности в опытах на клеточной культуре из исследуемых соединений готовили серию двукратных разведений в концентрации от 300 до 3 мкг/мл на поддерживающей среде Игла МЕМ. Разведения препаратов вносили в лунки планшетов. Клетки инкубировали в течение 48 часов при температуре 37 ºС в CO2 инкубаторе в атмосфере 5% CO2. Затем проводили микротетразолиевый (МТТ) тест на 96-луночных планшетах. Клетки промывали два раза физиологическим раствором (0,9% NaCl) и добавляли по 100 мкл в лунку раствор МТТ (3-(4,5-диметилтиазол-2)-2,5 дифенил тетразолий бромид), в концентрации 0,5 мкг/мл в физиологическом растворе. Планшеты инкубировали в течение часа при температуре 37 ºС, после чего жидкость удаляли и добавляли в лунки по 0,1 мл диметилсульфоксида. Оптическую плотность ячеек измеряли на спектрофотометре Victor 2 1440 при длине волны 535 нм. На основании полученных данных рассчитывали CTD50, то есть концентрацию препарата, разрушающую 50% клеток в культуре.
На основании полученных данных для каждого вируса рассчитывали индекс селективности (SI), представляющий отношение CTD50 к EC50.
Опыты in vivo проводили на белых беспородных мышах из питомника Рапполово (Ленинградская область). Изучаемые вирусы вводили интраназально под эфирным наркозом в объеме 50 мкл на одну особь. Препараты вводили перорально при помощи желудочного зонда в объеме 200 мкл. Противовирусную активность соединений учитывали по снижению смертности мышей в опытных образцах (вирус + препарат) по сравнению с контролем (вирус + плацебо).
Наблюдение за животными осуществляли 14 дней – срок, в течение которого при экспериментальном гриппе отмечается смертность животных. Ежедневно фиксировали смертность животных в контрольных и опытных группах.
На основании полученных показателей смертности в каждой группе рассчитывали процент смертности (M, отношение числа павших за 14 дней животных к общему числу зараженных животных в группе) и индекс защиты (IP, отношение разницы процентов смертности в контрольной и опытной группах к проценту смертности в контрольной группе) по формулам:
- M = M : Nt, где M – число животных, павших в течение 14 дней после заражения;
- IP = (Mc - Me) : Mc × 100%, где Mc и Me – смертность в процентах в контрольной и опытной группах соответственно.
Результаты исследования
Результаты тестирования противогриппозной активности компонентов Орвирема представлены в табл. 1.
Как видим, изучаемые соединения по-разному влияли на уровень репродукции использованных вирусов. Вирусы гриппа A/Aichi/2/68(H3N2), A/mallard/Pennsylvania/10218/84(H5N2) и A/Владивосток/02/09(H1N1) оказались римантадин-чувствительными (SI 17, 34 и 28 соответственно), тогда как вирусы A/Puerto Rico/8/34(H1N1) и A/California/07/09(H1N1)pdm09 были устойчивы к его противовирусному действию (SI 7 и 9 соответственно). Вирус гриппа A/California/07/09(H1N1)pdm09 в наибольшей степени ингибировался альгинатом натрия (SI 18), тогда как остальные использованные вирусы продемонстрировали устойчивость к альгинату.
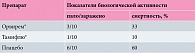
На следующей стадии эксперимента был протестирован комплексный препарат Орвирем® на модели летальной гриппозной пневмонии у мышей. Учитывая, что практически все современные изоляты вируса гриппа римантадин-устойчивы, в работе был использован модельный вирус A/Puerto Rico/8/34(H1N1), также резистентный к римантадину. Данные о протективной активности Орвирема и препарата сравнения Тамифлю® представлены в табл. 2.
Как видим, инфицирование животных вирусом приводило к их гибели, которая к концу эксперимента достигла 60%. Препарат сравнения Тамифлю® снижал процент гибели животных до 10%, что согласуется с данными о чувствительности использованного вируса к осельтамивиру. На фоне применения Орвирема гибель животных уменьшалась на 33%. Видимо, защитное действие препарата обусловлено не только противовирусными свойствами римантадина, но и патогенетическим действием компонентов Орвирема (альгинат натрия) – противотоксическим, иммуностимулирующим, адаптогенным и т.д.
Заключение
Изложенное выше подтверждает актуальность применения препарата Орвирем® для лечения и профилактики гриппа у детей с одного года жизни и старше в условиях напряженной эпидемиологической ситуации.
O.V. Shamsheva, V.V. Zarubayev
N.I. Pirogov Russian National Research Medical University
Research Institute of Influenza, Saint-Petersburg
Contact person: Olga Vasilyevna Shamsheva, ch-infection@mail.ru
Rimantadine bears antiviral activity against influenza A virus, and lowers toxic effects triggered by influenza B virus. Use of this drug at early stage of influenza allows to decrease intensity of clinical manifestations in children.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.