Эволюция представлений о патогенезе и терапии акне. Научно-практическая конференция «Акне, розацеа и патология сально-волосяного фолликула». Сателлитный симпозиум компании «Гленмарк»
- Аннотация
- Статья
- Ссылки



Что могут бактерии при акне и что можем сделать мы?
Кожа заселена разнообразными микроорганизмами. Одни из них выполняют полезные функции, другие воздействуют негативно – могут вызывать воспаление, аллергические реакции, по-разному стимулировать иммунную систему.
Как отметил Алексей Юрьевич СЕРГЕЕВ, д.м.н., профессор кафедры клинической иммунологии и аллергологии Сеченовского университета, председатель Общества теледерматологии и главный редактор www.dermatology.ru, представленность микроорганизмов различается на разных участках кожи (сальная, влажная, сухая)1, а также в разные возрастные периоды (у детей преобладает одна микробиота, у подростков другая, у взрослых третья). На микробный пейзаж также оказывают влияние терапия антисептическими и антибактериальными препаратами, изменение диеты и образа жизни2. Уменьшение разнообразия видов, штаммов, таксонов получило название исчезающей микробиоты.
Согласно результатам сравнительных исследований, у детей от семи до десяти лет микробиом более разнообразный с преобладанием стрептококков3. У подростков и преадолесцентных лиц превалирует Propionibacterium (Cutibacterium) acnes2.
В крупнейших руководствах последних лет P. acnes рассматривается как одна из ведущих причин возникновения акне, хотя само заболевание не является инфекцией4. Предполагают, что P. acnes запускает процесс воспаления через толл-подобные и протеазные рецепторы клеток врожденного иммунитета, что приводит к синтезу антимикробных пептидов и провоспалительных цитокинов (в частности, интерлейкинов (ИЛ) 8, 12 и 1A), кератинизации в устье волосяного фолликула, клеточной адгезии и образованию биопленки.
В 2016 г. были выделены три рода пропионобактерий (Acidipropionibacterium, Cutibacterium, Pseudopropionibacterium). Изначально присутствует на коже только Cutibacterium5.
Одни исследователи считают, что C. acnes является чуть ли не возбудителем акне и исходной причиной его развития, поэтому следует применять специфическую противомикробную терапию и даже вакцинацию6. Другие полагают, что C. acnes – часть эволюционно сложившегося у человека микробиома кожи и препятствует проникновению чужеродных микроорганизмов в кожу. Это две полярные точки зрения. Однако существуют и промежуточные. Согласно им C. acnes активируется при акне (закупорка фолликула), инициирует воспаление, появление воспалительных элементов.
По словам А.Ю. Сергеева, воспаление может развиться без участия Cutibacterium и Propionibacterium acnes. Сначала образуется сальная пробка, увеличивается количество питательных веществ и в фолликуле создаются анаэробные условия для размножения бактерий, затем происходит увеличение их популяции. Возможно, включаются более вирулентные механизмы, а затем выделяется много провоспалительных цитокинов, которые собираются в хромосомы, стимулируя разные звенья иммунитета7.
Установлено, что C. acnes участвует в липогенезе. Изменение баланса липидов ассоциируется с образованием свободных жирных кислот, дефицитом линолевой кислоты, накоплением эфиров сквалена. Все это влияет на процессы воспаления и кератинизации в фолликулах7.
Главным на сегодняшний день остается вопрос: является ли именно C. acnes ведущим и необходимым причинным фактором акне?
C. acnes индуцирует воспаление, однако есть и другие микробы, которые вызывают его, например стафилококки. Кроме того, доказано, что не все виды кутибактерий и пропионобактерий и даже не все штаммы C. acnes являются патогенными. У одного человека может насчитываться до десяти клонов C. acnes. При этом у больных акне выделяют более специфичные клоны (клад I-1a), клональный комплекс СС18, в то время как у здоровых лиц наблюдается более гетерогенная популяция (клады). Клинический исход колонизации зависит от состояния макроорганизма, а не вариации клонов кутибактерий8.
Последние годы отмечается рост резистентных к антибиотикам штаммов и указывается на необходимость преодоления этого во избежание перекрестной резистентности9. Устойчивость к антибиотикам зависит от предшествующей терапии. Наибольшая устойчивость зафиксирована к эритромицину (75%)10.
С 1974 по 2003 г. устойчивость P. acnes к эритромицину значительно возросла. Как следствие, снизилась его эффективность в отношении сокращения воспалительных и невоспалительных элементов акне. При этом устойчивость штаммов к клиндамицину – полусинтетическому антибиотику группы линкозамидов за этот период практически не изменилась11.
На сегодняшний день наблюдается меньшая устойчивость к клиндамицину и фузидовой кислоте. Для сравнения: нечувствительность к клиндамицину составляет 43,98%, фузидовой кислоте – 10,27%.
К клиническим предикторам резистентности относятся лечение более четырех месяцев, повторные курсы, комбинация системных и топических антибиотиков. Указывается также на возможность передачи резистентных штаммов.
У ранее не леченных пациентов с акне резистентность развивается через 12–14 дней от начала антибактериальной терапии.
На базе научно-исследовательского центра «Клиника дерматологии» с 2006 по 2016 г. проведено исследование микробиоты кожи 2634 пациентов с акне. Средний возраст пациентов, которые обращаются по поводу лечения акне, составляет 28 лет, 72% из них женщины. У больных идентифицируется staphyloсoссus, при этом доминирует золотистый стафилококк – 62,98% случаев. Связь между видом Staphylocoсcus и локализацией элементов сыпи, а также с полом и возрастом пациентов не выявлена.
По степени обсемененности выявленные стафилококки существенно превышают норму. Кроме того, отмечена их устойчивость ко всем современным макролидам. Нечувствительность достигает практически 92%. Устойчивость к аминогликозидам – гентамицину и неомицину – 30,93 и 25,84%.
Клиническая связь Staphylococcus и воспаления при акне очевидна. Стафилококки регулярно высеваются с кожи взрослых больных. У пациентов с тяжелыми формами акне и постакне обсемененность стафилококками выше12, 13. Установлено также, что устойчивость стафилококков к современным антибиотикам коррелирует с фактом их использования, обращением или необращением пациентов за медицинской помощью.
Недавние исследования, проведенные российскими учеными, свидетельствуют, что у пациентов с акне пропионовые бактерии практически не различаются по видовому составу и степени обсемененности ими кожи, поэтому, очевидно, не играют ключевой роли при данном заболевании в отличие от золотистого стафилококка, который не только достоверно чаще обнаруживается, но и коррелирует с тяжестью течения акне14.
Для лечения акне в настоящее время используются разные топические препараты. Они применяются как в виде монотерапии, так и в виде комбинированной терапии. В ряде случаев топические препараты применяют совместно с системными.
Эффективным и целесообразным может быть использование нескольких топических средств, воздействующих на разные звенья патогенеза. Поэтому следует рассмотреть возможность назначения их фиксированных комбинаций. Последние ассоциируются с увеличением не только эффективности, безопасности, но и приверженности пациентов терапии15, 16.
Какие комбинации можно использовать? Можно сочетать бензоилпероксид с ретиноидами и антибиотиками. В первом случае возникает вопрос о безопасности лечения. Во втором – мы получаем преимущество в терапии за счет снижения риска развития резистентности бактерий. Что делать, если она уже существует? Еще одна возможная комбинация – «ретиноиды + антибиотики». Данная комбинация не только снижает устойчивость микроорганизмов к антибиотикам, но и обладает кумулятивным действием.
Одним из примеров, содержащих такую комбинацию, является гель Клензит-С. В его состав входят ретиноид адапален 0,1% и антибиотик клиндамицина фосфат 1%.
Адапален характеризуется противовоспалительным эффектом:
- уменьшает миграцию лейкоцитов;
- активность активирующего протеина 1 и синтез простагландинов, матриксных протеиназ;
- экспрессию толл-подобных рецепторов;
- высвобождение провоспалительных цитокинов.
Клиндамицин обладает противомикробным и противовоспалительным действием. Препарат влияет на численность P. acnes, уменьшает хемотаксис и липазы P. acnes.
Совместное применение клиндамицина и адапалена в два раза увеличивает пенетрацию антибиотика в сально-волосяном фолликуле (по сравнению с монотерапией). Благодаря этому повышается эффективность лечения17.
Поддерживающая терапия при акне предполагает использование соответствующих препаратов в интермиттирующем режиме. Это позволяет контролировать появление невоспалительных (комедоны) и воспалительных (папулы, пустулы) элементов акне18. Продолжительность такого лечения может достигать 12 месяцев.
Препаратом выбора для поддерживающей терапии является адапален (Клензит)16.
Наиболее оптимальным алгоритмом лечения акне препаратами Клензит можно считать следующий. При акне легкой степени тяжести (преимущественно комедональной формы) назначают гель Клензит один раз в сутки на ночь в течение 8–12 недель. При средней степени тяжести заболевания (преимущественно папуло-пустулезной форме) – гель Клензит-С. Режим нанесения: один раз в сутки перед сном в течение 8–12 недель. При достижении регресса пустулезных высыпаний через одну-две недели назначается гель Клензит – один раз в сутки перед сном в течение 8–12 недель. Поддерживающая терапия гелем Клензит проводится в интермиттирующем режиме. Гель наносится вечером два-три раза в неделю, длительность такого лечения составляет от шести до 12 недель.
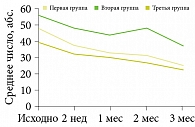
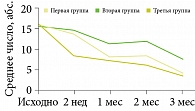
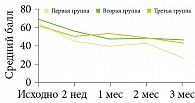
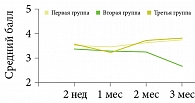
Далее профессор представил результаты открытого рандомизированного сравнительного исследования трех схем наружной комбинированной терапии акне: 0,1%-ного геля адапалена в сочетании с 1%-ным клиндамицином (первая группа), 0,05%-ного изотретиноина (вторая группа) и 0,05%-ного изотретиноина в сочетании с 2%-ным эритромицином (третья группа). В исследовании приняли участие 90 пациентов с акне легкой и средней степени тяжести, выборка была сформирована с помощью ресурса www.ugrei.net. В течение 12 недель наблюдения по специальным шкалам оценивали клиническую тяжесть акне, качество жизни больных, частоту побочных эффектов, комплаентность и удовлетворенность лечением пациентами. К окончанию терапии регресс элементов акне в группах сравнения в среднем составил около 50% от исходного, что сопровождалось улучшением качества жизни и оценки лечения. Частота побочных эффектов в группах была сопоставимой (рис. 1–4).
Результаты исследования подтвердили эффективность наружного комбинированного лечения 0,1%-ными препаратами адапалена и клиндамицина (схема применения – один раз в сутки) с переходом на поддерживающую терапию адапаленом не позднее восьмой недели лечения. По совокупности оценок врача и больного наиболее перспективным является начало терапии акне с комбинированного препарата Клензит-С19.
Фиксированные комбинации в современной терапии акне: не ищем тренды, а создаем
Акне – генетически обусловленное, хроническое, многофакторное заболевание кожи, сальных желез и волосяных фолликулов, то есть «патология пилосебацейного комплекса», пояснила Елена Николаевна ВОЛКОВА, д.м.н., профессор.
Среди значимых патогенетических факторов выделяют воспаление и иммунный ответ, аномальную кератинизацию выводных протоков сальных желез, гиперпродукцию кожного сала и микробную гиперколонизацию (P. acnes и др.). В настоящее время первое место в патогенезе отводится воспалению.
Определены также липиды, обусловливающие развитие акне: линолевая кислота, свободные жирные кислоты, сквален, сфингозин. Липиды избирательно регулируют пролиферацию и дифференцировку кератиноцитов. Промоторами дифференцировки являются церамиды, пролиферации – сфингозин и сфингозилфосфорилхолин. Стимуляторами пролиферации признаны цитокины. Образование комедонов индуцирует ИЛ-1-альфа. В свою очередь агонист рецептора ИЛ-1 и эпидермальный фактор роста снижают комедонообразование.
Гиперпродукция кожного сала – недостаточный, но важный фактор развития акне. Отмечается корреляция между количеством кожного сала и тяжестью заболевания. Гиперпродукция кожного сала также считается индикатором андрогенной активности. Изменение себопродукции ассоциируется с изменением численности P. acnes (наряду с комплексом бактерий – кожной микробиотой). Это связано с созданием оптимальной среды для их роста и размножения. Связь между тяжестью заболевания и количеством P. acnes на данный момент остается спорной. Однако о роли этих бактерий в патогенезе акне свидетельствуют два фактора:
- эффективность антибактериальной терапии;
- наличие устойчивых к антибиотикам штаммов P. acnes.
Почему у одних лиц P. acnes вызывает воспаление, у других – нет? Воспалительный процесс при акне зависит от бактериологического фактора или от иммунной реакции носителя на P. acnes? На эти вопросы еще предстоит ответить.
В ряде исследований продемонстрировано, что жизнеспособные P. acnes значительно повышают выделение интерферона гамма, ИЛ-12р40 и ИЛ-8. Интерферон гамма – один из незаменимых цитокинов, индуцирующих иммунный ответ. Предполагают, что на участках, пораженных акне, его продукция усиливается. Это объясняет эффективность тетрациклина при лечении акне. Препарат не только оказывает бактериостатическое действие, но и снижает выработку интерферона гамма.
P. acnes – гетерогенная группа микроорганизмов. Виды различаются энзимными и гемолитическими свойствами. Однако гетерогенность P. acnes не является решающей в продукции цитокинов. Подтверждением служит тот факт, что P. acnes как здоровых, так больных доноров вызывали выработку противовоспалительных цитокинов.
Несмотря на кажущуюся изученность патогенеза акне, вопросов по-прежнему больше, чем ответов.
До сих пор отсутствует единая классификация форм акне.
Согласно американской классификации существует четыре степени тяжести акне:
- первая степень характеризуется наличием комедонов (открытых и закрытых) и до десяти папул;
- вторая – наличием комедонов, папул и до десяти пустул;
- третья – наличием комедонов, папул, пустул и узлов (до трех);
- четвертая степень – выраженной воспалительной реакцией в глубоких слоях дермы с формированием множественных болезненных узлов и кист.
Эксперты Российского общества дерматовенерологов и косметологов предложили подразделять акне на комедональные, папуло-пустулезные легко-средней тяжести, тяжелые папуло-пустулезные, узловатые умеренной тяжести, узловатые тяжелой степени и конглобатные.
Для элементов акне свойственен ложный полиморфизм. Первоначальными элементами являются невоспалительные открытые и закрытые комедоны. Заболевание характеризуется рецидивирующим течением, оно требует длительных курсов лечения, для удержания контроля над акне необходима поддерживающая терапия.
Далее Е.Н. Волкова перечислила принципы лечения акне:
- должно быть своевременным (ранним!);
- эффективным;
- способствовать разрешению или значимому уменьшению воспалительных и невоспалительных элементов.
Кроме того, обязательны поддерживающая терапия (для профилактики рецидивов), коррекция проявлений постакне, уход за кожей.
При назначении терапии следует учитывать предпочтения пациентов (удобство применения, минимальную кратность приема, органолептические свойства).
Тактика ведения больных зависит от их возраста и пола, степени выраженности и распространенности клинических проявлений акне, наличия сопутствующих патологий. При легкой степени тяжести показана только наружная терапия: топические ретиноиды, местные антибиотики, антибактериальные и противовоспалительные средства и их комбинации.
При средней степени тяжести рекомендуют топическую терапию в сочетании с системными антибиотиками, антибактериальными препаратами или комбинированными оральными контрацептивами с антиандрогенным эффектом (у женщин).
При тяжелых формах акне следует совмещать системные ретиноиды и топическую терапию.
Топическая терапия ассоциируется с увеличением количества резистентных к антибиотикам штаммов микроорганизмов. Кроме того, при применении топических антибиотиков часто развиваются аллергические реакции.
Медикаментозное лечение акне следует начинать как можно раньше. Это минимизирует риск развития проявлений постакне.
Считается, что применение топических ретиноидов (адапалена) способствует достижению желаемого эффекта терапии, повышает удовлетворенность и приверженность лечению.
Адапален (Клензит) – синтетический ретиноид четвертого поколения. Он показан для топической терапии acne vulgaris.
«Клензит – препарат патогенетического действия. Пациентов необходимо обучать его применению», – подчеркнула Е.Н. Волкова. Она также отметила, что необходимо предупреждать пациентов об отсроченном эффекте терапии: «Назначение препарата сегодня не приведет к эффекту завтра».
Препарат Клензит предотвращает образование микрокомедонов (антикомедогенное действие) и способствует удалению сально-кератиновой пробки (комедонолитическое действие). Помимо прямого воздействия на гиперкератоз он способен снижать синтез провоспалительных цитокинов, ингибировать миграцию нейтрофилов, липооксигеназы (противовоспалительный эффект). Таким образом, Клензит оказывает воздействие на три патогенетических фактора, и в этом заключается его неоспоримое преимущество.
Адапален также обладает омолаживающим эффектом, что обусловлено влиянием на металлопротеиназу.
Адапален является препаратом первого выбора для местного патогенетического лечения acne vulgaris: он показан для монотерапии acne comedonica и acne papulopustulosa легкой степени, а также для комбинированной терапии acne papulopustulosa средней и тяжелой степени.
Курс лечения в среднем длится 12 недель (не менее 30 г препарата в форме геля при нанесении препарата только на область лица). Гель нужно бережно наносить на пораженные участки кожи один раз в день на ночь. Кожа должна быть предварительно очищена. Препарат нельзя наносить на периорбитальную и периоральную области.
Терапевтический эффект развивается через четыре – восемь недель, стойкое улучшение – через три месяца.
Клензит – гель на водной основе, который не содержит масляных ингредиентов. Действующее вещество представляет собой микрокристаллы одинакового размера, что способствует равномерной дисперсии. Перечисленные особенности препарата обеспечивают эффективную доставку активного вещества в пораженные зоны, лучшую переносимость лечения и оптимальные косметические свойства20.
Клензит можно назначать для длительной поддерживающей терапии, при переводе пациентов с системной терапии на топическую. К препарату не формируется резистентность.
Эффективность и переносимость адапалена в форме геля 0,1% по сравнению с плацебо изучались в двух клинических исследованиях. В них включали пациентов от 12 до 30 лет с акне легкой и средней степени тяжести. Режим применения средства – один раз в сутки перед сном в течение 12 недель21.
В многоцентровом рандомизированном двойном слепом исследовании, проведенном A. Lucky и соавт., приняло участие 237 пациентов (125 мужчин и 112 женщин). Они были разделены на две группы терапии: адапален в форме геля 0,1% и плацебо. Больные также применяли средства ухода, не содержащие мыла. От использования увлажнителей им было рекомендовано отказаться.
Адапален оказался более эффективным в отношении влияния на невоспалительные, воспалительные и все элементы сыпи. В среднем число высыпаний уменьшилось на 34, 32 и 34% соответственно (р < 0,05 по сравнению с исходным уровнем для всех трех параметров). В группе плацебо данные показатели составили 18, 17 и 18% соответственно. Терапия адапаленом ассоциировалась с большим количеством побочных эффектов со стороны кожи, но они легко переносились большинством пациентов.
В исследовании L.E. Millikan и соавт. (n = 350) были получены аналогичные результаты. Терапия адапаленом в отличие от применения плацебо способствовала сокращению невоспалительных элементов на 35% (против 15%), воспалительных – на 14% (против 6%), всех элементов – на 30% (против 15%).
Результаты обоих исследований свидетельствуют, что адапален в форме геля 0,1% обладает хорошей эффективностью, переносимостью и профилем безопасности (низкая частота кожных побочных эффектов).
Проведено несколько крупных сравнительных рандомизированных исследований адапалена22, 23. Результаты терапии адапаленом 0,1% и третиноином в разных концентрациях (от 0,025 до 0,1%) подтверждают сопоставимый клинический эффект препаратов при лучшей переносимости первого. Уменьшение общего количества высыпаний более чем на 50% наблюдалось уже через 4–12 недель терапии. Однако монокомпонентные препараты не всегда эффективны.
Последним трендом в лечении акне является применение комбинированных препаратов с фиксированной дозой. Такие препараты воздействуют на разные звенья патогенеза, разные этапы образования элементов акне (таблица). Как следствие, повышаются скорость наступления эффекта, удобство применения и приверженность лечению.
Клензит-С представляет собой комбинацию адапалена и клиндамицина. В 1 г геля содержится 1 мг адапалена и 10 мг клиндамицина. Действие адапалена направлено на нормализацию процессов фолликулярной дифференцировки и пролиферации. Он препятствует образованию микрокомедонов (предшественников комедонов и воспалительных элементов), оказывает противовоспалительное действие, улучшает пенетрацию других топических компонентов. Включение клиндамицина в препарат обеспечивает антибактериальное (сокращение популяции P. acnes) и противовоспалительное действие (подавление лейкоцитарного хемотаксиса, снижение содержания жирных кислот). Вещество способствует уменьшению числа воспалительных элементов и препятствует их развитию24. Еще одной особенностью клиндамицина является антикомедогенный эффект: за счет ингибирования липазы снижается количество свободных жирных кислот и уменьшается количество комедонов.
Для оценки фактического снижения эффективности топического эритромицина и клиндамицина T. Simonart и M. Dramaix проанализировали результаты клинических исследований, проведенных с 1974 по 2003 г. Эффективность эритромицина в отношении снижения количества воспалительных и невоспалительных элементов ежегодно уменьшалось на 2,14 и 2,03% соответственно. Эффективность клиндамицина с течением времени изменилась незначительно. При этом резистентность P. acnes к терапии продолжала нарастать11.
Высокая чувствительность P. acnes – еще одно преимущество клиндамицина.
Применение Клензит-С в течение четырех – восьми недель с переключением в дальнейшем на монотерапию препаратом Клензит в режиме постоянной или поддерживающей терапии обеспечивает регресс элементов акне в среднем на 50% к 12-й неделе, что соответствует показателям эффективности, установленным в последних международных исследованиях.
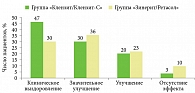
Применение комбинации «Клензит/Клензит-С» оказалось эффективнее комбинации «Зинерит/Ретасол» в отношении разрешения элементов акне. 60 пациентов с акне легкой, средней и тяжелой степени в возрасте от 11 до 38 лет были разделены на две группы терапии. Первая получала Клензит-С один раз в сутки перед сном в течение двух-трех недель до устранения воспалительных проявлений, далее – Клензит по той же схеме в течение шести – восьми недель. Вторая группа применяла сначала лосьон Зинерит два раза в сутки (утром и вечером) в течение двух-трех недель, далее – Ретасол по аналогичной схеме от шести до восьми недель.
В первой группе большее число пациентов достигли клинического выздоровления (рис. 5). Терапия комбинацией «Клензит/Клензит-С» способствовала более выраженному противовоспалительному эффекту, быстрому разрешению невоспалительных (комедоны) и воспалительных (папул и пустул) элементов (через 7–14 дней). Стойкий клинический эффект отмечался у 93,3% больных уже через восемь недель.
Немаловажно, что гели Клензит и Клезит-С не оказывают фотосенсибилизирующего действия25, поэтому их можно назначать в летнее время.
В 2016 г. опубликованы обновленные Федеральные клинические рекомендации по ведению больных акне Российского общества дерматовенерологов и косметологов, в которых адапален (Клензит) и его комбинация с топическим антибиотиком, например клиндамицином (Клензит-С), предложены в качестве препаратов первой линии терапии разных форм акне.
Комбинация клиндамицина и адапалена включена в рекомендации с высоким уровнем доказательности B.
Заключение
Проблема эффективного лечения акне обусловлена развитием резистентности штаммов к антибиотикам.
Препараты для наружного применения Клензит и Клензит-С компании «Гленмарк» предназначены не только для терапии разных форм акне, но и для предупреждения рецидивов заболевания. Приведенные докладчиками результаты исследований свидетельствуют, что применение этих препаратов позволяет добиваться стойкого эффекта, а также повышает приверженность пациентов лечению.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.