Фармакотерапия вторичного синдрома Рейно
- Аннотация
- Статья
- Ссылки
- English
Лечение вторичного СР является обязательным компонентом комплексной терапии заболеваний, с которыми данный синдром ассоциируется. В фармакотерапии СР используются препараты, которые оказывают сосудорасширяющий эффект. В последнюю декаду арсенал таких препаратов существенно расширился за счет появления лекарственных средств с разными механизмами действия.
Обзору таковых посвящена данная статья.
Лечение вторичного СР является обязательным компонентом комплексной терапии заболеваний, с которыми данный синдром ассоциируется. В фармакотерапии СР используются препараты, которые оказывают сосудорасширяющий эффект. В последнюю декаду арсенал таких препаратов существенно расширился за счет появления лекарственных средств с разными механизмами действия.
Обзору таковых посвящена данная статья.
Введение
Синдром Рейно (СР) характеризуется эпизодами дигитальной ишемии, индуцированными холодом или эмоциональным стрессом. В настоящее время установлены два механизма его развития: преходящий вазоспазм и фиксированная обструкция артерий пальцев. Однако, скорее всего, это мультифакторное заболевание.
Причиной чрезмерно выраженного вазоспазма в ответ на провоцирующие стимулы является дефект центральных и локальных механизмов регуляции тонуса сосудов. Изменение активности адренорецепторов периферических сосудов, в особенности повышенная экспрессия постсинаптических альфа-2с-адренорецепторов, приводит к гиперактивности гладкомышечных клеток сосудистой стенки и снижению порога чувствительности периферических сосудов к вазоконстрикторным стимулам [1]. Помимо этого большую роль играют фенотипические изменения сосудистых эндотелиальных клеток, изменения реологических параметров. В развитии вторичного СР существенная роль отводится структурным изменениям сосудов [2]. Особое значение придается дисбалансу между вазодилататорами и вазоконстрикторами вследствие нарушений нейрогенного контроля сосудистого тонуса и продуцируемых в гемоциркуляцию медиаторов [3, 4]. Известно, что при охлаждении повышается продукция кислородных радикалов, которые активируют Rho-киназу, вызывающую транслокацию на клеточную мембрану альфа-2с-адренорецепторов, ответственных за вазоконстрикторные реакции [5, 6].
Еще в 1929 г. T. Lewis предложил подразделять СР на первичный и вторичный [7]. В 80–90% случаев он является первичным, или идиопатическим [8, 9]. Вторичный СР ассоциируется с разными группами заболеваний, прежде всего с системными заболеваниями соединительной ткани (системная склеродермия, системная красная волчанка, дермато- и полимиозит, синдром Шегрена и др.). На вторичный характер СР указывают поздний возраст дебюта патологии, болезненные эпизоды вазоспазма с признаками тканевой ишемии (изъязвления), асимметричные атаки. Необходимо учитывать, что клинические признаки, с которыми ассоциируется СР, могут развиться по истечении нескольких месяцев или лет после появления эпизодов вазоспазма. Вторичный СР является следствием васкулопатии.
Лечение СР признано обязательным компонентом терапии заболеваний, с которыми он ассоциируется. При СР используются препараты, которые оказывают сосудорасширяющее действие. Последнее десятилетие ознаменовано расширением арсенала лекарственных средств, применяемых при СР, прежде всего благодаря появлению сосудорасширяющих препаратов с разными механизмами действия. Их рассмотрению посвящена данная статья.
Блокаторы кальциевых каналов
Блокаторы кальциевых каналов, или антагонисты кальция (Са), – вещества, которые противодействуют эффектам ионов кальция, влияя либо на их прохождение через мембрану клеток, либо на связывание или высвобождение из саркоплазматического ретикулума. Поэтому выделяют три группы антагонистов кальция:
- стимуляторы аденилатциклазы, под влиянием которой образуется циклический аденозинмонофосфат, повышающий активность Са++-насоса в саркоплазматическом ретикулуме и таким образом снижающий внутриклеточное содержание ионов кальция (аденозин, простациклин);
- ингибиторы кальмодулина – медиатора действия ионов кальция в гладкомышечных клетках (фендилин);
- ингибиторы проникновения ионов кальция через клеточную мембрану.
Проникновение ионов кальция через клеточную мембрану осуществляется через потенциал-зависимые и рецептор-зависимые кальциевые каналы. В свою очередь потенциал-зависимые кальциевые каналы подразделяются на три типа – T, L и N. Каналы T и L обнаружены в кардиомиоцитах и гладкомышечных клетках сосудов, тогда как каналы N – только в мембранах нейронов. Т-каналы быстро инактивируются, поэтому ток ионов кальция через них незначительный. L-каналы инактивируются медленнее и являются длительно действующими. Именно эти каналы чувствительны к действию антагонистов кальция.
Таким образом, в узком смысле блокаторы кальциевых каналов – это лекарственные препараты, которые тормозят или полностью блокируют проникновение ионов кальция внутрь клеток по потенциал-зависимым медленным кальциевым каналам L-типа [10].
В зависимости от химической структуры антагонисты кальция подразделяют на три группы: производные фенилалкиламина (верапамил и др.), производные бензодиазепина (дилтиазем и др.) и производные дигидропиридина (нифедипин, амлодипин, исрадипин, фелодипин и др.). Указанные группы различаются наличием и степенью выраженности сердечно-сосудистых эффектов, в частности влиянием на периферические и коронарные артерии, сократительную способность миокарда, функцию синусового и атриовентрикулярного узлов.
Первые сообщения об эффективности нифедипина при первичном и вторичном СР были получены в начале 1980-х гг. [11–13]. До настоящего времени нифедипин и другие дигидропиридиновые производные остаются препаратами первой линии в лечении СР, что нашло подтверждение в последних рекомендациях Европейской антиревматической лиги (Еuropean League Against Rheumatism – EULAR) по лечению системной склеродермии 2017 г. [14]. Эффективность антагонистов кальция, в первую очередь дигидропиридиновых производных, по сравнению с плацебо была продемонстрирована в недавнем Кохрановском обзоре (38 рандомизированных клинических исследований, 982 больных с первичным или вторичным СР) [15]. Обобщенный анализ результатов этих исследований показал, что блокаторы кальциевых каналов (особенно производные дигидропиридина) уменьшали частоту, длительность и выраженность атак вазоспазма, а также болевые ощущения, связанные с СР. Отмечалось также, что при высокой частоте побочных эффектов серьезных среди них не наблюдалось. В многоцентровом контролируемом исследовании, в которое было включено 313 больных с первичным СР, при приеме нифедипина отмечалось снижение частоты атак вазоспазма на 66% [16]. У 15% больных препарат был отменен из-за развития нежелательных реакций. Метаанализ 12 рандомизированных исследований эффективности нифедипина показал уменьшение выраженности атак вазоспазма на 33% (оценивали по визуальной аналоговой шкале), а также их частоты на 2,8–5,0 эпизода в неделю [17].
Для поддержания равномерной и стойкой концентрации препарата в крови, а также уменьшения частоты побочных эффектов предпочтительно назначать нифедипин пролонгированного действия. Рекомендуемая суточная доза препарата составляет 30–90 мг в зависимости от эффективности и переносимости. Однако, как показывает собственный опыт, прием нифедипина в дозе более 60 мг/сут приводит к повышению риска развития нежелательных явлений, в первую очередь артериальной гипотензии и тахикардии.
Производные дигидропиридина признаны наиболее эффективными вазодилататорами по сравнению с другими классами антагонистов кальция, однако на их фоне чаще развиваются побочные эффекты. В случае развития таковых назначают другие производные дигидропиридина (амлодипин, исрадипин, фелодипин и др.). Амлодипин по сравнению с нифедипином обладает большим периодом полувыведения, однако меньшей эффективностью [18]. При СР доказана также эффективность никардипина [19], фелодипина [20] и нисолдипина [21]. В рандомизированном двойном слепом исследовании установлено, что при приеме 120 мг дилтиазема три раза в день по сравнению с плацебо достоверно снижалась частота и выраженность атак вазоспазма у больных с первичным и вторичным СР [22]. Дилтиазем по сравнению с нифедипином оказывал менее выраженное сосудорасширяющее действие и, следовательно, реже ассоциировался с развитием побочных явлений, однако его эффективность была существенно ниже [23]. Производное фенилалкиламина верапамил в большей степени влиял на проводящую систему сердца, чем на периферические сосуды, и в этом отношении он не может считаться адекватным вазодилататором.
Ингибиторы фосфодиэстеразы 5
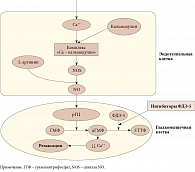
Оксид азота (NO) – мощный вазодилататор с коротким, в несколько секунд, периодом полураспада. Связываясь с гем-содержащей частью растворимой гуанилатциклазы (рГЦ), он приводит к конформационным изменениям фермента и его активации (рис.). Растворимая ГЦ катализирует реакцию дефосфорилирования гуанозинтрифосфата до образования циклического гуанозинмонофосфата (цГМФ), который посредством цГМФ-зависимой протеинкиназы G оказывает прямое воздействие на фосфорилирование и соответственно активность ионных каналов клеточных мембран [24, 25]. Фосфорилирование ионных каналов приводит к оттоку К+ из клетки и гиперполяризации клеточной мембраны, а также препятствует проникновению Ca++ внутрь клетки [26]. Снижение внутриклеточной концентрации Ca++ сопровождается его отсоединением от кальмодулина и киназы легких цепей миозина. Дефосфорилирование легких цепей миозина препятствует их связыванию с актином и приводит к расслаблению гладкомышечных клеток и вазодилатации. Уровень цГМФ снижается вследствие гидролиза фосфодиэфирной связи. Этот процесс осуществляется специфическим для цГМФ ферментом – фосфодиэстеразой 5 (ФДЭ-5). Под воздействием последней цГМФ трансформируется в 5’-ГМФ (см. рис.) [27]. Учитывая роль цГМФ в NO-опосредованной вазодилатации, лекарственные средства, которые препятствуют его разрушению, представляют особый интерес в лечении заболеваний, ассоциированных с поражением сосудов.
В 1986 г. был разработан силденафил (Виагра®, компания «Пфайзер») – высокоселективный ингибитор ФДЭ-5. Структурная схожесть силденафила с цГМФ позволяет ему конкурировать за место связывания с ФДЭ-5. В частности, силденафил связывается с каталитическим участком ФДЭ-5 приблизительно в тысячу раз прочнее, чем естественный субстрат [28].
В 2003 г. было опубликовано первое сообщение о положительных результатах применения силденафила при СР [29]. Силденафил был назначен десяти больным первичным или вторичным СР, ассоциированным с системной склеродермией и системной красной волчанкой. Доза препарата составляла 50 мг/сут. Положительный эффект наблюдался у больных как с первичным, так и вторичным СР. Ответ на лечение во всех случаях был охарактеризован как значительный – вплоть до полного исчезновения симптомов. Хотя сроки лечения не были указаны, у всех больных с дигитальными язвами пальцев кистей и стоп отмечалось их заживление. Однако после отмены силденафила произошел рецидив. Переносимость препарата была хорошей, побочных эффектов не наблюдалось.
В 2004 г. проведено двойное слепое плацебоконтролируемое исследование с целью изучить безопасность и эффективность силденафила при СР [30]. В частности, оценивалось влияние силденафила на частоту и выраженность атак Рейно, воздействие на кожную микроциркуляцию (по данным лазерной допплеровской флоуметрии) и качество жизни пациентов. 20 больных, включенных в исследование, были разделены на две равные группы. Первая группа (n = 10) в течение первых двух недель получала силденафил по 50 мг два раза в день, вторая (n = 10) – плацебо. После одной недели «отмывания» получавшие плацебо были переведены на силденафил и наоборот. Длительность второго этапа терапии – две недели. По истечении двух, трех и пяти недель исследователи не выявили достоверных различий в частоте атак вазоспазма, в счете синдрома Рейно и кожной микроциркуляции по сравнению с исходными данными.
В то же время в другом аналогичном по дизайну исследовании были получены противоположные результаты [31]. Авторы изучали эффект силденафила в дозе 50 мг два раза в день или плацебо после четырех недель лечения у 20 больных с первичным и вторичным СР, резистентным к предшествовавшей вазодилатационной терапии. У шести из 16 пациентов с вторичным СР наблюдались длительно незаживающие дигитальные язвы. У принимавших силденафил по сравнению с получавшими плацебо достоверно снизились частота и кумулятивная продолжительность атак вазоспазма, а также счет синдрома Рейно. Дигитальные изъязвления значительно уменьшились в размерах, у двух из шести больных отмечено заживление язв. При повторном исследовании во всех случаях отмечалось достоверное повышение скорости кровотока в капиллярах ногтевого ложа – в среднем более чем в четыре раза. Все больные четко различали этапы приема плацебо или силденафила. По завершении исследования 89% больных изъявили желание продолжить лечение препаратом.
В другом исследовании улучшение симптомов СР (значительное снижение частоты и выраженности атак) наблюдалось у восьми из десяти больных через несколько недель лечения силденафилом в дозе 12,5–100,0 мг/сут. При этом у шести из восьми в этот же период зафиксировано полное заживление дигитальных язв, рефрактерных к обычной терапии [32].
В небольшой серии наблюдений с помощью термографии оценивалось влияние разных ингибиторов ФДЭ-5 на кровоток в подушечках пальцев больных вторичным СР [33]. Через 120 минут после приема силденафила, варденафила или тадалафила средняя температура на кончике пальцев повысилась на 2,17, 3,47 и 3,59 °C соответственно.
В другом исследовании отмечалось повышение кожной гемоперфузии в подушечках пальцев кистей после четырех недель приема силденафила (по данным лазерной допплеровской флоуметрии) в четыре раза [31]. Проведенный в 2013 г. метаанализ показал, что ингибиторы ФДЭ оказывали значимый, но умеренный эффект при вторичном СР. На фоне лечения частота атак в среднем снижалась на 0,49 эпизода в день, их длительность – на 14,62 минуты [34].
Несмотря на положительное влияние ингибиторов ФДЭ-5 на течение вторичного СР, мало внимания уделялось оценке их побочных эффектов. С этой целью был проведен анализ собственных данных эффективности и безопасности силденафила у 16 больных системной склеродермией [35]. Жалобы, связанные с приемом силденафила, предъявляли четверо больных. Среди таковых указывалась головная боль (один пациент), головокружение (два пациента) и усиление стенокардии (один больной). Еще у четырех больных в разные сроки от начала лечения силденафилом развились сердечно-сосудистые осложнения: острый инфаркт миокарда с летальным исходом через шесть недель приема препарата, мерцательная аритмия через восемь недель, усиление стенокардии через шесть месяцев и застойная сердечная недостаточность через пять лет лечения. Эти осложнения наблюдались у лиц с выраженными изменениями электрокардиограммы (ЭКГ). Речь, в частности, идет об очаговом фиброзе или недостаточности кровоснабжения миокарда. Полученные результаты указывают на то, что у больных с выраженными ЭКГ-изменениями на фоне лечения силденафилом повышается риск развития тяжелых кардиальных осложнений, что требует тщательного мониторинга состояния.
Согласно рекомендациям EULAR ингибиторы ФДЭ-5 следует назначать при выраженном СР и/или недостаточной эффективности антагонистов кальция [14].
В настоящее время помимо силденафила в клинической практике используются тадалафил и варденафил, которые различаются по фармакокинетическим свойствам. Описано успешное применение тадалафила у пациента с вторичным СР, у которого предшествующее лечение силденафилом оказалось неэффективным [36]. Однако в рандомизированном исследовании не наблюдалось различий между тадалафилом и плацебо в отношении влияния на количество, выраженность и длительность атак вазоспазма [37].
Аналоги простагландинов
В большинстве исследований при СР оценивалась эффективность илопроста – стабильного аналога эпопростенола (простагландина I2). Согласно рекомендациям EULAR илопрост при СР следует назначать в случае неэффективности парентеральной терапии и/или для лечения дигитальных язв [14]. Установлено, что внутривенное введение илопроста более эффективно по сравнению с пероральным приемом. В Кохрановском обзоре 1998 г. представлены данные об эффективности илопроста при вторичном СР. В частности, указывалось на уменьшение частоты и выраженности атак вазоспазма [38]. Однако результаты исследований были неоднозначными. В большом рандомизированном двойном слепом исследовании инфузии илопроста способствовали снижению частоты и выраженности атак вазоспазма у больных системной склеродермией, однако не влияли на заживление дигитальных язв [39]. В другом исследовании инфузии илопроста не влияли на частоту и выраженность атак вазоспазма, но улучшали заживление дигитальных язв [40]. В отдельных случаях или серии случаев при применении илопроста отмечалось как уменьшение частоты, выраженности и длительности атак вазоспазма, так и улучшение заживления язв [41–43]. В нескольких небольших исследованиях сравнивалось влияние илопроста и нифедипина на характеристики СР у больных с системной склеродермией. В одной из таких работ короткий курс инфузий илопроста в отличие от нифедипина приводил к снижению частоты, длительности и выраженности атак вазоспазма [44].
В то же время илопрост ассоциируется с высокой частотой побочных реакций, таких как головная боль, покраснение лица, тошнота, миалгии, боль в жевательных мышцах, диарея [39, 45]. Согласно результатам ряда исследований, пероральный прием илопроста при вторичном СР не отличался от применения плацебо в отношении рассматриваемых показателей [46, 47].
Другим представителем простагландинов с вазодилатирующим и антиагрегантным действием является алпростадил (простагландин Е1). В небольшом открытом исследовании ежедневная инфузия алпростадила в течение шести дней ассоциировалась со снижением частоты и выраженности атак вазоспазма у пациентов с системной склеродермией [48]. Однако в двойном слепом плацебоконтролируемом исследовании, включавшем больных первичным или вторичным СР, ассоциированным с системной склеродермией, алпростадил продемонстрировал эффективность, сопоставимую с плацебо [49].
Антагонисты рецепторов эндотелина
Альтернативой простагландинам могут стать антагонисты рецепторов эндотелина.
В нескольких исследованиях у пациентов с выраженным СР, не ответивших на другие виды лечения, оценивался эффект антагонистов рецепторов эндотелина.
Рецепторы эндотелина А обнаруживают главным образом на гладкомышечных клетках сосудов. Они опосредуют вазоконстрикцию и клеточную пролиферацию. Рецепторы В представлены преимущественно на эндотелиальных клетках. Данный тип рецепторов ассоциируется с активацией вазодилатации посредством NO.
Первый представитель антагонистов рецепторов эндотелина – бозентан. Он относится к неселективным препаратам.
Бозентан во многих странах одобрен для профилактики дигитальных язв при системной склеродермии или другого генеза. Эти рекомендации основаны на результатах двух исследований. В одном из них – рандомизированном двойном слепом исследовании у больных, принимавших бозентан, отмечалось снижение частоты появления новых дигитальных язв в среднем на 48% по сравнению с получавшими плацебо. Однако различий между группами в отношении заживления существующих язв получено не было [50]. В другом похожем исследовании, включавшем 188 пациентов с системной склеродермией, общее количество новых язв в течение 24 недель наблюдения достоверно различалось – 1,9 в группе бозентана и 2,7 в группе плацебо [51].
Описаны также случаи заживления дигитальных язв после применения бозентана у лиц с системной склеродермией, у которых предшествующая терапия блокаторами кальциевых каналов и силденафилом оказалась неэффективной [52]. Заживление язв отмечалось у 65% больных в среднем после 25 недель лечения.
В одном из исследований зафиксировано улучшение поток-зависимой вазодилатации при лечении бозентаном больных системной склеродермией. Однако в нем не оценивалось влияние терапии на частоту или выраженность СР, а также на заживление дигитальных язв [53].
В то же время описана серия случаев, в которых на фоне лечения бозентаном не отмечалось улучшения течения СР, микроциркуляторного кровотока, систолического давления в пальцевой артерии [54].
Среди побочных эффектов бозентана указывают серьезное поражение печени, анемию и тератогенное действие.
Альфа-адреноблокаторы
Альфа-адренорецепторы играют важную роль в симпатической регуляции сосудистого тонуса и температуры кожи [55].
В двойном слепом плацебоконтролируемом исследовании, включавшем 24 больных, празозин превосходил по эффективности плацебо в лечении СР [56]. Авторы наблюдали снижение частоты и длительности атак вазоспазма, а также улучшение состояния кожного кровотока (по результатам лазерной допплеровской флоуметрии).
I.J. Russell и соавт. зафиксировали клиническое улучшение и снижение резистентности сосудов при лечении празозином 14 больных СР [57]. Однако его положительное влияние отмечалось только при первичном СР. При системной склеродермии положительный эффект наблюдался только у одного из пяти больных.
В другом исследовании празозин продемонстрировал эффективность как при первичном, так и вторичном СР [58].
Метаанализ показал, что празозин существенно снижал выраженность и частоту атак вазоспазма у больных системной склеродермией [59]. Разработка длительно действующих блокаторов альфа-адренорецепторов позволила сократить частоту применения препаратов до одного раза в день [60, 61].
Особую роль в терморегуляции кожи играют альфа-2с-адренорецепторы. В небольшом исследовании, включавшем 13 больных СР, ассоциированным с системной склеродермией, было показано, что специфический блокатор альфа-2с-адренорецепторов уменьшал время восстановления температуры кожи после воздействия холода [62].
Антагонисты серотониновых рецепторов и ингибиторы обратного захвата серотонина
Серотонин (5-hydroxytriptamine – 5-HT) является нейромедиатором. Он содержится в головном мозге, желудочно-кишечном тракте и в большом количестве в тромбоцитах, где выполняет функцию местного гормона или медиатора.
В настоящее время известно семь типов (14 подтипов) серотониновых рецепторов. Так, 5-HT2A находится в гладких мышцах сосудов, тромбоцитах, легких, центральных нейронах и желудочно-кишечном тракте. Эти рецепторы вовлечены в процессы сокращения кровеносных сосудов, коагуляции тромбоцитов и выброса серотонина из тромбоцитов. 5-HT2B и 5-HT2C представлены на периферии и в головном мозге. Они задействованы в расслаблении кровеносных сосудов.
Роль серотонина в патофизиологии СР не до конца изучена. Однако установлено, что на фоне применения селективного ингибитора обратного захвата серотонина флуоксетина симптомы СР уменьшались [63].
В пилотном исследовании сравнивали терапию флуоксетином и нифедипином у 26 больных с первичным и 27 – с вторичным СР [64]. Флуоксетин 20 мг/сут или нифедипин 40 мг/сут принимали в течение шести недель, после двухнедельного отмывочного периода пациенты получали альтернативный препарат. При приеме обоих препаратов наблюдалось уменьшение частоты и выраженности атак вазоспазма, однако эффект был значимым только при лечении флуоксетином.
В небольшом исследовании, включавшем семь больных системной склеродермией, установлено, что прием сарпогрелата – селективного антагониста 5-HT2-рецепторов в дозе 300 мг/сут в течение 12 месяцев ассоциировался со снижением частоты и длительности атак вазоспазма [65]. Аналогичные результаты получены и в других исследованиях. 32 и 12 пациентов с вторичным СР ежедневно принимали 300 мг сарпогрелата в течение восьми или 12 недель [66, 67].
В то же время в ряде исследований наблюдалось усиление симптомов СР при лечении ингибиторами обратного захвата серотонина и антагонистами серотониновых рецепторов [68–70].
Метаанализ эффективности ингибитора обратного захвата серотонина кетансерина также не подтвердил положительное влияние такой терапии на течение вторичного СР, ассоциированного с системной склеродермией [71].
Ботулинический токсин А Ботулинический токсин А – нейротоксин, который специфически связывается с пресинаптической мембраной и проникает в цитозоль посредством эндоцитоза, где действует как Zn2+-зависимая протеаза цитозоля, избирательно расщепляя SNAP-25.
Мембранный белок SNAP-25 с молекулярной массой 25 кДа осуществляет стыковку синаптической везикулы с пресинаптической мембраной нейрона и их слияние с последующим высвобождением нейромедиатора. Ботулинический токсин А, расщепляя SNAP-25, препятствует высвобождению ацетилхолина из пресинаптических терминалей холинергических нейронов. Конечным эффектом этого процесса становится стойкая хемоденервация. Клинически это проявляется выраженным расслаблением мышц в месте инъекции и значительным уменьшением боли.
Первое сообщение о применении ботулинического токсина А в лечении СР было опубликовано в 2004 г. [72]. В дальнейшем у больных с первичным и вторичным СР были продемонстрированы снижение частоты атак вазоспазма и заживление дигитальных язв, повышение кровотока после введения инъекций ботулинического токсина А в интердигитальную область [73–76]. L. Uppal и соавт. оценивали изменения в течении СР у 20 больных системной склеродермией через 8–12 недель после инъекции 100 единиц ботулинического токсина А в кисть [77]. В 80% случаев наблюдалось уменьшение клинических параметров вазоспазма и интенсивности боли, в 65% – повышение толерантности к холоду. Положительный эффект терапии сохранялся от полутора до шести месяцев.
Считается, что ботулинический токсин А подавляет вазоспазм за счет блокады индуцированной холодом вазоконстрикции и препятствуя транслокации альфа-2с-адренорецепторов на клеточную мембрану гладкомышечных клеток сосудов [74].
Антиагреганты
Как показали длительные наблюдения большого числа больных, комбинация вазоактивных препаратов и антиагрегантов приводит к усилению их действия. Такое сочетание позволяет применять минимально эффективные дозы каждого из препаратов и таким образом уменьшать частоту, а также выраженность побочных эффектов.
Наиболее удобным и безопасным для длительного применения признан пентоксифиллин в дозе 600–1200 мг.
В двойном слепом плацебоконтролируемом исследовании эффективности дипиридамола и плацебо не было выявлено различий таковой [78].
Однако у больных СР, у которых, несмотря на лечение сосудорасширяющими препаратами, развивается критическая ишемия вследствие окклюзии пальцевой артерии, антикоагулянтная терапия с применением низкомолекулярного или нефракционированного гепарина может уменьшить распространение ишемических повреждений.
Заключение
При СР возможно применение препаратов разных классов. В соответствии с рекомендациями экспертов у пациентов с СР при системной склеродермии (как наиболее частом варианте вторичного СР) препаратом первой линии остаются дигидропиридиновые блокаторы кальциевых каналов, препаратами второй линии – ингибиторы ФДЭ-5. При недостаточной эффективности в схему лечения следует включить антагонисты рецепторов эндотелина 1 и/или простаноиды [79].
В то же время течение СР может существенно различаться у разных больных и приводить к серьезным осложнениям. Это требует индивидуального подхода при назначении лекарственной терапии.
Следует отметить, что большинство исследований при СР проводилось в течение короткого периода времени (от нескольких недель до нескольких месяцев), исходы длительного применения отдельных классов препаратов не оценивались.
R.T. Alekperov
Moscow Regional Research and Clinical Institute
V.A. Nasonova Research Institute of Rheumatology
Contact person: Rizvan Tiarovich Alekperov, ralekperov@list.ru
Raynaud’s phenomenon (RP) is an excessive vascular response to cold and emotional stress, which can be idiopathic (primary) or secondary to another condition. In secondary RP, episodes of vasospasm are more pronounced and often lead to ischemic complications, such as skin ulcers and necrosis of the flank of the fingers and feet. Treatment of secondary RP is a mandatory component of the complex therapy of diseases with which this syndrome is associated. In pharmacotherapy RP used drugs
of different classes, which have a vasodilatory effect. In the last decade the list of such drugs has expanded significantly due to vasodilators with different mechanisms of action, the review of which is devoted to this article.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.