Отдельную проблему представляет собой вирус гепатита D, поскольку вызываемое им заболевание медицина сегодня не умеет ни лечить, ни даже контролировать. Пациенты, инфицированные вирусом гепатита D, умирают в течение 5–7 лет от цирроза печени, ГЦР или прогрессирующей декомпенсации заболевания. Поскольку вирусный гепатит D тесно связан с вирусным гепатитом В, основным методом борьбы с этими заболеваниями является вакцинопрофилактика HBV.
В зависимости от активности процесса хронический гепатит В можно классифицировать следующим образом:
- носительство HBsAg (повышение уровня аланинаминотрансферазы (АЛТ) не более 2 норм (N), отсутствие HBeAg в сыворотке крови (-), уровень виремии HBV < 104 копий/мл);
- иммуноактивный гепатит В (АЛТ > 2N, HBeAg (±), уровень виремии HBV > 104 копий/мл);
- иммунотолерантный гепатит В (АЛТ < 2N, HBeAg (+), уровень виремии HBV > 104 копий/мл).
Наибольшую опасность представляет собой иммуноактивный гепатит, сопровождающийся репликацией вируса, реакциями со стороны иммунной системы и цитолизом.
Существующие сегодня препараты (прежде всего – аналоги нуклеозидов) позволяют контролировать процесс репликации, однако прекращение курса лечения, как правило, приводит к возобновлению сборки вирусных копий и дальнейшему прогрессированию заболевания. Более того, через несколько лет непрерывной терапии контроль над репликацией нередко утрачивается из-за появления специфических мутантных штаммов HBV. Скорость развития резистентности напрямую зависит от того, препарат какого поколения получает больной: на фоне использования энтекавира и тенофовира, наиболее современных препаратов из группы аналогов нуклеозидов, резистентность развивается значимо медленнее1. Именно поэтому пациентам с высокой ожидаемой продолжительностью жизни следует назначать препараты последнего поколения.
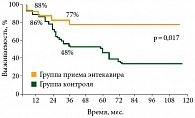
Существуют данные, указывающие на целесообразность продолжения противовирусной терапии энтекавиром даже у пациентов с уже развившимся ГЦР, поскольку данная терапия позволяет контролировать вирусную нагрузку и уменьшает выраженность клинических проявлений цирроза печени и в конечном счете улучшает общую выживаемость (рис. 1)2.
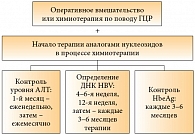
В рекомендациях Американской ассоциации по изучению болезней печени (American Association for the Study of Liver Diseases – AASLD) говорится о необходимости проведения профилактической противовирусной терапии носителям HBsAg в начале курса химиотерапии. То же относится и к иммуносупрессивной терапии – пациенты, у которых обнаружены антитела к HBV, должны получать аналоги нуклеозидов вне зависимости от того, выявляется ли в крови вирусная ДНК или нет (рис. 2).
Несколько иначе выглядит ситуация с гепатитом С. Хотя случаи острого течения заболевания в последнее время регистрируются все реже, проблема хронического гепатита С пока не решена. Помимо ГЦР, HCV-инфекция сегодня ассоциируется с такими онкологическими заболеваниями, как гемобластозы и неходжкинская лимфома3. Кроме того, естественным течением хронического гепатита C считается медленное (в течение десятилетий) прогрессирование заболевания, завершающееся развитием цирроза печени и ГЦР.
В клинической практике нередки случаи, когда у пациента с хроническим гепатитом С, нуждающегося в проведении системной химиотерапии по поводу онкологического заболевания, откладывается начало химиотерапии до завершения противовирусной терапии или достижения авиремии. Как подчеркнул докладчик, этот подход не верен: проведение полихимиотерапии не связано с реактивацией вируса гепатита C вне зависимости от степени фиброза печени или интенсивности воспалительного процесса в печени4.
Проблему, однако, может представлять гепатотоксичность, характерная для полихимиотерапии в целом. Чтобы определить, идет ли в конкретном случае речь о реактивации HCV или о лекарственном гепатите, необходимо корректно трактовать клинико-лабораторные показатели. В частности, следует помнить, что уровень РНК HCV не коррелирует с тяжестью гепатита, а повышение уровня АЛТ и аспартатаминотрансферазы (АСТ) само по себе не свидетельствует о реактивации HCV-инфекции4.
Для лекарственного гепатита, как правило, характерно повышение уровня ферментов холестаза – щелочной фосфатазы (ЩФ) и особенно гамма-глутамилтранспептидазы (ГГТП). Кроме того, выраженность лекарственного гепатита коррелирует с дозой вводимого препарата и отменой лечения. На фоне терапии иммуносупрессорами происходит реактивация HBV-, но не HCV-инфекции, следовательно, у пациентов с хроническим гепатитом C противовирусная терапия как до, так и во время противоопухолевого лечения нецелесообразна.
В целом гепатотоксичность противоопухолевых препаратов представляет собой серьезнейшую проблему5, особенно она актуальна, если речь идет о пациентах, инфицированных вирусом гепатита. Доказанной эффективностью в профилактике гепатотоксичности, индуцированной полихимиотерапией, обладают только два препарата: S-адеметионин6 и урсодезоксихолевая кислота7.
В ходе полихимиотерапии обязателен регулярный мониторинг функции печени для оценки тяжести гепатотоксичности. При этом могут использоваться либо критерии гепатотоксичности, разработанные Национальным институтом рака (National Cancer Institute – NCI), либо функция Мэддрея. При выявлении гепатотоксичности дозы препаратов для химиотерапии должны корректироваться. Согласно рекомендациям AASLD, препаратом выбора для пациентов с вирусными гепатитами и ГЦР является сорафениб – отсутствие гепатотоксичности у этого препарата доказано в ходе масштабных исследований STORM8 и SHARP9. Сочетание доксорубицина и сорафениба используется в клинических исследованиях в группах контроля. Перспективной считается также комбинация сорафениба и бевацизумаба.
В общем виде рекомендации гепатолога у пациентов с вирусными гепатитами и ГЦР можно свести к следующим пунктам:
- пациенты с HBV-инфекцией должны получать профилактическую противовирусную терапию;
- назначение противовирусной терапии пациентам с HCV-инфекцией нецелесообразно;
- лекарственный гепатит может профилактироваться назначением сорафениба в качестве препарата для полихимиотерапии и S-адеметионина или урсодезоксихолевой кислоты в качестве гепатопротектора.
Вопросам лучевой диагностики рака печени был посвящен доклад заведующего отделом лучевой диагностики ФГБУ «Институт хирургии им. А.В. Вишневского», д.м.н., профессора Григория Григорьевича КАРМАЗАНОВСКОГО. Средствами лучевой диагностики может осуществляться и поиск очагового образования в печени, и выяснение его морфологической принадлежности, и оценка распространенности процесса, а также резектабельности и операбельности опухоли. Во время химиотерапии лучевая диагностика используется для оценки ее эффективности.
Характер скрининговых исследований зависит от размеров новообразования: при малых гепатоцеллюлярных опухолях используется ультразвуковая диагностика в сочетании с анализом на альфа-фетопротеин, при обширных новообразованиях применяются такие методы, как ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Степень злокачественности процесса определяется по степени артериализации кровотока.
Компьютерная томография является информативным методом исследования, однако не следует забывать, что при ее использовании пациенты вынуждены взаимодействовать с рентгеновским излучением. Именно поэтому от КТ следует по возможности отказываться в пользу МРТ. Необходимо также уделять достаточно внимания выбору контрастного вещества, поскольку от него напрямую зависит информативность проводимого исследования.
С точки зрения лучевой диагностики можно выделить три типа гепатоцеллюлярного рака:
- ГЦР на фоне нормальной паренхимы;
- фиброламеллярный ГЦР;
- ГЦР на фоне цирроза печени.
ГЦР на фоне нормальной паренхимы без контрастного усиления практически не виден ни на МРТ, ни на КТ. Однако в артериальной фазе можно увидеть зону гиперваскуляризации, поскольку для опухолевого поражения характерна артериализация кровотока. Данный критерий является основным в диагностике ГЦР. На практике это означает, что диагностика ГЦР без применения таких современных методов, как КТ или МРТ с болюсным контрастным усилением, будет малоинформативна.
Фиброламеллярный рак характеризуется, с одной стороны, большими размерами опухоли, с другой – наличием капсулы, внутри которой и происходит рост новообразования. Именно благодаря наличию этой капсулы жизненный прогноз у молодых пациентов, перенесших гепатэктомию, может быть вполне благоприятным.
Гепатоцеллюлярный рак на фоне цирроза печени характеризуется большим количеством жидкости, мелко- и крупноочаговым фиброзом и деформацией контура новообразования. ГЦР при циррозе очень слабо дифференцируется как на КТ, так и на МРТ, поэтому диагноз может быть установлен только на основании целого ряда признаков. Опухоли небольшого размера могут быть гиперконтрастными в артериальной фазе исследования, однако к крупным очагам это не относится – их кровоснабжение падает, и они могут мимикрировать под нормальную паренхиму. Оценивая операбельность и резектабельность новообразования, следует помнить, что опухоль может прорасти (и чаще всего прорастает) в стенку воротной вены – наступает инвазия, образуется тромб. Кроме того, опухоль может распространяться и по системе нижней полой вены, прорастая в правую половину сердца.
Пациенты с ГЦР нуждаются в масштабной и всесторонней лучевой диагностике, поскольку метастазы могут обнаружиться практически в любом органе. Современные методики мультиспиральной томографии позволяют обнаружить, например, мелкие метастазы в легких диаметром порядка 3 миллиметров. Метастазы ГЦР могут располагаться также в надпочечниках, органах брюшной полости, нередко встречаются и костные поражения, которые проще всего обнаружить при помощи КТ.
В настоящее время для проведения МРТ печени используются контрастные вещества трех типов: неспецифические внеклеточные хелаты гадолиния, ретикулоэндотелиальные-специфические вещества (в настоящее время в России не зарегистрированы) и гепатоцит-специфичные вещества. Из последних на территории нашей страны зарегистрирован только препарат Примовист на основе гадоксетовой кислоты. От других гепатоцит-специфичных контрастных веществ Примовист отличается тем, что около 50% введенной дозы выделяется печеночными клетками через экскрецию, что особенно важно для пациентов с печеночной недостаточностью.
Примовист чрезвычайно активно изучается: если в 2010 г. было опубликовано 52 работы, посвященных данному препарату, то в 2013-м их количество составило уже 474. Колоссальный интерес к проблеме позволяет без преувеличения назвать этот метод одним из наиболее перспективных направлений в гепатологии.
Гепатоспецифичность гадоксетовой кислоты обеспечивается достаточно сложным механизмом. После внутривенного введения гадоксетовая кислота быстро распределяется в кровеносном русле, после чего активно поглощается гепатоцитами, что приводит к усилению интенсивности отображения печеночной паренхимы. Из внеклеточного пространства гадоксетовая кислота перемещается в гепатоциты посредством органического анионтранспортного полипептида (OATP1/8), а с помощью канальцевого белка MRP3 и белка-переносчика MRP2 проникает в синусоидальные сосуды и желчные капилляры10, что позволяет использовать Примовист также как средство функциональной диагностики для оценки выделительной функции органа.
Благодаря использованию Примовиста стало возможным обнаружение даже небольших зон, в которых отсутствуют нормальные гепатоциты. Иными словами, при помощи Примовиста можно определять мелкие метастазы, не выявляемые ни одним другим способом. Кроме того, Примовист позволяет дифференцировать фокальную нодулярную гиперплазию, демонстрирующую специфическое накопление препарата в печеночно-специфичной фазе контрастного усиления.
И, наконец, немаловажно, что использование Примовиста сокращает количество больных, нуждающихся в дополнительных исследованиях, что приводит к уменьшению расходов на лечение в целом и снижению нагрузки на аппаратуру и персонал клиники в частности.
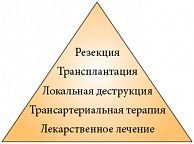
По словам заместителя директора по научной работе ФГБУ «Российский научный центр хирургии им. Б.В. Петровского» РАМН, д.м.н., профессора Олега Григорьевича СКИПЕНКО, место методов лечения ГЦР можно схематично представить в виде лечебной пирамиды, из которой видно, что на сегодняшний день доля агрессивных и радикальных вмешательств невелика – основу лечения при ГЦР по-прежнему составляет лекарственная терапия (рис. 3).
На сегодняшний день в распоряжении онкологов имеется разработанный Европейской ассоциацией по изучению печени (European association for the study of the liver – EASL) алгоритм проведения диагностических мероприятий, используемый при подозрении на ГЦР (рис. 4).
Определение уровня альфа-фетопротеина, по мнению экспертов EASL (2012) и AASL (2010), имеет весьма ограниченную диагностическую ценность. Его повышение на ранних стадиях заболевания наблюдается лишь у 20% больных. Недостаточно высока и специфичность исследования: уровень альфа-фетопротеина может повышаться не только на фоне рака печени, но и при холангиокарциноме и метастазах рака толстой кишки, а также на фоне диффузных болезней печени. Холангиокарцинома, как и ГЦР, развивается на фоне цирроза печени, однако тактика лечения и прогноз этих заболеваний различаются.
Для повышения выявляемости гепатоцеллюлярных заболеваний целесообразно проведение скрининговых исследований в группах риска: среди пациентов с циррозом печени, а также среди инфицированных вирусами гепатита В и С. Согласно данным, полученным в ходе когортного исследования пациентов с циррозом печени, в том числе на фоне HBV-, HCV-инфекции, УЗИ, проводимое у таких пациентов каждые 6 месяцев, позволяет в 63% случаев диагностировать ГЦР на ранних стадиях и в 94% случаев выявить его до развития клинических проявлений заболевания11.
На сегодняшний день при ГЦР применяются следующие виды терапевтических вмешательств: резекция печени, локальная деструкция, трансплантация печени, трансартериальная и лекарственная терапия, а также наиболее часто применяемая сейчас комбинированная лечебная тактика.
Для выбора оптимальной схемы лечения должны учитываться следующие факторы: резектабельность новообразования (локализация очагов, наличие инвазии ворот печени), онкологическая целесообразность (наличие отдаленных метастазов и сосудистой инвазии), состояние печени (наличие цирроза, класс по Чайлду – Пью (Child-Pugh)) и общее состояние пациента (наличие сопутствующего заболевания).
Жизненный прогноз пациента после резекции зависит от нескольких факторов. Прежде всего, это размер опухоли: если диаметр новообразования < 2 см, пятилетняя выживаемость составит 66%, 2,1–5 см – 53%, 5,1–10 см – 37%, > 10 см – 32%12. Пятилетняя выживаемость существенно варьирует в зависимости от методики проведения операции: при анатомической резекции этот показатель составляет 66%, а при неанатомической – всего 35%13. Резекция 4 и более сегментов уменьшает пятилетнюю выживаемость до 40%14.
Наилучшими кандидатами на проведение резекции являются пациенты с солитарным очагом класса А по Чайлду – Пью без портальной гипертензии и с нормальными показателями билирубина. В зависимости от наличия или отсутствия указанных симптомов 5-летняя выживаемость может составлять от 25 до 74%15.
Портальная гипертензия сама по себе не является абсолютным противопоказанием к резекции печени. При резекции < 2 сегментов и функциональном состоянии по Чайлду – Пью класса 5А общая выживаемость не отличается от таковой у пациентов без портальной гипертензии.
Большие размеры опухоли и ее срединная локализация указывают на необходимость проведения обширной резекции, однако на практике она не всегда осуществима. Существуют способы повышения резектабельности, в частности, наращивание левой доли, что, например, позволяет на 19% увеличить количество радикально прооперированных изначально неоперабельных больных колоректальным раком с метастазами в печень16.
Рецидив ГЦР, как правило, бывает обусловлен микрососудистой инвазией, наличием сателлитных опухолей или общим состоянием печени. Наиболее востребованным методом лечения при рецидиве является повторная резекция – она показывает лучшие, чем лекарственная терапия или локальная деструкция, результаты17.
Резекция – не единственный способ хирургического лечения ГЦР. Пациентам с данным заболеванием может быть проведена также трансплантация. Преимущество проведения трансплантации в том, что пациент избавляется как от опухоли, так и от диффузного заболевания печени. Однако дефицит донорских органов в значительной степени затрудняет своевременное проведение подобных операций. Общая выживаемость пациентов, перенесших трансплантацию, в наибольшей степени зависит от суммарного диаметра очагов – если он составляет 10 см и более, выживаемость падает почти в 5 раз.
В процессе подготовки к трансплантации пациенту может быть проведена микроволновая аблация, трансартериальная химиоэмболизация (ТАХЭ) или радиочастотная катетерная аблация (РЧА). Эти процедуры могут привести либо к уменьшению размеров опухоли и количества узлов, что, в свою очередь, позволит выполнить трансплантацию в пределах критериев, либо к стабилизации опухоли и снижению риска прогрессии в листе ожидания.
Наиболее перспективной на сегодняшний день считается комбинированная терапия ГЦР, предполагающая сочетание, например, ТАХЭ с РЧА или ТАХЭ с лекарственной терапией сорафенибом. Присоединение ТАХЭ к РЧА повышает общую и безрецидивную выживаемость и снижает частоту прогрессии опухоли, не оказывая негативного влияния на безопасность лечения18. В лекарственной терапии эффективны комбинации химиотерапевтических и таргетных препаратов.
Резюмируя свое выступление, профессор О.Г. Скипенко акцентировал внимание слушателей на следующих основных
тезисах:
- современное лечение ГЦР базируется на концепции мультидисциплинарного подхода;
- скрининг позволяет выявлять заболевание на ранних стадиях;
- лечебная тактика при ГЦР должна учитывать стадию онкологического процесса и функциональное состояние печени;
- хирургическое лечение ГЦР по-прежнему остается наиболее эффективным методом (при возможности его выполнения);
- комбинация различных видов терапевтических вмешательств является перспективным направлением, требующим дальнейшего изучения.
Таргетная терапия ГЦР
На вопросах выбора таргетных препаратов для лечения нерезектабельного ГЦР остановился ведущий научный сотрудник II хирургического отделения ФГБУ «Российский научный центр хирургии им. Б.В. Петровского» РАМН к.м.н. Николай Николаевич БАГМЕТ. На данный момент сорафениб – единственный препарат, доказавший свою эффективность на поздних (по Барселонским критериям) стадиях ГЦР, наряду с химиоэмболизацией и РЧА. Результаты многочисленных исследований сорафениба19, 20 позволили присвоить препарату высочайший уровень доказательности и силы рекомендаций 1А21. Другие таргетные препараты в этой клинической ситуации оказывались либо неэффективными, либо небезопасными22, 23.
Сообщения о результатах применения сорафениба неизменно вызывают огромный интерес в научном сообществе: в период с 2008 по 2010 г. посвященное сорафенибу исследование SHARP стало самой цитируемой научной работой, обогнав даже работу по исследованию мутаций гена KRAS при колоректальном раке.
Согласно рекомендациям Европейского общества медицинской онкологии 2012 г. (European Society for Medical Oncology – ESMO), целесообразным является использование сорафениба у пациентов с поздней стадией ГЦР, сопровождающейся портальной инвазией и метастазами в лимфоузлы. Использование же препарата у пациентов с промежуточной стадией ГЦР в схеме «ТАХЭ + сорафениб» оказалось по эффективности сопоставимым с комбинацией «ТАХЭ + плацебо»24.
Однако, как уточнил докладчик, говоря о промежуточной стадии ГЦР, следует помнить, что пациенты, находящиеся на данной стадии заболевания, представляют собой весьма неоднородную группу, хотя и объединенную сходными показателями альбумина, билирубина и классом по шкале Чайлда – Пью. Именно поэтому для лечения пациентов с промежуточной стадией ГЦР могут применяться и применяются самые разные терапевтические подходы, в том числе и лечение сорафенибом.
В соответствии с современными клиническими рекомендациями EASL/EORTC, в практике должна применяться так называемая миграция лечения по стадиям. Если та или иная стратегия лечения не подходит пациенту, ему должно быть назначено лечение, предназначенное для следующей по тяжести стадии заболевания. Таким образом, сорафениб назначается пациентам, у которых не может применяться ТАХЭ, и пациентам, у которых заболевание начало прогрессировать на фоне проведения ТАХЭ.
Еще одна группа пациентов с ГЦР, у которых применение сорафениба является целесообразным, – это больные, перенесшие резекцию печени. Конечно, теоретически они должны относиться к пациентам с ГЦР ранней стадии, однако в реальной клинической практике резекция не всегда осуществляется в соответствии с Барселонскими критериями. Многим пациентам операция проводится с опозданием, и рецидивы ГЦР – основная проблема для таких больных.
Рецидив заболевания возникает у 50–70% пациентов, перенесших резекцию печени, причем в большинстве случаев речь идет об истинном рецидиве ГЦР25. И все эти больные нуждаются в достаточно агрессивном хирургическом и терапевтическом лечении. Остальные 30–50% случаев так называемых рецидивов приходятся на ГЦР, возникший de novo. И тут на первый план выходит хемопрофилактика. Имеются данные о целесообразности использования с этой целью пегилированного интерферона, он положительно влияет на общую выживаемость пациентов с вирусным гепатитом С, однако не улучшает выживаемость безрецидивную26. Интерферон повышает функциональные резервы печени и затормаживает развитие цирроза, само по себе являющееся одной из основных причин наступления неблагоприятного исхода у пациентов, перенесших резекцию печени по поводу ГЦР.
В настоящее время идет международное исследование STORM (Sorafenib as adjuvant treatment in the prevention of recurrence of hepatocellular carcinoma), посвященное исследованию применения сорафениба в качестве средства для адъювантной терапии. Сорафениб назначается пациентам, уже перенесшим резекцию, получавшим РЧА и инъекции этанола. Пока данных об эффективности сорафениба в качестве препарата для адъювантной терапии не получено, но предварительные результаты исследования ожидаются уже в ближайшее время.
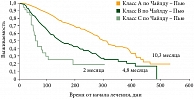
Существуют, однако, данные уже завершенных исследований, посвященных изучению эффективности сорафениба в реальной клинической практике. Это работы GIDEON27, SOFIA28 и INSIGHT. В исследовании GIDEON, например, было показано, что сорафениб безопасен для пациентов различных классов по шкале Чайлда – Пью (рис. 5) и может использоваться при условии сокращения длительности курса у пациентов классов В и С по сравнению с пациентами класса A.
Заключение
Широкая распространенность и плохая выявляемость гепатоцеллюлярного рака заставляют онкологов непрерывно искать новые подходы к лечению пациентов с различными стадиями ГЦР. В настоящее время доказал свою эффективность комбинированный подход, предполагающий использование как хирургических, так и терапевтических методов: РЧА, химиотерапии и таргетной терапии. Препаратом выбора для таргетной терапии ГЦР является мультикиназный ингибитор сорафениб. Он уже доказал свою эффективность и безопасность в лечении поздних стадий ГЦР (в том числе – у пациентов с вирусными гепатитами и циррозом печени), в настоящее время изучается целесообразность его применения у больных с промежуточной стадией ГЦР и в адъювантном режиме.