– В настоящее время в российской фарминдустрии намечается знаковая тенденция: отечественные фармацевтические компании перешли от воспроизводства простых субстанций к разработке собственных инновационных препаратов. Более того, некоторые российские разработки уже дошли до клиник, например, препарат Апагин производства компании «ГЕНЕРИУМ» в настоящее время проходит испытания I фазы на базе РОНЦ им. Н.Н. Блохина. При этом Апагин не единственная перспективная разработка компании «ГЕНЕРИУМ», существует обширный список продуктов этой компании, появления которых в клинической практике мы, врачи-онкологи, ждем с нетерпением. Надеемся на долгое, взаимовыгодное сотрудничество, результатом которого будет выход на наш, а возможно, и на зарубежный рынок новых, высокотехнологичных продуктов, которые изменят результаты лечения российских онкологических больных.
Международный биотехнологический центр «ГЕНЕРИУМ»: фокус на онкологические препараты
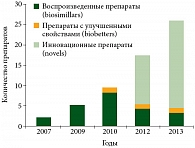
Обозначенную профессором С.А. Тюляндиным тенденцию проиллюстрировал на примере истории развития компании «ГЕНЕРИУМ» директор по науке, к.х.н. Андрей Владимирович ПЕТРОВ. За период с 2007 г. – именно тогда «ГЕНЕРИУМ» разработал, организовал современное производство и вывел на рынок Российской Федерации первый в мире воспроизведенный препарат рекомбинантного фактора свертывания крови человека VIIa – Коагил-VIIа для лечения гемофилии – компания проделала огромный путь, позволивший ей уже к 2012 г. полностью отказаться от разработки технологий выпуска дженериков и сконцентрироваться на оригинальных препаратах (рис. 1).
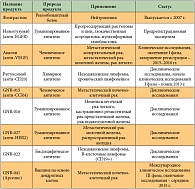
Официальному открытию Международного биотехнологического центра (МБЦ) «ГЕНЕРИУМ» и созданию производственной компании ЗАО «ГЕНЕРИУМ», состоявшемуся в 2009 г., предшествовала огромная работа, в результате которой сегодня компания «ГЕНЕРИУМ» занимает лидирующую позицию среди российских инновационных фармацевтических компаний. Основная цель «ГЕНЕРИУМ» – разработка, производство и внедрение высокоэффективных, инновационных, качественных лекарственных препаратов для лечения и диагностики социально значимых заболеваний. На сегодняшний день в портфолио компании присутствуют препараты для лечения различных нозологий – гематологических, нейродегенеративных, аутоиммунных и других заболеваний. Однако одним из наиболее приоритетных направлений деятельности компании «ГЕНЕРИУМ» является разработка препаратов онкологического профиля (табл. 1).
Фактически «ГЕНЕРИУМ» представляет собой группу компаний, в состав которой входят «МБЦ «ГЕНЕРИУМ», деятельность которого направлена на научные разыскания и разработку инновационных биотехнологических препаратов, и ЗАО «ГЕНЕРИУМ», инициирующее проведение клинических исследований, занимающееся регистрацией новых препаратов и, что немаловажно, организацией российского высококачественного производства биотехнологических препаратов. Препараты из портфолио группы компаний
«ГЕНЕРИУМ» сегодня находят применение не только в России, но и далеко за ее пределами.
Группу компаний «ГЕНЕРИУМ» можно назвать уникальным для России проектом. Центры разработки и производства лекарственных средств компании «ГЕНЕРИУМ» объединены как функционально, так и географически. Усилия всех сотрудников компании направлены на то, чтобы обеспечить российских пациентов высококачественными препаратами, более доступными, нежели те, что приходят к нам из-за рубежа. В портфолио компании находятся наиболее востребованные бренды, являющиеся лидерами в сегментах федеральных программ.
«МБЦ «ГЕНЕРИУМ», расположенный в 100 км от Москвы, занимает площадь в 75 га. На этой территории располагается не только сам институт, но и жилые дома, а также здания, составляющие инфраструктуру научного парка. В институте постоянно работают 120 сотрудников, 75 из которых непосредственно занимаются научной деятельностью.
Биотехнологический центр «ГЕНЕРИУМ» насчитывает 7 подразделений, занимающихся разработкой высокоэффективных биотехнологических препаратов. Это отделы разработки антител, клеточной биологии, разработки технологий, химии белка, аналитических методов, а также центр доклинических исследований и экспертный отдел. В распоряжении компании имеется весь необходимый инструментарий для разработки высокоспецифичных моноклональных антител, полностью человеческих по своей природе, а также все, что нужно для успешной культивации и переноса лабораторных результатов в производство.
Отдельного упоминания заслуживает отдел аналитических методов, сотрудники которого осуществляют непрерывный контроль качества продуктов группы компаний «ГЕНЕРИУМ» на стадии разработки препаратов. В дальнейшем эти методы адаптируются для условий промышленного производства, что позволяет группе компаний «ГЕНЕРИУМ» производить фармацевтическую продукцию, отвечающую самым высоким мировым стандартам качества.
В настоящее время компания «ГЕНЕРИУМ» запускает проект строительства бизнес-инкубатора, аналогичного американским и европейским биотехнологическим хабам. Целью этого проекта является привлечение новых идей, которые имеют потенциал в плане создания новых средств терапии или диагностики заболеваний. Когда проект будет завершен, научный парк компании «ГЕНЕРИУМ» пополнится двумя дополнительными лабораторными корпусами общей площадью 4500 кв. м, на которых с комфортом разместятся стартап-компании, работающие в сфере биотехнологий. Однако уже сейчас компания «ГЕНЕРИУМ» проводит совместные исследования в рамках бизнес-инкубатора с учеными других стран, являющимися зачастую нашими бывшими соотечественниками, предоставляя им возможность реализовать собственные идеи на территории России.
Производством препаратов, разрабатываемых в научном центре, занимается ЗАО «ГЕНЕРИУМ». Производственный комплекс ЗАО «ГЕНЕРИУМ» работает в строгом соответствии с ГОСТ Р 52249-2009 «Правила производства и контроля качества лекарственных средств», стандартом GMP (Good Manufacturing Practice, Надлежащая производственная практика). Уже налажен выпуск 6 лекарственных средств (все они входят в список Жизненно необходимых и важнейших лекарственных препаратов – ЖНВЛП), на стадии клинических исследований находятся 4 препарата, доклинических – 9, еще 14 лекарственных средств в настоящее время разрабатываются. В общей сложности портфолио компании «ГЕНЕРИУМ» состоит более чем из 40 препаратов. Основной вектор развития компании – разработка и внедрение в клиническую практику оригинальных препаратов. Уже в ближайшее время можно ожидать пополнения портфолио за счет препаратов для иммунотерапии онкологических заболеваний.
Апагин – новый селективный антиангиогенный препарат
Одним из недавно разработанных препаратов компании «ГЕНЕРИУМ» является Апагин (генериумаб), который слушателям симпозиума представил менеджер проектов «МБЦ «ГЕНЕРИУМ» Александр Батадзович КОЧИЕВ. Апагин представляет собой полностью человеческое моноклональное антитело (IgG) к фактору роста сосудистого эндотелия (VEGF – Vascular endothelial growth factor). Апагин способен селективно блокировать взаимодействие VEGF с VEGF-рецепторами второго типа (VEGFR2), не влияя на взаимодействие с VEGF-рецепторами первого типа (в отличие от бевацизумаба). Ингибирование опосредованной VEGFR2 миграции эндотелиальных клеток и внутриклеточного каскада фосфорилирования приводит к угнетению ангиогенеза и замедлению роста опухоли. От ближайшего аналога – бевацизумаба Апагин кардинально отличается по структуре, аффинности к VEGF и фармакодинамике.
Апагин уже прошел обширную программу доклинических фармакологических, фармакокинетических и токсикологических исследований, включая модели специфического взаимодействия in vitro и in vivo различных опухолей на грызунах. В частности, было показано, что препарат обладает высокой противоопухолевой активностью как в моно-, так и в комбинированной терапии с химиопрепаратами первой линии. Апагин исследовался на моделях рака легкого, поджелудочной железы, молочной железы и колоректального рака. В последнем случае Апагин был включен в схему комбинированной терапии (на основе 5-фторурацила, или иринотекана, или комбинации 5-фторурацила с иринотеканом), на фоне которой удалось снизить плотность кровеносных сосудов в опухоли на 50% и существенно замедлить скорость роста опухоли. В составе комбинированной терапии Апагин продемонстрировал ярко выраженный аддитивный эффект.
В ходе доклинических исследований Апагина была отмечена не только высокая эффективность, но и хорошая переносимость препарата в интервале доз от 20 до 180 мг/кг. Так, яванским макакам Апагин вводился 26-недельными курсами, при этом значимых признаков токсичности не наблюдалось. В ходе исследований токсичности использовался интервал доз 20–214 мг/кг, что существенно выше значений, которые предполагается применять у людей.
В целом полученные в ходе доклинических исследований данные позволяют предположить, что применение Апагина у человека будет характеризоваться более высоким профилем безопасности, чем других препаратов той же фармакотерапевтической группы. В отличие от бевацизумаба, например, Апагин не влияет на заживление ран. Было также установлено, что некоторые опухоли, резистентные к бевацизумабу, чувствительны к Апагину.
На сегодняшний день практически завершено исследование I фазы и запланированы исследования II и III фазы у пациентов с онкологическими и офтальмологическими заболеваниями. Пока препарат принимали 32 пациента с гистологически подтвержденными метастатическими солидными опухолями, не подлежащими хирургическому лечению и радиочастотной аблации в фазе стабилизации или при отсутствии доступных альтернативных способов лечения (колоректальный рак, рак желудка, гепатоцеллюлярный рак, почечно-клеточный рак, немелкоклеточный рак легкого, рак яичников, рак молочной железы, нейроэндокринные опухоли). Включенные в исследование пациенты разделены на 4 группы в зависимости от принимаемой дозы препарата – 1, 5, 10 или 15 мг/кг, каждая доза вводится на 1-й, 29-й, 43-й и 57-й дни исследования. Оценка переносимости однократной дозы осуществляется в течение первых 4 недель, оценка безопасности многократных доз и исследование фармакокинетики – в течение 10 недель. К настоящему времени случаев проявления дозолимитирующей токсичности выявлено не было.
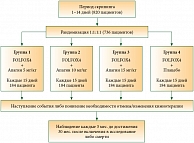
После окончания многоцентрового исследования I фазы, которое проводится в том числе в РОНЦ им. Н.Н. Блохина, будет запущено многоцентровое, проспективное, рандомизированное плацебоконтролируемое двойное слепое исследование в параллельных группах, в ходе которого будет изучена эффективность и безопасность трех доз Апагина в сочетании с химиотерапией (Апагин + протокол FOLFOX) по сравнению со стандартной химиотерапией у пациентов с метастатическим колоректальным раком (рис. 2). В ходе исследования планируется оценить влияние на выживаемость без прогрессирования заболевания у 700–850 пациентов.
Доклад Александра ДУНКАНА (Alexander DUNCAN, PhD) – научного директора датской компании «Аффитех» (Affitech) – был посвящен новой мишени таргетной терапии, соответственно, новому подходу к лечению солидных опухолей. Говоря об онкологических заболеваниях, следует помнить, что рак как совокупность патологических процессов не сводится к образованию и размножению измененных клеток. Рак – это еще и нарушение работы иммунной системы. Сфокусировавшись на иммунологических аспектах терапии онкологических заболеваний, можно повысить эффективность лечения.
Один из подходов к иммунотерапии онкологических заболеваний предполагает ингибирование хемокинового рецептора CCR4. Данный рецептор экспрессируется на T-клетках определенных подтипов: в первую очередь – на T-регуляторных клетках (Treg) и T-хелперных клетках 2-го типа (Th2), а также на базофилах, натуральных киллерах (NK-клетки), дендритных клетках.
Основная роль CCR4, как и других хемокиновых рецепторов, сводится к организации адекватного корректно локализованного иммунного ответа за счет миграции и хоуминга T-клеток. Однако рецепторы CCR4 также участвуют в создании иммуносупрессивной микросреды опухоли. Предполагается, что уничтожение CCR4-несущих клеток или ингибирование данного рецептора способно преодолеть этот иммуносупрессивный эффект и нормализовать работу иммунной системы.
Экспрессия CCR4 наблюдается, прежде всего, в раковых клетках, происходящих от T-лимфоцитов, например, в клетках узловой Т-клеточной лимфомы или Т-клеточного лейкоза взрослых. Но помимо этого CCR4 определяется и в клетках солидных опухолей, например, рака почки, желудка, пищевода, молочной железы и др. Кроме того, у пациентов с повышением экспрессии CCR4 наблюдается также изменение экспрессии лигандов. Измерение последнего показателя, предположительно, может служить биомаркером ответа на терапию ингибиторами
CCR4.
Для создания эффективного и безопасного биотехнологического препарата, ингибирующего CCR4, потребовалось провести целую серию последовательных скринингов природных антител человека. В итоге было получено антитело Affi-503, способное не просто связываться с CCR4-рецепторами, но и эффективно блокировать сигнальные пути, активируемые соответствующими лигандами.
Оценка эффективности нового антитела Affi-503 проводилась на животной модели плоскоклеточной почечной карциномы. Многочисленные проведенные исследования показали, что введение антитела приводит к специфическому и эффективному снижению роста опухоли по сравнению с контрольным антителом. Кроме того, у мышей, получавших Affi-503, достоверно снижался уровень циркулирующего в сыворотке крови хемокина CCL17, лиганда CCR4.
В ходе эксперимента оценивались различные показатели, в том числе количество маннозных рецепторов, уровень MHC II и другие параметры, связанные с макрофагами, окружающими опухоль. Оказалось, что использование Affi-503 способствовало изменению структуры популяции макрофагов опухолевого микроокружения – вместо макрофагов, поддерживающих рост опухоли, стали преобладать макрофаги, его подавляющие. Кроме того, был зарегистрирован рост численности
NK-клеток.
Когда исследования только запускались, Affi-503 рассматривался как средство, предположительно способное убивать раковые клетки. Но в ходе работы стало ясно, что механизм действия данного антитела принципиально иной: под воздействием Affi-503 у животных, участвовавших в экспериментах, менялась модель иммунного ответа с иммуносупрессивной на адаптивную, то есть иммунная система пораженного опухолью животного начинала эффективно бороться с опухолью.
Если применение Affi-503 у людей приведет к схожим результатам, существенного роста выживаемости без прогрессирования на фоне применения препарата, возможно, не произойдет, но увеличится число продолжительных ответов на лечение. Немаловажно также, что уже сегодня известны биомаркеры, позволяющие выделить пациентов, которые ответят на лечение, а значит, совсем скоро следует ожидать перемен в лечении онкологических заболеваний.
Нимотузумаб – перспективы в России
Нимотузумаб является биотехнологическим препаратом, относящимся к группе ингибиторов рецептора эпидермального фактора роста (epidermal growth factor receptor – EGFR). Как отметил Владимир Евгеньевич БОКОВАНОВ, руководитель экспертного отдела ООО «МБЦ Генериум», нимотузумаб был разработан на Кубе в 1999 г., то есть с момента появления препарата прошло более 10 лет – все это время нимотузумаб активно изучался, было проведено около 30 исследований, причем работы по изучению препарата активно ведутся до сих пор в разных странах.
Регистрацией и маркетингом препарата на территории России займутся ООО «МБЦ «ГЕНЕРИУМ» и ЗАО «ГЕНЕРИУМ», трансфер будет осуществляться в рамках Государственного контракта с Минпромторгом РФ.
Нимотузумаб несколько отличается от других препаратов, блокирующих EGFR-рецептор. Он характеризуется средней аффинностью к EGFR, что позволяет нимотузумабу относительно селективно связываться только с теми тканями, где плотность данного рецептора велика – злокачественными опухолями, – в меньшей степени затрагивая здоровые ткани с небольшой плотностью EGFR. Существуют также данные, указывающие на то, что высокоаффинные антитела обладают меньшей биодоступностью для опухолевых тканей, наибольшая же биодоступность в опухоли наблюдается приблизительно при той аффинности, которая характерна для нимотузумаба.
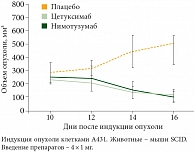
Умеренная аффинность нимотузумаба не повлияла на его способность уменьшать размеры опухоли. В ряде in vivo экспериментов было продемонстрировано, что данный показатель у нимотузумаба и у высокоаффинных ингибиторов EGFR сопоставим (рис. 3).
Одной из целей создания нимотузумаба было уменьшение количества побочных эффектов, типичных для курсов лечения высокоаффинными ингибиторами EGFR, например, цетуксимабом. Эта цель была достигнута: на фоне применения нимотузумаба не развивается гипомагниемия и не наблюдается поражений желудочно-кишечного тракта 3–4-й степени. Кроме того, при сочетании курса нимотузумаба с курсами химио- или радиотерапии токсичность последних у пациентов с плоскоклеточным раком головы и шеи и глиомой не повышается. На фоне приема нимотузумаба существенно реже, чем при использовании цетуксимаба, развиваются такие нежелательные явления, как озноб, лихорадка, головная боль и астения. Наиболее значимым является то, что нимотузумаб отличает достоверно меньшая дерматотоксичность, которая зачастую ограничивает применение иных ингибиторов EGFR.
В России препарат планируется использовать для лечения глиом и рака головы и шеи. Эффективность нимотузумаба в отношении повышения общей выживаемости пациентов с данным диагнозом доказана рядом исследований, проводившихся, в частности, на Кубе – в стране, где распространенность рака головы и шеи существенно выше, чем в России. В одно из таких исследований
(IIC RD-EC055) были включены 106 пациентов с плоскоклеточным раком головы и шеи III–IV стадии, подлежащие радиотерапии, не леченные ранее. В группе пациентов, получавших нимотузумаб, медиана общей выживаемости составила 22,71 месяца, а в группе плацебо – 12,5 месяца (табл. 2).
Другая работа, в которой нимотузумаб использовался в комплексе с химиорадиотерапией (h-R3/SCCHN/001/IND), показала еще большую эффективность препарата. В исследование были включены 92 пациента с плоскоклеточным раком головы и шеи III–IVA стадии, подлежащие радиотерапии, не леченные ранее. В соответствии с дизайном исследования пациенты получали либо нимотузумаб в сочетании с химиотерапией цисплатином (50 мг 1 р/нед) и радиотерапией (60–66 Гр 1 р/нед), либо химиотерапию в сочетании с радиотерапией, либо нимотузумаб и радиотерапию, либо только радиотерапию. В первой группе количество объективных ответов составило 100%, в то время как в последней – 37% (табл. 3). Планируется также применение препарата для лечения глиомы у детей. Возможность такого использования нимотузумаба подтверждена исследованием OSAG 101-BSC-05, показавшим, что эффективность терапии нимотузумабом сопоставима с химиорадиотерапией, при этом частота развития нежелательных явлений при использовании нимотузумаба существенно меньше.
В заключение докладчик подчеркнул, что применение нимотузумаба целесообразно лишь у пациентов с высоким уровнем экспрессии EGFR, что ограничивает применение препарата либо опухолями, для которых характерен рост экспрессии EGFR, либо пациентами, прошедшими соответствующий скрининг.
Arcelis – новое поколение дендритно-клеточных вакцин: применение для лечения почечно-клеточного рака
О технологии Arcelis рассказал к.б.н., эксперт-аналитик ООО «МБЦ «ГЕНЕРИУМ» Илья Вячеславович ЩЕГЛОВ. Arcelis представляет собой не препарат, а персонализированную иммунотерапевтическую платформу, ключевым звеном которой являются аутологичные дендритные клетки. Флагманский продукт платформы AGS-003 в настоящее время проходит международные клинические испытания III фазы по показанию «метастатическая почечно-клеточная карцинома».
Платформа Arcelis характеризуется высокой мобильностью, при необходимости она легко может быть модифицирована и усовершенствована, а список показаний к применению данной технологии может быть существенно расширен.
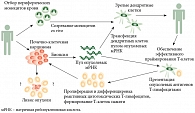
В алгоритме использования платформы Arcelis (рис. 4) можно выделить два ключевых момента, отличающих данную платформу от аналогичных разработок. Во-первых, для работы используется тотальный пул опухолевых мРНК, трансфицируемых в дендритные клетки методом электропорации. Это позволяет презентировать опухолевые антигены в контексте MHC I и MHC II, а не только МНС II, как это происходит при обработке дендритных клеток лизатом опухолевых клеток.
Использование тотального пула опухолевых мРНК позволяет технологии Arcelis достигать максимального охвата опухолевых антигенов. Это чрезвычайно важно, поскольку, по данным последних научных исследований, раковые клетки демонстрируют высочайшую гетерогенность, а эффективность лечения напрямую зависит от способности препарата или метода «охватить» все имеющиеся разновидности клеток опухоли.
Клеточный продукт AGS-003 помимо раковых антигенов на своей поверхности также содержит CD40L. В естественных условиях дендритные клетки не экспрессируют этот лиганд, но экспрессируют соответствующий рецептор, взаимодействуя с которым, CD40L запускает процесс «самоактивации» дендритных клеток, не зависящий от CD4+ Т-клеток. Этот процесс необходим, поскольку активность CD4+ T-хелперных-клеток, осуществляющих активацию дендритных клеток в нормальных условиях, в иммуносупрессивной среде опухоли оказывается подавлена. Использование технологии Arcelis делает дендритные клетки не зависящими от активации со стороны CD4+ T-хелперов.
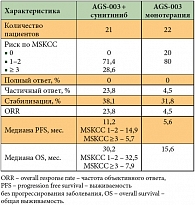
Флагманский продукт технологии Arcelis AGS-003 уже прошел клинические испытания II фазы по почечно-клеточной карциноме, где было продемонстрировано, в частности, что наибольшей эффективности можно достичь при использовании его у пациентов со средним риском по прогностической шкале MSKCC (Memorial Sloan-Kettering Cancer Center – Мемориальный онкологический центр им. Слоуна-Кеттеринга). Для уточнения полученных данных компания провела еще одно исследование II фазы, в которое были включены пациенты со средним и высоким риском по MSKCC. AGS-003 в этой работе применялся в виде мототерапии либо в сочетании с существующим стандартом терапии – сунитинибом. В группе, где пациенты получали комбинированную терапию, лечение AGS-003 начиналось после завершения курса сунитиниба.
Самым важным результатом работы, безусловно, был двукратный прирост выживаемости в группе, получавшей терапию сунитинибом и AGS-003 (табл. 4). Выживаемость более 30 месяцев в группе комбинированной терапии составила 52%, аналогичный же показатель у пациентов сходных групп риска, находившихся на монотерапии либо AGS-003, либо сунитинибом, составил 23 и 13% соответственно. Существенным моментом является то, что 7 из 28 пациентов экспериментальной группы до сих пор живы – уже на протяжении 4 лет, несмотря на предварительный неблагоприятный прогноз в 14–16 месяцев.
AGS-003 продемонстрировал благоприятный профиль безопасности: нежелательных явлений 3–4-й степени, связанных с применением AGS-003, зарегистрировано не было. На фоне применения AGS-003 у большинства пациентов наблюдался иммунологический ответ. У 73% пациентов было зарегистрировано повышение опухоль-специфичных TCM и TEM, а также снижение CD4+CD25+ (Тreg) после введения 5 доз.
В настоящее время технология Arcelis проходит международные клинические испытания III фазы в 130 центрах по всему миру: уже набрано 90 из 450 запланированных пациентов. В качестве первичного критерия решено использовать первичную выживаемость, ожидаемое увеличение этого показателя составляет 6 месяцев.
Заключение
За последние годы арсенал терапевтических подходов к лечению онкологических заболеваний существенно расширился. К традиционной химиотерапии добавились биотехнологические таргетные препараты; получил распространение иммунологический подход, предполагающий воздействие не на опухолевые клетки, а на клетки иммунной системы, работа которых в отсутствие иммунотерапии нарушается создаваемой опухолью средой.
Состав портфолио компании «ГЕНЕРИУМ» отражает актуальные тенденции терапии онкологических заболеваний: в нем присутствуют препараты различных фармацевтических групп, воздействующие на разные звенья патогенеза онкологических заболеваний. Это и ингибитор ангиогенеза Апагин (генериумаб), и ингибитор EGFR нимотузумаб, и персонализированная иммунотерапевтическая платформа Arcelis. Разработки компании «ГЕНЕРИУМ» либо уже используются в клинической практике, либо проходят завершающие стадии испытаний. Ожидается, что по мере распространения препаратов, выпускаемых группой компаний «ГЕНЕРИУМ», инновационные подходы к лечению онкологических заболеваний станут более доступными для российских пациентов.