Повышение резектабельности метастазов как фактор увеличения общей выживаемости
Как повысить общую выживаемость у пациентов с метастатическим колоректальным раком
- Аннотация
- Статья
- Ссылки


![Рис. 3. Сравнение эффективности и частоты резекции печени у пациентов с мКРР и диким типом гена KRAS в исследованиях CRYSTAL, OPUS, CELIM и POCHER (адаптировано по [10, 13, 16])](/upload/resize_cache/iblock/06b/195_350_1/06ba40e3c4e36b235969ae04180757d6.jpg)
Как подчеркнул Николай Владимирович ЖУКОВ (к.м.н., руководитель отдела лекарственного лечения ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России, заведующий отделением оптимизации лечения онкологических заболеваний у подростков и взрослых ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Д. Рогачева» Минздрава России, доцент кафедры онкологии ФГБУ «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России), во многом благодаря появлению таргетных препаратов, в том числе моноклональных антител, больные метастатическим колоректальным раком (мКРР) стали жить значительно дольше. На фоне современной терапии с использованием новых противоопухолевых препаратов медиана выживаемости без прогрессирования выросла до 10 месяцев (на фоне применения химиотерапии по схеме FOLFIRI в сочетании с цетуксимабом или бевацизумабом), а медиана общей выживаемости за последние 15 лет увеличилась почти в 4 раза и достигла 29 месяцев (на фоне режима «FOLFIRI + цетуксимаб»)1. Для проведения 1-й линии химиотерапии при мКРР в арсенале онколога есть такие препараты с доказанной эффективностью, как комбинация 5-ФУ/ЛВ (5-фторурацил + лейковорин), капецитабин, оксалиплатин, иринотекан, ралтитрексид, которые используются в различных комбинациях (IFL, FOLFOX/XELOX, FOLFIRI/ XELIRI, FOLFOXIRI).
Однако одновременно с улучшением результатов лечения происходит и увеличение его стоимости. «К сожалению, реальность такова, что мы не в состоянии обеспечить всех нуждающихся пациентов необходимым им лечением с включением новых таргетных препаратов», – констатировал докладчик2. Следует отметить, что ситуация с ограничением использования эффективных, но дорогостоящих препаратов характерна не только для России, но и для более благополучных стран – например, в Великобритании за счет Национальной системы здравоохранения (National Health Service – NHS) предоставляется только цетуксимаб для индукционной терапии при потенциально операбельных метастазах в печень, а бевацизумаб, цетуксимаб для паллиативного лечения, панитумумаб, афлиберцепт и регорафениб не предоставляются по причине превышения установленного барьера стоимости за год продленной жизни с поправкой на ее качество (quality-adjusted life-year – QALY). По мнению Н.В. Жукова, одна из основных проблем отечественной практики – нерациональное использование дорогостоящих препаратов. На практике они часто используются вне показаний и/или по неоптимальным показаниям, в связи с чем многим больным их просто не хватает и терапия им не предоставляется под различными предлогами.
Для преодоления сложившейся ситуации следует определить оптимальный алгоритм использования «новых» препаратов, что позволит обеспечить ими хотя бы группы пациентов, в наибольшей степени выигрывающих от лечения. А вычленить эти группы помогает поиск предсказательных факторов. Адресное назначение препаратов может осуществляться не только по факторам, предсказывающим эффект в зависимости от наличия или отсутствия молекулярных маркеров, но и по цели применения (перевод в операбельное состояние, паллиативная терапия), по желаемому эффекту (максимальная циторедукция, быстрый ответ, сдерживание прогрессирования заболевания), по цене (возможность пролечить больше больных в рамках одного бюджета).
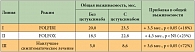
Если говорить об адресном назначении препаратов исходя из возможности предсказания эффекта при КРР, то такой фактор определен для моноклональных антител к рецептору эпидермального фактора роста (epidermal growth factor receptor – EGFR) (цетуксимаб, панитумумаб) – это отсутствие мутации гена KRAS. Для препаратов, представляющих собой моноклональные антитела к фактору роста сосудистого эндотелия (vascular endothelial growth factor – VEGF) (бевацизумаб, афлиберцепт, регорафениб), фактор, который бы позволял прогнозировать успех терапии, не выявлен. Этот тезис докладчик проиллюстрировал данными исследований по изучению эффективности цетуксимаба и бевацизумаба в 1-й линии терапии мКРР.
Так, в масштабном исследовании CRYSTAL 1198 ранее не леченных пациентов с мКРР рандомизированно распределили на две группы: пациенты в одной группе получали химиотерапию по схеме FOLFIRI, а пациентам второй группы к режиму FOLFIRI добавляли цетуксимаб. Добавление цетуксимаба к химиотерапии позволило статистически значимо увеличить выживаемость без прогрессирования с 8 до 8,9 месяца (p < 0,05) и частоту объективного ответа с 38,7% до 46,9% (p < 0,05), однако магнитуда выигрыша не была столь значительной, как хотелось бы3. Позже было показано, что при наличии мутации протоонкогена KRAS (наблюдается почти у 40% больных колоректальным раком) использование моноклональных антител к EGFR не приводит к улучшению результатов лечения, и наоборот, у пациентов с диким геном KRAS назначение цетуксимаба привело к увеличению магнитуды выигрыша от лечения (табл.). Сегодня тест на мутацию гена KRAS у пациентов с мКРР стал обязательным во всем мире, доступен он и в нашей стране.
Изучалась и эффективность применения анти-VEGF препаратов в качестве 1-й линии терапии при мКРР. Как показали данные крупного рандомизированного плацебоконтролируемого исследования NO16966, в которое были включены 2034 ранее не леченных пациента с колоректальным раком, добавление бевацизумаба к химиотерапии по схеме FOLFOX4 или XELOX не привело к статистически значимым различиям по параметру «объективный эффект» – 49,2% в группе химиотерапии против 46,5% в группе пациентов, которым был добавлен бевацизумаб, а также по параметру «общая выживаемость» – 19,9 месяца против 21,2 месяца соответственно. В группе терапии бевацизумабом достоверно увеличилась только выживаемость без прогрессирования – с 8 до 9,4 месяца (p < 0,05)4.
В ходе клинического исследования III фазы FIRE-3 было проведено прямое сравнение (head-to-head) цетуксимаба (Эрбитукс) и бевацизумаба в 1-й линии терапии мКРР. При этом, по мнению докладчика, сопоставлялись не только два препарата, но и стратегические подходы к их назначению: цетуксимаб назначался по известному предсказательному фактору – дикий тип KRAS, а бевацизумаб – в соответствии с заявленным «универсальным» принципом действия (можно назначать всем пациентам, так как факторы отбора на лечение пока не выявлены)1. В исследовании приняли участие 592 пациента, ранее не леченные по поводу мКРР, с наличием дикого типа гена KRAS, рандомизированные на получение химиотерапии в режиме FOLFIRI в сочетании с цетуксимабом (1-я группа) или бевацизумабом (2-я группа). Полученные данные показали, что у пациентов в группе применения цетуксимаба (Эрбитукс) в комбинации с FOLFIRI медиана общей выживаемости составила 28,5 месяца по сравнению с 25 месяцами у пациентов в группе приема бевацизумаба в комбинации с FOLFIRI (отношение рисков (ОР) 0,77, 95% доверительный интервал (ДИ) 0,62–0,96). Таким образом, цетуксимаб (Эрбитукс) в комбинации с FOLFIRI продемонстрировал более высокую эффективность в 1-й линии терапии больных мКРР с диким типом гена KRAS в опухоли по сравнению с бевацизумабом в той же комбинации. «В данном случае был использован правильный препарат в правильное время у правильных больных – то есть у больных, отобранных в зависимости от наличия маркера предсказания эффекта. Результат, который мы получили, – пациенты стали жить дольше», – пояснил Н.В. Жуков.
Другим примером адресности назначения «новых» препаратов служит таргетность по месту применения. Так, бевацизумаб, не показавший увеличения общей выживаемости в качестве 1-й линии лечения при комбинации FOLFOX/XELOX, продемонстрировал значимо более высокую эффективность во 2-й линии терапии в комбинации с FOLFOX4 по сравнению с химиотерапией в режиме FOLFOX45.
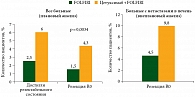
Таргетность по цели применения – еще один способ адресного назначения лекарственного средства. Применительно к лечению больных мКРР – это попытка с помощью лекарственной терапии перевести больного в операбельное состояние при потенциально операбельных метастазах КРР либо достижение более «глубокой» ремиссии при паллиативной терапии. Куративная (R0) резекция, бесспорно, дает пациентам шанс на излечение и на длительную выживаемость6, 7. Каковы возможности бевацизумаба и цетуксимаба при неоадъювантном (индукционном) назначении? Как показало исследование CRYSTAL, благодаря использованию цетуксимаба в комбинации с режимом FOLFIRI удалось увеличить процент больных, достигших резектабельного состояния3 (рис. 1). Добавление бевацизумаба к современным режимам химиотерапии в 1-й линии терапии мКРР, как упоминалось выше, не приводит к увеличению частоты достижения ремиссии4.
Назначение паллиативной терапии также предполагает селекцию больных и представляет значимость только для тех неоперабельных пациентов, которые способны перенести комбинированное лечение и имеют риск значительного ухудшения состояния в ближайшее время.
Цетуксимаб также зарегистрирован в 3-й линии терапии (в качестве монотерапии) у пациентов с мКРР, у которых заболевание прогрессировало после химиотерапии. Причем и в этом случае назначение цетуксимаба более эффективно у пациентов с диким типом гена KRAS. Так, в исследовании D.J. Jonker и соавт., в которое было включено 572 пациента, ранее леченных флуоропиримидином, иринотеканом и оксалиплатином, добавление цетуксимаба к наилучшему симптоматическому лечению позволило увеличить общую выживаемость у всех больных с 4,57 до 6,14 месяца, а у больных без мутации гена KRAS – с 5 до 8,6 месяца8.
Существуют данные по продолжению терапии бевацизумабом у пациентов после прогрессирования болезни на бевацизумабсодержащих химиотерапевтических режимах в 1-й линии терапии. Согласно данным, полученным D. Arnold и соавт., у пациентов, продолживших принимать бевацизумаб во 2-й линии, медиана общей выживаемости составила 11,2 месяца по сравнению с 9,8 месяца у пациентов, у которых бевацизумаб был отменен, но продолжена химиотерапия; выживаемость без прогрессирования – 5,7 против 4,1 месяца соответственно9. Таким образом, применение бевацизумаба во 2-й линии терапии в комбинации с химиотерапевтическими режимами демонстрирует наилучшие результаты.
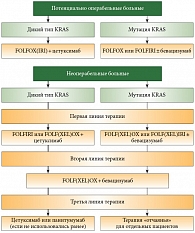
Что с точки зрения практического здравоохранения дает адресный подход к назначению таргетных препаратов больным мКРР? Наряду с увеличением выживаемости пациентов и улучшением качества их жизни рациональное использование моноклональных антител позволяет в пределах одной и той же суммы пролечить большее количество пациентов. Таким образом, если препараты являются равноэффективными, выбор препарата должен определяться более низкой стоимостью лечения на один клинический случай. Исходя из вышесказанного, докладчик представил алгоритм ведения больных мКРР с учетом применения моноклональных антител (рис. 2). В первой линии терапии как у потенциально операбельных, так и
у потенциально неоперабельных больных мКРР показано использование современных режимов химиотерапии (FOLFOX или FOLFIRI), причем при диком гене KRAS рекомендовано добавление цетуксимаба, а при наличии мутации гена KRAS возможно (±) добавление бевацизумаба. Во 2-й линии терапии у всех пациентов рекомендовано применение бевацизумаба в комбинации с химиотерапией. В качестве 3-й линии терапии у пациентов с диким геном KRAS рекомендовано использование цетуксимаба или панитумумаба, если эти препараты не назначались ранее, а у пациентов с мутацией гена KRAS показано лишь паллиативное лечение.
В заключение Н.В. Жуков подчеркнул, что сегодня моноклональные антитела стали неотъемлемой частью лечения злокачественных опухолей, а при рациональном использовании этих препаратов – в соответствии с медицинскими показаниями – мы сможем оказать помощь гораздо большему количеству больных при сопоставимых затратах на лечение.
Только 20% больных КРР с метастазами в печени потенциально операбельны, у 80% печеночные метастазы оцениваются как нерезектабельные, привел данные статистики д.м.н., профессор Виктор Анатольевич КАЩЕНКО (главный хирург Клинической больницы № 122 им. Л.Г. Соколова ФМБА, Санкт-Петербург). Между тем современная химиотерапия позволяет на 10–30% повысить частоту резекций у первично неоперабельных больных, то есть перевести их из первично нерезектабельного в резектабельное состояние, и в конечном итоге если не добиться полного излечения, то существенно увеличить продолжительность и качество жизни. Так, по данным исследования POCHER, применение химиотерапии (по схеме chrono-IFLO) в сочетании с цетуксимабом позволило добиться 60%-ной резектабельности печеночных метастазов, 2-летняя выживаемость у прооперированных пациентов составила 80,6%, у непрооперированных – 47,1% (p = 0,01)10. В целом уровень 5-летней выживаемости пациентов, подвергнутых резекции печени по поводу метастазов КРР, может достигать 42% (в группах с хорошим прогнозом), а уровень 10-летней выживаемости – 26%11.
R. Adam и соавт., наблюдавшие в течение 10 лет 184 пациента с КРР с первично нерезектабельными метастазами в печень, перенесших резекцию после индуцированной терапии, отметили, что 33% из них достигли 5-летней выживаемости, причем 19% – безрецидивной, а через 10 лет эти показатели составили 27% и 15%12.
Пациентов с мКРР можно условно разделить на 3 группы: легко резектабельную, погранично резектабельную/нерезектабельную и однозначно нерезектабельную. Стратегия лечения наименее многочисленной, но прогностически наиболее благоприятной в отношении излечения первой группы может идти по двум направлениям. Можно начать лечение с одномоментной/двухэтапной R0-резекции метастатических очагов и первичного очага и затем провести курс химиотерапии, либо отложить операцию, провести неоадъювантную химиотерапию (3–6 циклов), в случае ее эффективности – резекцию метастатических очагов, после чего – адъювантную химиотерапию. В последнее время все более популярным становится проведение периоперационной терапии, которая позволяет тестировать чувствительность опухоли к химиотерапии, уменьшить объем резекции и улучшить выживаемость.
Выбор тактики проведения химиотерапии у больных с погранично резектабельным/нерезекатабельным мКРР, а таких больных большинство, зависит от решения хирурга о вероятности проведения резекции. В случае положительного решения больному назначается максимально эффективная терапия, позволяющая достичь объективного ответа и повысить резектабельность метастазов в печени. Как показывает целый ряд исследований, увеличить частоту объективного эффекта и R0-резекций печени при первично нерезектабельном процессе, ограниченном пределами печени, у пациентов с диким геном KRAS можно, добавив к неоадъювантной химиотерапии цетуксимаб (Эрбитукс). Так, в исследовании CELIM добавление цетуксимаба к химиотерапии по схеме FOLFOX или FOLFIRI у пациентов с отсутствием мутации гена KRAS и с изначально нерезектабельными изолированными метастазами КРР в печени позволило повысить частоту объективных ответов до 70%, а частоту проведения резекции – до 33%13, а в исследовании POCHER добавление цетуксимаба к режиму chrono-IFLO – до 79% и 60% соответственно10. Выявление наличия/отсутствия мутации гена KRAS способствует подбору рациональной схемы медикаментозного лечения и, как результат, повышению частоты резекций у неоперабельных пациентов. Этому также способствуют предоперационная эмболизация воротной вены и методы локального воздействия на метастазы.
Как подчеркнул профессор В.А. Кащенко, основные условия достижения резектабельности связаны с оптимальной химиотерапией первой линии, а также с проведением химиотерапии в максимально короткие сроки. Так, данные ретроспективного анализа историй болезни 2470 пациентов с мКРР за период с 1990 по 2005 г. показали, что увеличение выживаемости и качества жизни пациентов обусловлено увеличением частоты операций по резекции печени и внедрением в клиническую практику моноклональных антител (цетуксимаб и бевацизумаб)14. Следует также учитывать гепатотоксичность химиотерапии: чем продолжительнее неоадъювантная химиотерапия и чем больше линий химиотерапии получил пациент, тем меньше выживаемость после резекции метастазов в печени11. С параметром общей выживаемости также напрямую коррелирует уменьшение размера опухоли на ранних этапах лечения. В исследованиях CRYSTAL и OPUS показано, что у пациентов с мКРР и диким типом гена KRAS уменьшение опухоли более чем на 20% на фоне терапии цетуксимабом (Эрбитукс) в течение 8 недель в сочетании со стандартной химиотерапией по схеме FOLFIRI или FOLFOX4 способствовало увеличению общей выживаемости до 30 и 26 месяцев соответственно по сравнению с химиотерапией (24,1 и 21,6 месяца соответственно)15.
Немаловажным условием в достижении резектабельности у первично неоперабельных больных мКРР является междисциплинарный подход к лечению таких пациентов (рис. 3). «Плоскости мультидисциплинарного подхода даже в аспекте метастатического колоректального рака лежат не только во взаимодействии онкологов и хирургов, но и специалистов других важных лечебных и диагностических служб», – отметил профессор В.А. Кащенко. В этой связи трудно переоценить роль такого чувствительного метода диагностики и оценки поражений при мКРР, как магнитно-резонансная томография (МРТ) с Примовистом (гадоксетата динатрий). Технология визуализации желчевыделительной системы с помощью гепатотропного МРТ-средства гадоксетата динатрия позволяет получить не только артериальную, портальную, равновесную (интерстициальную), но и гепатобилиарную фазу, показать выделение контрастного вещества во внепеченочные желчные протоки. Именно после введения гепатоспецифического контраста удается диагностировать метастазы колоректального рака диаметром 1–3 миллиметра, что очень важно для принятия стратегических решений по ведению больных с мКРР.
Междисциплинарный подход к лечению больных мКРР профессор В.А. Кащенко продемонстрировал, рассмотрев несколько клинических случаев.
Клинический случай 1
Пациент П., 1955 года рождения, в марте 2010 г. был госпитализирован в КБ № 122 (Санкт-Петербург) с признаками кишечной непроходимости. При фиброколоноскопии (ФКС) выявлена стенозирующая опухоль в нисходящем отделе ободочной кишки, по поводу которой был оперирован 16 марта – выполнена расширенная левосторонняя гемиколэктомия без выведения колостомы. Через полгода после операции, 5 октября 2010 г., при спиральной компьютерной томографии (СКТ) выявлено метастатическое образование в левом легком, а также множественные очаги в правой доле печени. 11 октября, после проведения химиотерапии, больному первоначально в условиях торакального отделения при КБ № 122 была выполнена расширенная верхняя лобэктомия слева. Поскольку у него был определен мутантный ген KRAS, пациенту были назначены 4 цикла полихимиотерапии по схеме mFOLFOX-6, на фоне которой отмечен 20%-ный регресс. Больному была выполнена расширенная правосторонняя гемигепатэктомия, затем его перевели в отделение медицинской онкологии, где он проходит курс химиотерапии.
Клинический случай 2
Пациентка А., 1966 года рождения, в августе 2011 г. поступила в один из стационаров города с острой кишечной непроходимостью, где ей диагностировали рак ректосигмоидного отдела с метастазами в печени. Прооперирована с выведением колостомы. В КБ № 122 больная обратилась в октябре 2011 г., тогда же ей была выполнена передняя резекция прямой кишки, ректосигмоидного отдела, сигмовидной и нисходящей ободочной, правой части ободочной кишки. Поскольку у пациентки определена мутация гена KRAS, ей были проведены 4 цикла полихимиотерапии режимом mFOLFOX-6. После частичного регресса, достигнутого на фоне химиотерапии, 26 января 2012 г. больной была выполнена правосторонняя гемигепатэктомия. Гистологическое заключение – метастаз аденокарциномы с лечебным патоморфозом III степени. Пациентка на фоне благоприятной картины была выписана с последующим наблюдением. В настоящее время у нее отмечается рецидив, планируется проведение очередной операции.
Клинический случай 3
Пациентка В., 58 лет, в 2007 г. поступила с кишечной непроходимостью в один из стационаров города, где ей провели резекцию кишки. Междисциплинарный принцип стадирования при ведении пациентки тогда не был соблюден, количество лимфоузлов не удовлетворяло возможностям для стадирования. В октябре 2010 г. был отмечен местный рецидив. В феврале 2011 г. больная обратилась за помощью в КБ № 122, где ей выполнили левостороннюю гемиколэктомию, удалены 12 лимфоузлов, в одном из которых был обнаружен метастаз колоректального рака. У больной выявлено метастатическое поражение печени, легких, мезентериальных лимфатических узлов. Отдаленные внепеченочные метастазы – неоперабельны. Поскольку у пациентки выявлен дикий тип гена KRAS, было проведено 12 циклов химиотерапии по схеме FOLFIRI в сочетании с цетуксимабом. Получен полный ответ на лечение цетуксимабом в комбинации с FOLFIRI – метастазы в печени и легких не определялись.
Завершая выступление, профессор В.А. Кащенко сформулировал следующие выводы:
- пациенты с мКРР представляют собой гетерогенную группу;
- МРТ с использованием Примовиста – наиболее чувствительный метод диагностики и оценки поражения при мКРР;
- определение статуса гена KRAS – обязательно при выработке тактики лечения и определении прогноза;
- сочетание ингибиторов EGFR с химиотерапией увеличивает долю R0-резекций печени и общую выживаемость больных с диким типом гена KRAS;
- междисциплинарный подход имеет важное значение для обеспечения выбора оптимальной тактики лечения.
«Мерк Сероно» в рамках VIII Съезда онкологов России (Санкт-Петербург, 11–13 сентября 2013 г.)." id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.