Сахарный диабет и остеопороз: современные возможности лечения
- Аннотация
- Статья
- Ссылки

Последствия заболевания часто недооцениваются как пациентами, так и врачами. Так, для 50-летней женщины риск перелома позвоночника составляет в среднем 15,5%, шейки бедра – 17,5%, костей запястья – 16,0%, а любого из трех участков скелета – 39,7%, и половина женщин старше 50 лет в течение своей последующей жизни переносит остеопоретический перелом (8, 20). Каждый восьмой мужчина, достигший возраста 59 лет, также переносит в последующие годы остеопоретический перелом, при этом почти треть всех переломов шейки бедра и 20% позвоночных переломов имеют место именно у мужчин (1).
В последние годы, обратив особое внимание на распространенность остеопороза у больных сахарным диабетом (СД), врачи назвали остеопороз «недооцененным осложнением СД» (15, 17). СД является одной из важнейших медико-социальных проблем здравоохранения: к 2030 году, согласно прогнозу Международной диабетической федерации, число больных в мире достигнет 438 млн. В Российской Федерации, как и во всех странах мира повсеместно отмечается рост заболеваемости СД 2. Суммарный процент остеопороза при СД среди всех вторичных форм заболевания составляет от 6 до 10% (27).
Метаболические нарушения, сосудистые и неврологические осложнения диабета приводят к развитию изменений практически всех органов и тканей, в том числе и костной системы (15, 27). Патологические изменения костной ткани при СД, по данным различных авторов, встречаются в среднем у половины больных, что предопределяет их уязвимость для остеопоретических переломов. Многочисленные исследования доказали, что потеря костной массы наблюдается чаще и более выражена при СД типа 1, чем при СД типа 2 (27, 28). По мнению большинства исследователей, наиболее ранним признаком является остеопения (17).
К счастью, остеопороз – это одно из немногих заболеваний, когда возможна эффективная профилактика. В настоящее время определены факторы риска остеопороза, часть из которых модифицируемые, разработаны методы первичной и вторичной профилактики, постоянно совершенствуются методы лечения заболевания. Вместе с тем, не вызывает сомнения тот факт, что сохранение костной массы – задача более легкая, чем прекращение потери или ее восстановление. Существует целый ряд эффективных антиостеопоретических препаратов, среди которых наиболее хорошо изучены соли кальция и витамин D, составляющие основу профилактики и любой терапевтической программы остеопороза, как первичного, так и вторичного, вместе с активным образом жизни, начиная с детства и на протяжении всей жизни (1, 8, 10, 23).
Регуляция баланса кальция в организме, роль витамина D
Костная ткань представляет собой активную динамическую систему, в которой постоянно происходят процессы резорбции старой кости и образования новой. Эти процессы составляют цикл костного ремоделирования, который начинается еще в утробе матери и продолжается в течение всей жизни человека (2, 13, 22). Достаточное поступление кальция в организм необходимо в любом возрасте, однако основная масса костной ткани формируется в детстве и пубертатном периоде, когда процессы костеобразования преобладают над костной резорбцией, поэтому в это время особенно важно адекватное потребление кальция (13, 16, 23). Согласно имеющимся данным, 90% костной массы формируется до 18 лет (2, 23). На протяжении жизни человека скорость и направленность костного ремоделирования меняются. До 35-40 лет поддерживается нулевой баланс; потери костной массы начинаются с конца третьего десятилетия жизни, их скорость зависит от пола и возраста. У мужчин они составляют 0,3-0,5% в год (1, 14). У женщин до начала периода климактерия костная масса ежегодно снижается на 0,7-1,3%, а после наступления менопаузы ее потери достигают 2-3% в год. При этом наибольшие потери происходят в течение первых 5-10 лет после наступления менопаузы и могут достигать 3-5% ежегодно (25).
В настоящее время в разных странах разработаны клинические рекомендации оптимального суточного потребления кальция в различные периоды жизни, основанные на возрастных и половых особенностях организма, его потребностях при различных состояниях, характеризующиеся общими тенденциями (8, 21). Согласно рекомендациям Национального института здоровья США, повышенное потребление кальция – 1200-1500 мг/сут. – необходимо подросткам, беременным и кормящим женщинам (32). Рекомендуемое потребление кальция для женщин в возрасте 25-50 лет, для женщин в постменопаузе, получающих гормональную заместительную терапию, и для мужчин 25-65 лет составляет 1000 мг/сут. Для женщин в постменопаузе, не получающих гормональную заместительную терапию, и для всех мужчин и женщин старше 65 лет оптимальное потребление кальция составляет 1500 мг/сут. Существенно, что поступление кальция в организм в количестве 1000 мг и более в сутки может способствовать замедлению потери костной массы в постменопаузе (14). Очевидно, что реальное потребление кальция населением значительно меньше рекомендованных нормативов. Практика показывает, что в обычном суточном рационе человека, как правило, содержится не более 600-800 мг кальция (13, 14, 22). В этой связи, в любом возрасте необходимо своевременно корригировать дефицит поступления кальция с пищей.
Более половины объема кости составляют минералы, поэтому для поддержания оптимальной костной массы необходимо регулярное поступление кальция, достаточное для возмещения его ежедневных потерь (8, 23). В зависимости от возраста, содержание кальция в организме колеблется в пределах от 0,8 до 1,7%, что в абсолютных цифрах составляет около 25-30 г у новорожденных и 850-1400 г – у взрослых. 99% кальция находится в костях скелета в виде кристаллов гидроксиаппатита (Са10(РО4)6(ОН)2) – основного депо кальция в организме, и только 1% – во внеклеточной жидкости и мягких тканях (14, 21, 22).
Функции кальция в организме многообразны. Кальций активно участвует во всех физиологических процессах, протекающих в костной ткани, – минерализации, моделировании и ремоделировании (12, 23, 25). Наряду с этим, кальций регулирует клеточное деление, дифференцировку, пролиферацию и апоптоз, проведение нервных импульсов, цикл сокращения–расслабления скелетной мускулатуры, синтез и секрецию гормонов, ферментов, нейротрансмиттеров (13, 22). Существенно, что кальций участвует в поддержании тонуса сосудов, процессах свертывания крови и регуляции метаболизма гликогена, оказывает влияние на липидный обмен (14, 26). Наибольшее значение имеет ионизированный кальций, участвующий в регуляции ряда важных процессов жизнедеятельности (14, 21).
Существует тесная взаимосвязь между уровнем ионизированного кальция крови и концентрацией кальцийрегулирующих гормонов. Повышение концентрации Са2+ на 1-2% вызывает незамедлительное снижение уровня паратиреоидного гормона (ПТГ) на 40-50% (14). Интересно, что при старении нарушается чувствительность клеток паращитовидной железы к Са2+ и повышается стартовый порог для концентрации, при котором подавляется секреция ПТГ (20).
Нормальный кальциевый баланс в организме поддерживается четким взаимодействием трех систем, включая желудочно-кишечный тракт (ЖКТ), кости и почки. Кальций поступает во внеклеточную жидкость в результате его всасывания в кишечнике и резорбции кости, а покидает ее путем отложения в костной ткани, а также выделяясь с секретом ЖКТ, мочой и в небольшом количестве через кожу (13, 26, 30). Поддержание положительного кальциевого баланса зависит от всасывания кальция в кишечнике.
Максимальная абсорбция кальция, составляющая около 50-60% от его суточного потребления, характерна для детского и подросткового возраста, с возрастом она снижается до 30% (12, 16). В пожилом возрасте всасывание кальция снижается до 20%, причем, чем ниже потребление кальция, тем больше выражено возрастное уменьшение его абсорбции (20). Пожилые люди плохо адаптируются к изменчивости в потреблении кальция, при этом кальциевый баланс у них в большей степени зависит от поступления кальция в организм, чем у лиц молодого возраста (9, 20, 25). Поэтому крайне важным является своевременное восполнение дефицита пищевого кальция в этой возрастной группе. Следует помнить, что ряд лекарственных препаратов, в том числе некоторые антибиотики (тетрациклины), антиконвульсанты, кортикостероиды при длительном использовании снижают абсорбцию кальция в ЖКТ (21, 22).
Важную роль в поддержании кальциевого гомеостаза и функционировании костной ткани принадлежит витамину D, роль дефицита которого в развитии остеопороза представляется очень важной (20, 25, 31). Наряду с регуляцией кальциевого обмена, витамин D влияет на ряд систем организма, таких как иммунная и кроветворная, контролирует экспрессию более 200 генов, ответственных за регуляцию клеточной пролиферации, дифференцировки, апоптоза и ангиогенеза (14, 18, 19). В β-клетках поджелудочной железы установлено наличие рецепторов к витамину D и экспрессии 1α-гидроксилазы; в условиях его дефицита в эксперименте на животных моделях нарушается глюкозоопосредованная секреция инсулина. Витамин D участвует в поддержании концентрации внутриклеточного кальция в β-клетках, регулируя уровень кальбидина, цитозольного кальцийсвязывающего протеина, контролирует ток иона в клетку.
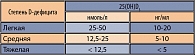
Для реализации своего биологического действия витамин D, поступающий с пищей (эргокальциферол), и образующейся в коже из 7-дигидрохолестерола под воздействием ультрафиолетового света (холекальциферол), после 25-гидроксилирования в печени превращаются в 25(ОН)D3 (кальцидиол) – транспортную форму витамина D (14, 19, 31). Примерно 80% витамина D образуется эндогенно и только 20% поступает из экзогенных источников (например, яйца, кисломолочные продукты, сливочное масло, печень рыб). После последующего 1α-гидроксилирования в почках при участии фермента 1α-гидроксилазы из 25(ОН)D3 образуется 1,25(ОН)2D3 (кальцитриол) – активная форма витамина D. Регуляция синтеза 1,25(ОН)2D3 в почках является непосредственной функцией ПТГ; на его концентрацию по механизму обратной связи влияет содержание активного метаболита витамина D и Са2+. Снижение уровня сывороточного 25(ОН)D3 является наиболее информативным показателем дефицита витамина D (таблица 1) (19).
Синтез кальцитриола в почках резко замедляется, если концентрация 25(ОН)D3 снижается до уровня менее 30 нг/мл (20). Недостаток витамина D может привести к вторичному гиперпаратиреозу, что в свою очередь вызывает остеопороз, повышение риска переломов. Кроме того, дефицит витамина D вносит свой вклад в нарушение двигательной активности, координации движений и как следствие – повышению риска падений, особенно у пожилых лиц.
Уровень витамина D в организме зависит от многих факторов, включая время года, географическую широту, возраст человека, массу его тела, особенности пигментации кожи (14, 20, 23, 26). Зимой в высоких широтах синтез витамина D в коже значительно снижается, что сопровождается понижением уровня 25(ОН)D3 (22). Способность синтезировать и абсорбировать витамин D уменьшается с возрастом человека. Так, у пожилых людей в возрасте 65 лет и старше способность к синтезу витамина D в коже уменьшается в 4 раза (20). Результаты ряда исследований выявили значительную распространенность гиповитаминоза D и дефицита витамина D у людей пожилого возраста, составляющую 25-57% (9, 14). В то же время, недостаток витамина D может быть характерен и для лиц молодого возраста, особенно в зимнее время: им страдает 32% здоровых людей 18-29 лет [26]. Избыточная масса тела также часто сопровождается недостаточностью витамина D (23, 32). Среди женщин с постменопаузальным остеопорозом, по данным мета-анализа, у трети концентрация 25(ОН)D3 составляла менее 20 нг/мд (4). Вместе с тем, в клинической практике дефицит витамина D часто не диагностируется.
Основной механизм, обеспечивающий всасывание 90% кальция, представляет собой витамин D-зависимый, активный транспорт кальция через энтероциты, который активизируется при дефиците витамина (14, 19). Наряду с кальцитриолом, основной формой витамина D, ответственной за регуляцию активного транспорта кальция в ЖКТ, 25(ОН)D3 также принимает участие в этом процессе. Эффективность абсорбции кальция существенно возрастает, если на фоне терапии витамином D уровень 25(ОН)D3 повышается с 50 до 80 нмоль/л и не изменяется при дальнейшем росте концентрации 25(ОН)D3 (22, 25). Снижение концентрации 25(ОН)D3 до величин менее 80 нмоль/л вызывает повышение выработки ПТГ, а повышенный уровень ПТГ, в свою очередь, ведет к усилению костной резорбции, что ассоциируется с высоким риском переломов (19).
Сахарный диабет и остеопороз
С современных позиций остеопению/остеопороз при СД рассматривают в качестве одной из форм вторичного остеопороза (15, 21). Многочисленные метаболические изменения, характеризующие СД, приводят к нарушению процессов костного ремоделирования. Инсулин, как известно, принимает непосредственное участие в процессах костеобразования: стимулирует биосинтез белка, обладает анаболическим эффектом на метаболизм костной ткани и прямым стимулирующим влиянием на синтез коллагена и гиалуроната (17, 27). Усиливая всасывание аминокислот и кальция в кишечнике, инсулин способствует увеличению захвата, транспорта аминокислот, их включению в костную ткань и синтезу костного матрикса. Обладая стимулирующим влиянием на остеобластогенез (вызывает пролиферацию и репликацию остеобластов), инсулин повышает количество остеобластов; он необходим для поддержания и обеспечения процессов дифференцировки остеобластов и их способности отвечать на другие гормональные влияния (15, 17, 24). Кроме того, инсулин влияет на продукцию инсулиноподобного фактора роста 1 типа (ИПРФ-1), который также участвует в образовании костной ткани.
Дефицит инсулина, проявляющийся плохим метаболическим контролем, создает условия для формирования остеопении и остеопороза. Чаще всего больные СД с костными нарушениями – это пациенты с неудовлетворительным гликемическим контролем. На взаимосвязь степени компенсации метаболических процессов и выраженности процессов деминерализации костной указывают многие авторы (17, 28). В условиях недостатка инсулина снижается активность остеобластов, напротив, активность остеокластов увеличивается, и костная резорбция усиливается (15, 17). Эти изменения сопровождаются отрицательным азотистым балансом, увеличением секреции глюкокортикоидов, которое приводит к уменьшению белковой костной матриц. Важную роль играет прямое влияние высокой концентрации глюкозы – глюкозотоксичность: за счет высокой концентрации конечных продуктов гликозилирования в костном коллагене может усиливаться остеокластическая резорбция кости (24). Метаболический ацидоз также ассоциируется с отрицательным кальциевым балансом.
Среди предполагаемых механизмов ускоренного развития остеопороза при СД большое значение придают диабетическим микроангиопатиям, ухудшающим кровоснабжение костей (17, 27). Наряду с этим повышенное выделение кальция, ассоциирующееся с глюкозурией, – также значимый фактор риска развития остеопороза. Гиперкальциурия особенно часто наблюдается у больных СД при неудовлетворительном контроле гликемии, то есть при неадекватной фармакокотерапии; ее повышение прямо коррелирует со степенью глюкозурии. Кроме того, сахароснижающая терапия – лечение тиазолидиндионами – ассоциируется с повышенным риском переломов, особенно у пожилых женщин (17, 24).
В условиях недостаточности инсулина страдает функция остеобластов, которые имеют рецепторы инсулина: снижается выработка коллагена и щелочной фосфатазы, необходимых для образования костного матрикса и его минерализации. Кроме того, снижение концентрации ИПРФ-1, часто обнаруживаемое при СД, ведет к снижению числа остеобластов и их активности (17, 27).
Обсуждается и такой важный механизм, как недостаток активных метаболитов витамина D: дефицит инсулина приводит к нарушению метаболизма, биологической активности и рецепции витамина D (17, 24). Это ведет к снижению всасывания кальция в кишечнике, усилению секреции и активности ПТГ, а, в конечном итоге, создает отрицательный баланс кальция в организме, усиливая резорбцию костной ткани. Особо следует выделить возникновение остеопороза у части больных диабетической нефропатией, при которой нарушается образование в почках активных форм витамина D.
Известно, что у женщин старше 50 лет с СД типа 1 относительный риск частоты переломов шейки бедра в 7 раз и более превышает таковой у женщин без диабета (24, 27). У женщин с СД типа 2 в период менопаузы риск переломов шейки бедра почти вдвое выше, чем у женщин, которые им не страдают. Следует отметить, что учащение переломов костей различной локализации при сочетании СД и остеопороза связано также с увеличением случаев падения этих больных. Факторы риска падения при СД весьма специфичны, и на них следует обращать особое внимание. К ним относятся гипогликемические состояния; нарушение равновесия в связи с автономной и периферической невропатией; поли- и никтурия; нарушение зрения вследствие ретинопатии и других офтальмологических осложнений; изменение структуры стопы (язвы, деформации, остеоартропатия Шарко); полипрагмазия, а также резкое снижение артериального давления при сердечно-сосудистой форме диабетической автономной невропатии (24, 27, 28).
Клиническое применение препаратов кальция и витамина D
За последние годы накоплено немало данных, свидетельствующих об участие кальция и витамина D в процессах регуляции массы тела, толерантности к глюкозе и чувствительности тканей к инсулину, например, выявлена обратная зависимость между потреблением кальция и массой тела, объемом жировой массы (23, 24, 32). Исследователями экспериментальным путем выявлено, что при высоком потреблении кальцийсодержащих продуктов достоверно снижается активность липогенеза, увеличивается интенсивность липолиза и скорость окисления жирных кислот [33].
В β-клетках поджелудочной железы установлено наличие рецепторов к витамину D, там же экспрессирован фермент 1α-гидроксилаза, т.е. при участии этого фермента путем 1α-гидроксилирования из 25(ОН)D3 может образовываться 1,25(ОН)2D3 (кальцитриол) – активная форма витамина D (3, 17, 29). Интересно, что в условиях его дефицита (продемонстрировано в эксперименте на животных моделях) нарушается глюкозоопосредованная секреция инсулина, ухудшается чувствительность органов и тканей к инсулину (5, 6). Показано, что недостаточность 25(ОН)D3 характерна не только для СД 2, но и для нарушения толерантности к глюкозе (29). Регулируя уровень кальбидина, цитозольного кальцийсвязывающего протеина, витамин D участвует в поддержании концентрации внутриклеточного кальция и, что важно, контролирует ток иона в β-клетках. В свою очередь кальций необходим для инсулинозависимых внутриклеточных процессов, происходящих в скелетных мышцах и жировой ткани. Также показано, что нарушение фосфорилирования инсулинового рецептора, как кальцийзависимого процесса, может лежать в основе снижения активности ГЛЮТ-4 (17). В целом неадекватное потребление кальция и витамин D-недостаточность могут нарушать баланс между вне- и внутриклеточным пулом кальция в β-клетках, что в последующем влияет на нормальный секреторный ответ инсулина на нагрузку глюкозой (24, 29).
Обладая онкопротективным действием, кальций и витамин D снижают риск развития рака кишечника, простаты и молочной железы (22). Своевременная компенсация их дефицита способствует улучшению течения ряда заболеваний (например, ревматоидный артрит, артериальная гипертензия), а также повышает эффективность их лечения (18, 22).
Эффективность и безопасность применения кальция и витамина D подтверждена результатами различных демографических исследований, существенно, что наибольшая клиническая эффективность имеет место при их комбинированном использовании (9, 14, 30). Наибольшая эффективность с точки зрения снижения риска переломов достигается при назначении комбинации кальция в дозе 1000-1200 мг/сут. и витамина D в дозе 700-800 МЕ/сут., что в целом приводит к снижению риска переломов шейки бедра на 35-50%, снижению частоты переломов костей скелета – на 25-70% и повышает МПК на 2-10% (29).
К сожалению, не всегда усилия врачей приводят к желанной цели, в том числе и из-за отсутствия комплаентности у пациентов. Длительное лечение любого хронического заболевания, в том числе остеопороза, как правило, вызывает у пациентов определенные трудности с соблюдением режима приема препарата. Действительно, одновременный прием нескольких лекарственных препаратов все шире признается как препятствие к эффективному лечению. Результаты ряда исследований показывают, что около 47-50% пациентов с остеопорозом не соблюдают рекомендованную терапию (8, 25). Следовательно, упрощение схемы фармакотерапии является одной из эффективных стратегий профилактики и лечения остеопороза.
В практическом плане важно, что биоусвояемость кальция в значительной степени определяется химическими свойствами солей кальция, каждая из которых содержит различное количество элементарного кальция, обусловливающего основные эффекты (4, 22). Усваиваться может только элементарный кальций, что крайне важно оценивать при использовании на практике конкретных препаратов для достижения оптимального потребления кальция (таблица 2).
Как видно, наибольшее количество элементарного кальция (40%) содержит его карбонатная соль. Для минимизации побочных эффектов и улучшения абсорбции препараты, содержащие кальций, следует принимать во время или после еды. Абсорбция кальция прекращается через 4 часа после приема пищи. Ранее считалось, что однократный прием кальция не должен превышать 600 мг. При увеличении однократно принимаемой дозы кальция до 1000 мг, несколько уменьшается процент его всасывания, что клинически не является значимым. С целью повышения приверженности в некоторых странах появились лекарственные формы с содержанием кальция 1000 мг и витамина D 800 МЕ в одной таблетке, При применении указанных доз кальция и витамина D3 не наблюдается роста побочных эффектов.
Прием кальция, как у пациентов, так и у врачей, часто ассоциируется с риском почечнокаменной болезни. Следует помнить, что именно дефицит кальция имеет большое значение в патогенезе камнеобразования в почках (23, 28). В настоящее время установлено, что при высоком потреблении кальция снижается частота камнеобразования у мужчин и женщин, а низкое потребление кальция (683 мг/сут. и меньше), особенно в постменопаузе, является достоверным фактором риска образования камней в почках у женщин (23). Также известно, что при нормальной функции почек потребление кальция до 2,5 г/сут. не вызывает развития гиперкальциемии и камнеобразования, в то же время риск камнеобразования может увеличиваться при приеме кальция натощак (3, 14).
Одним из эффективных комбинированных препаратов, содержащих кальций и витамин D, является Кальций-Д3 Никомед. Удобство использования препарата обеспечивается наличием двух его форм (500 мг карбоната кальция + 200 МЕ витамина D3). Препарат рекомендуется в основном для профилактики и включения в схемы лечения остеопороза у лиц более молодого возраста. Кальций-Д3 Никомед Форте (500 мг карбоната кальция + 400 МЕ витамина D3). Препарат рекомендуется для лечения сенильного остеопороза, при назначении антирезорбтивных препаратов, для профилактики остеопороза у лиц старше 50 лет.
Применяя комбинированные препараты, содержащие кальций и витамин D в профилактике и комплексной терапии остеопороза и его осложнений ни в коей мере нельзя забывать и о немедикаментозных методах коррекции: сбалансированное питание, прекращение курения и злоупотребления алкоголем, адекватной физической активности и профилактике падений.
В заключение хотелось бы отметить, что компенсация хронического дефицита кальция и витамина D, широко распространенного состояния, характерного и для сахарного диабета, представляет собой важный аспект современной медицины, имеющей профилактическую направленность. Большой и длительный опыт клинического применения солей кальция и витамина D позволяет эффективно использовать их как безопасную и доступную стратегию профилактики и лечения как первичных, так и вторичных форм остеопороза.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.