Гипертрофия левого желудочка и возможности антигипертензивной терапии
- Аннотация
- Статья
- Ссылки
Первое описание гипертрофии левого желудочка (ГЛЖ) было сделано еще в 1748 г., однако патогенетическое обоснование процесса формирования ГЛЖ как механизма адаптации к повышенной нагрузке было дано лишь во второй половине XX в. Тем не менее связь между ГЛЖ и высокой смертностью была замечена еще в начале XX в., однако в те годы эти данные не имели достаточного статистического обоснования.
Проведенные в дальнейшем крупные эпидемиологические исследования показали, что общая и сердечно-сосудистая смертность нарастают по мере увеличения выраженности ГЛЖ. Например, согласно результатам Корнельского и Фремингемского исследований, у лиц с признаками ГЛЖ общая смертность в 4 раза выше, а смертность от сердечно-сосудистых причин в 7-9 раз выше по сравнению с лицами без признаков ГЛЖ. У мужчин в возрасте до 65 лет ГЛЖ увеличивает риск смерти в 7 раз по сравнению с общей популяцией. Среди лиц без клинических симптомов сердечно-сосудистой патологии, но с признаками ГЛЖ на электрокардиограмме (ЭКГ) 33% мужчин и 21% женщин умирают в течение 5 лет (10, 14, 23, 28, 30).
Природа формирования ГЛЖ носит мультифакториальный характер. Важное значение в патогенезе ГЛЖ имеют пол, масса тела, повышенное потребление соли и алкоголя. По мере увеличения возраста отмечается рост частоты встречаемости ГЛЖ – за каждые 10 лет жизни риск развития ГЛЖ возрастает на 15%. Расовая принадлежность также имеет значение при определении распространенности ГЛЖ: исследование, проводившееся в США, показало практически четырехкратное увеличение встречаемости ГЛЖ у афроамериканского населения по сравнению с белым (13, 30).
В современных представлениях о патогенезе ГЛЖ важнейшую роль отводят многочисленным нейрогенным и гуморальным факторам, и в первую очередь – симпатоадреналовой (САС) и ренин-ангиотензин-альдостероновой (РААС) системам, активация которых способна как индуцировать гипертрофию, так и ускорять ее развитие (1, 11, 27).
Наконец, накопление новых данных по эпидемиологии сердечно-сосудистого ремоделирования и внедрение методов молекулярной кардиологии привели к формированию концепции существенной роли генетических факторов в развитии изменений в сердечно-сосудистой системе. Среди генов, структурный полиморфизм которых обсуждается как фактор развития гипертрофии миокарда и сосудистой стенки, на первом месте стоят гены белков РААС и гены других факторов роста и регуляторных пептидов, участвующих в передаче гипертрофических стимулов (39).
Имеется тесная связь между ГЛЖ и уровнем артериального давления (АД) – ГЛЖ выявляется примерно у половины больных с артериальной гипертензией (АГ). Доказано, что ГЛЖ при АГ является независимым фактором риска сердечно-сосудистой заболеваемости (ССЗ) и смертности, а также основным доклиническим проявлением поражения сердечно-сосудистой системы, которое повышает риск ишемической болезни сердца (ИБС) и инфаркта миокарда (ИМ), инсульта и застойной сердечной недостаточности, внезапной смерти и общей смертности (26). Термин «гипертоническое сердце», предложенный еще в середине XX в., определяет все многообразие функциональных и морфологических изменений в сердце как органе-мишени при АГ (4).
Сущность гипертрофии может быть определена как увеличение сердца вследствие увеличения объема и/или числа кардиомиоцитов. Этот процесс сопровождается увеличением количества сократительных и вспомогательных белков выше нормального уровня. До настоящего времени имеются противоречивые мнения о том, связан ли прирост массы миоцитов исключительно с гипертрофией (увеличением размера клеток) или в некоторых случаях также имеется элемент гиперплазии (деления клеток и увеличения их количества). Гипертрофированный миокард характеризуется значительным количеством электрофизиологических нарушений: во многих исследованиях показаны замедление реполяризации, нарушение распространения волны электрического возбуждения при ГЛЖ (8, 11, 18).
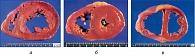
Традиционно выделяют два типа ГЛЖ (рисунок 1): концентрическую и эксцентрическую. Концентрическая ГЛЖ характеризуется утолщением стенки ЛЖ вследствие функциональной нагрузки давлением, при этом гипертрофия кардиомиоцитов развивается преимущественно за счет утолщения миофибриллярных пучков, в то время как длина кардиомиоцитов заметно не изменяется. Для этого типа ГЛЖ характерны высокое общее периферическое сосудистое сопротивление (ОПСС), субнормальный ударный объем и повышенное пульсовое АД, обусловленное значительной ригидностью артерий.
Эксцентрическая ГЛЖ развивается вследствие нагрузки объемом и характеризуется увеличением объема полости левого желудочка (ЛЖ), при этом кардиомиоциты удлиняются за счет добавления новых саркомеров к предшествующим миофибриллам, а поперечные размеры сердечных миоцитов и длина саркомера в этом случае не изменяются. Для пациентов с эксцентрической гипертрофией свойственно увеличение полости левого желудочка, высокий ударный выброс, сравнительно низкое пульсовое АД, что обусловлено податливостью артериального сосудистого русла в отсутствие выраженных вазоспастических реакций (5).
Геометрия ЛЖ является индикатором развития жизнеугрожающих нарушений ритма. Согласно данным J. Ghali (18, 19), концентрическая гипертрофия сопряжена с высоким риском желудочковых аритмий: при динамическом наблюдении в течение 9 лет за пациентами с ГЛЖ концентрическая гипертрофия сопровождалась более высоким риском смерти вследствие развития жизнеугрожающих аритмий, чем эксцентрическая, причем эта закономерность была выявлена как при наличии сопутствующей ИБС, так и без нее (12).
В Фремингемском исследовании был проведен анализ прогноза больных с различными типами геометрии ЛЖ, который показал, что наличие концентрической ГЛЖ является самостоятельным фактором риска неблагоприятного прогноза, прежде всего в плане развития ИБС и ее осложнений. В рекомендациях Европейского кардиологического общества по лечению АГ (2007) подчеркнута важность определения типа геометрии ЛЖ для стратификации риска больных с АГ (22).
ГЛЖ сопровождается снижением коронарного резерва вследствие уменьшения в гипертрофированном миокарде количества резистивных артериол. Такое несоответствие отражает нарушение способности артериолярной сети к росту адекватно увеличению количества кардиомиоцитов. В норме во время систолы происходит уменьшение коронарного кровотока из-за компрессии, обусловленной периваскулярными силами сжатия. В условиях гипертрофии действие сил сжатия на коронарный кровоток в систолу увеличивается, чему способствует и усиление напряженности стенки миокарда ЛЖ, связанное с повышением АД. Влияние этих неблагоприятных факторов приводит к тому, что гипертрофированный миокард в большей степени подвергается коротким эпизодам ишемии, причем максимальная степень снижения коронарного резерва выявляется при гипертензивной ГЛЖ концентрического типа (5).
В настоящее время установлено, что изменение морфологии сердца одновременно сопровождается нарушением морфологии крупных сосудов: у больных с более выраженными гипертрофическими изменениями миокарда утолщение стенок крупных сосудов также выражено гораздо больше. Эта зависимость, скорее всего, является следствием общности регуляторных механизмов, лежащих в основе формирования и ГЛЖ, и утолщения сосудистой стенки (2, 5).
По мере нарастания гипертрофии стенок ЛЖ возникает и усугубляется его диастолическая дисфункция, усиливается внутримиокардиальное напряжение, повышается конечное диастолическое давление. Вслед за диастолической начинает страдать и систолическая функция, и при увеличении массы миокарда ЛЖ выше критического уровня (200 г) возникает латентная сердечная недостаточность.
Вследствие описанных патологических моментов развивается комплекс механизмов, приводящих в итоге к развитию сердечно-сосудистых осложнений и значительному ухудшению прогноза у больных с ГЛЖ. Так, ГЛЖ является независимым фактором риска ИБС и ИМ. У пациентов с ГЛЖ риск ИМ в 4 раза выше, чем у людей с нормальной геометрией сердца. Более того, у пациентов с ГЛЖ ИМ протекают тяжелее и характеризуются большим количеством осложнений. Столь значимая связь между ГЛЖ и риском ишемических событий объясняется прежде всего снижением коронарного резерва на фоне ГЛЖ и относительной ишемией гипертрофированного миокарда при недостаточном его кровоснабжении, а также сопутствующей эндотелиальной дисфункцией и микроангиопатией коронарных сосудов.
При наличии ГЛЖ в 6-12 раз увеличивается риск инсульта, что, скорее всего, обусловлено сопутствующими изменениями в системе мозговых сосудов, поскольку между ГЛЖ и поражением крупных сосудов имеется неразрывная связь. Согласно результатам исследования, проведенного в Японии K. Kohara и соавт. (25), концентрическая ГЛЖ является маркером доклинического поражения ЦНС. ГЛЖ ассоциирована также с риском развития атеросклероза сосудов нижних конечностей.
ГЛЖ в настоящее время рассматривается как основное звено в цепи сердечно-сосудистого континуума и в развитии сердечной недостаточности. Признаки гипертрофии на ЭКГ сопровождаются увеличением частоты развития синдрома ХСН в 14 раз. При этом такие клинические состояния, как ИМ и инсульт, успешно предотвращаются на фоне адекватного контроля АД, в то время как профилактика сердечной недостаточности требует более пристального внимания именно к поражению сердца.
Оригинальные исследования продемонстрировали, что ГЛЖ на ЭКГ является важным независимым фактором риска внезапной смерти как у мужчин (6-кратное увеличение риска), так и у женщин (3-кратное увеличение риска). Результаты проведенных исследований свидетельствуют в целом о большей частоте желудочковых аритмий у больных с ГЛЖ, чем без нее. Это справедливо и для желудочковой экстрасистолии, и для более сложных нарушений ритма по типу парных экстрасистол, ранних желудочковых экстрасистол и коротких пробежек желудочковой тахикардии (8).
Механизмы развития нарушений ритма при ГЛЖ включают в себя как непосредственные изменения электрофизиологических свойств сердечной мышцы вследствие ее гипертрофии и фиброза, так и снижение коронарного резерва, систолическую и диастолическую дисфункцию, активацию симпатической нервной системы и других нейрогуморальных систем. Данные оригинальных исследований подтверждены результатами Фремингемского исследования, которое продемонстрировало увеличение частоты фибрилляции предсердий в 1,5 раза при увеличении индекса массы ЛЖ на каждые 40 г/м2. ГЛЖ увеличивает риск фибрилляции предсердий (ФП) в 3-4 раза при одинаковом возрасте пациентов, и каждые 4 мм утолщения стенки ЛЖ приводят к увеличению ФП на 28% (40).
Исходя из всего вышеизложенного, ГЛЖ должна быть объектом лечения и профилактики, и современные принципы терапии ССЗ во многом направлены на то, чтобы остановить прогрессирующую ГЛЖ или уменьшить ее степень. Как было показано во многих клинических исследованиях, в ряде случаев удается не только затормозить, но и добиться определенной регрессии нарушений геометрии ЛЖ.
Способность благотворно влиять на процессы ремоделирования ЛЖ была продемонстрирована для ряда медикаментозных препаратов. При этом для снижения общей заболеваемости и смертности не менее важно корригировать модифицируемые факторы риска, влияющие на ГЛЖ и ее распространенность, такие как уровень АД, масса тела, количество потребляемой соли и алкоголя (3, 4, 7).
Антигипертензивные препараты оказывают различное влияние на обратное развитие ГЛЖ при равном гипотензивном эффекте, что может быть обусловлено их особым воздействием на САС, РААС и факторы роста. У больных АГ при наличии ГЛЖ необходимо отдавать предпочтение антигипертензивным препаратам, обладающим способностью вызывать обратное развитие ГЛЖ, так как препараты, снижающие АД без изменения массы миокарда ЛЖ, не уменьшают риска развития сердечно-сосудистых осложнений и внезапной смерти (34). Наиболее эффективны для лечения больных АГ с ГЛЖ ингибиторы АПФ (иАПФ) и/или блокаторы рецепторов к ангиотензину II (БРА), а также антагонисты кальция. Далее по убывающей – b-адреноблокаторы и диуретики (16, 41).
Лидирующая роль иАПФ в снижении массы миокарда ЛЖ была выявлена B. Dahlof c соавт. (16) по результатам проведенного метаанализа 109 исследований и подтверждена метаанализами, выполненными Shmieder R.E. с соавт. (41) и Klingbeil A.U. с соавт. (24) и включившими в общей сложности 12142 пациента. Необходимо отметить, что все гипотензивные препараты примерно одинаково уменьшают механическую нагрузку на миокард путем снижения АД, в то время как иАПФ оказывают непосредственное действие на ангиотензин II. Причем в большей степени регрессу ГЛЖ способствуют иАПФ, имеющие повышенное сродство к тканевой РААС, – квинаприл, периндоприл, рамиприл и трандалоприл. Эти препараты, обладающие большей тканевой аффинностью, устраняют дисфункцию эндотелия, замедляя распад брадикинина – мощного вазодилататора, вызывающего образование простациклина, оксида азота и эндотелиального гиперполяризующего фактора. Они также уменьшают продукцию супероксидного аниона и деградацию оксида азота, препятствуют пролиферации гладкомышечного слоя сосудов, предупреждая таким образом действие ангиотензина II в тканях.
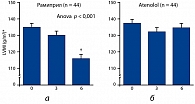
В исследованиях RACE (33) доказано, что при одинаковом влиянии на АД иАПФ рамиприл вызывает более выраженный регресс ГЛЖ, чем b-адреноблокатор атенолол (рисунок 2). В рандомизированном двойном слепом плацебо-контролируемом исследовании HYCAR (31), сравнивавшим применение рамиприла в дозах 1,25 мг/сут., 5 мг/сут. и плацебо, было установлено, что через 6 месяцев лечения масса миокарда ЛЖ (ММЛЖ) достоверно увеличивалась в группе плацебо и достоверно уменьшалась в группах рамиприла. Более выраженное снижение было получено в группе с большей (5 мг/сут.) дозой рамиприла.
В исследовании HEART (36) было доказано, что раннее применение рамиприла (с первых суток) в дозе 10 мг/сут. у больных острым инфарктом миокарда предупреждает ремоделирование ЛЖ и вызывает более значительное увеличение его фракции выброса по сравнению как с низкими дозами (0,625 мг/сут.), так и с отсроченным назначением препарата (на 14-е сутки).
Ряд российских исследований также подтвердил достоверное положительное действие иАПФ на структурно-функциональное состояние миокарда. Так, на базе Ростовского государственного медицинского университета (9) оценивалось влияние рамиприла (Хартил, EGIS) на процессы ремоделирования сердца у пациентов с сочетанным течением АГ и ИБС (n = 40). Дополнительное назначение этого препарата к аспирину, статину и b-адреноблокатору сопровождалось тенденцией к более выраженному уменьшению толщины задней стенки ЛЖ, снижению миокардиального стресса (на 12,2%, р = 0,001) и повышению фракции выброса (на 7,3%, p = 0,002) к концу 12-недельного периода наблюдения.
Сотрудники Московского государственного медико-стоматологического университета обследовали 60 женщин, страдающих ХСН неклапанной этиологии, находящихся в постменопаузе (6). Пациентки были рандомизированы в группы приема рамиприла (Хартил, EGIS) и эналаприла в дополнение к стандартной терапии. Исходно и через 6 месяцев у пациенток определяли тяжесть ХСН и морфо-функциональные изменения сердца. Терапия ХСН во всех группах привела к некоторому уменьшению толщины стенок и размеров левого желудочка. Однако в группе рамиприла к концу исследования отмечено достоверное уменьшение степени диастолической дисфункции (р = 0,062), а также улучшение переносимости физической нагрузки, снижение функционального класса ХСН, улучшение качества жизни и снижение степени эндотелиальной дисфункции. Применение рамиприла сопровождалось низкой частотой развития побочных эффектов, что повышало приверженность к лечению и его эффективность.
Антагонисты рецепторов ангиотензина также оказывают выраженное действие на тканевую РААС, что ассоциируется со значительным органопротективным эффектом. В настоящее время накоплен достаточный клинический опыт по оценке их влияния на гипертрофированный миокард ЛЖ.
В исследовании LIFE (15, 17) было показано достоверное преимущество лозартана перед атенололом в снижении массы миокарда ЛЖ. В этом исследовании принимали участие 9193 пациента в возрасте 55-80 лет с АГ и ЭКГ-признаками ГЛЖ. Лозартан по сравнению с атенололом приводил к уменьшению относительного риска смерти от сердечно-сосудистых причин на 11%, инсульта – на 25%, новых случаев сахарного диабета – на 25%. Назначение лозартана сопровождалось более выраженным, чем при использовании атенолола, уменьшением ГЛЖ – на 10,2% и 4,4% по Корнельскому индексу и на 15,3% и 9,0% по индексу Соколова–Лайона соответственно. Аналогичные результаты получены и при использовании телмисартана в сравнительных исследованиях с гидрохлортиазидом, эналаприлом и карведилолом.
Антагонисты кальция также оказывают влияние на регресс ГЛЖ. Уменьшение гипертрофии миокарда на фоне их применения обусловлено ингибицией фосфориляции рецепторов эпидермального ростового фактора. Метаанализ, проведенный Dahlof с соавт. (16), показал, что антагонисты кальция (нифедипин) уменьшают массу ЛЖ на 10%, а иАПФ – на 16% (32, 37). Однако в большинстве проанализированных работ использовался нифедипин короткого действия, который, как известно, недостаточно эффективен при редукции ГЛЖ, что связывают с повторными эпизодами симпатической стимуляции.
В то же время при использовании нифедипина ультрадлительного действия ММЛЖ в течение года уменьшилась на 19%, что сопоставимо с эффектом иАПФ (37). Аналогичные данные получены Picca с соавт. (38), показавшими одинаковый гипотензивный эффект и достоверное снижение ММЛЖ в группах больных, принимавших амлодипин (10 мг/сут.) или эналаприл (20 мг/сут.).
Однако не все антагонисты кальция также эффективны в отношении влияния на ГЛЖ, как амлодипин. Например, фелодипин обладает гораздо более низкой активностью, скорее всего, вследствие повышения уровня норадреналина и увеличения ЧСС на фоне его приема (29).
Остальные группы гипотензивных препаратов (b-адреноблокаторы, антагонисты a-рецепторов, диуретики) вызывают менее выраженный регресс ГЛЖ, чем иАПФ, антагонисты рецепторов ангиотензина II или антагонисты кальция. Однако ряд исследований, оценивавших эффективность мочегонных препаратов (хлорталидон, индапамид-ретард, гидрохлортиазид) в сопоставлении с иАПФ (эналаприл) и β-адреноблокаторами (ацебутолол, атеналол) (TOMHS, 1993; Veterans Administration Study, 1997; LIVE, 2000) (20, 21, 35) по влиянию на регресс ГЛЖ, существенно усилили позиции диуретиков.
Следовательно, определенная коррекция геометрических изменений ЛЖ представляется возможной и реально достижимой. Уменьшение ГЛЖ сопровождается увеличением коронарного резерва, улучшением систолической и диастолической функций ЛЖ, а также уменьшением числа желудочковых нарушений ритма. Таким образом, снижение массы миокарда ЛЖ в результате лечения сопровождается улучшением прогноза и снижением риска смерти, и именно это доказанное свойство должно быть определяющим критерием в выборе медикаментозного препарата.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.