Гликемический контроль и управление кардиометаболическим риском у пациентов с сахарным диабетом типа 2
- Аннотация
- Статья
- Ссылки







Раннее назначение инсулина – реальный шанс избежать осложнений
Все уровни оказания медпомощи при сахарном диабете типа 2 – от диагностики до терапии – должны базироваться на единых, грамотно составленных стандартах, четко определяющих объем лечебно-диагностической помощи больным.
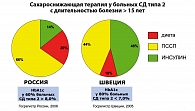
Уже через три года после установления диагноза СД типа 2, согласно данным UKPDS, только 45% пациентов, получавших монотерапию пероральными сахароснижающими препаратами, имели уровень HbA1c < 7%; через девять лет доля компенсированных больных в этой группе не превышала 20%. Комбинация пероральных сахароснижающих препаратов (ПССП) также позволила поддерживать нормогликемию лишь в течение нескольких лет. Учитывая уже имеющееся в момент выявления диабета снижение секреции инсулина, раннее добавление инсулина к терапии ПССП с целью компенсации функции β-клеток является логичным терапевтическим подходом для достижения оптимального контроля. Однако в реальной клинической практике между установлением диагноза СД типа 2 и началом инсулинотерапии проходит более 15 лет.
По данным Госрегистра Швеции в 2005 г., у 38% больных сахарным диабетом типа 2 был достигнут уровень HbA1c 5,0-5,9%, а у 13% больных уровень HbA1c составил < 4,9%. Каким же образом в Швеции удалось достичь такого уровня контроля гликемии? Именно заменой у больных СД типа 2 ПССП на инсулин. С целью стандартизации оказания медицинской помощи совместно ADA и EASD в 2006 году был создан алгоритм лечения СД типа 2, в котором основанием для назначения или изменения сахароснижающей терапии является увеличение уровня HbA1c >7%.
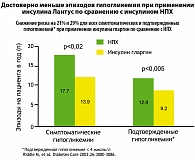
В исследовании INSIGHT (2006 г.) убедительно продемонстрировано, что добавление базального аналога инсулина к ПССП у пациентов с СД типа 2 более эффективно, чем дальнейшее увеличение доз уже принимаемых пероральных препаратов. Комбинация инсулина гларгин (Лантус) с ПССП на 24% эффективнее снижала уровень HbA1с по сравнению с терапией только пероральными препаратами без риска развития гипогликемии. А целевого уровня HbA1c < 7% достигли на 32% больше пациентов, получающих Лантус в комбинации с ПССП, по сравнению с пациентами, получающими терапию только пероральными препаратами.
Стоит отметить, что почти 2/3 пациентов, получавших Лантус в сочетании с ПССП, достигли целевого уровня гликемии уже в течение первых 8 недель терапии. С клинической точки зрения чрезвычайно важно, что комбинация Лантуса с ПССП была так же безопасна, как монотерапия ПССП: в конце исследования группы не отличались между собой по частоте развития гипогликемии (48,5% и 42,2%). И еще один важный момент: удовлетворенность лечением по шкале DTSQ на 18% была выше у пациентов, получавших инсулин гларгин в сочетании с ПССП, по сравнению с пациентами, получавшими ПССП. Таким образом, на вопрос, стоявший перед диабетологами в XX веке – назначать ли в принципе инсулин пациентам с СД типа 2, учитывая имеющуюся у этих больных гиперинсулинемию, – в настоящее время дан утвердительный ответ. Более того, в алгоритме определен срок ее начала: инсулин может быть назначен уже через 2-3 месяца после установления диагноза, если неэффективен первый этап лечения.
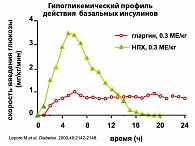
Одинаковая эффективность комбинации Лантуса и НПХ-инсулина с ПССП была показана в уже ставшем классикой исследовании Treat-To-Target («Лечение до цели»): в обеих группах удалось добиться хорошего контроля гликемии (уровень глюкозы плазмы натощак у пациентов, получавших Лантус и НПХ-инсулин, составил в среднем 6,5 ммоль/л и 6,7 ммоль/л соответственно, а уровень HbA1c – 6,96 и 6,97%). Целевого уровня HbA1c удалось достичь почти у 60% пациентов в обеих группах. Однако применение Лантуса отличалось меньшей вариабельностью гликемии в течение суток и значительно реже сопровождалось развитием клинически явной гипогликемии и, что особенно важно с точки зрения безопасности терапии, ночной гипогликемии (снижение риска составило 42-48%). Такие же результаты – сходная с НПХ-инсулином эффективность Лантуса для достижения нормогликемии при более высоком уровне безопасности – были получены в исследованиях, проведенных в азиатской (Pan и соавт., 2007) и латиноамериканской (Eliaschewitz и соавт., 2006) популяциях больных СД типа 2. И если, как было отмечено выше, риск гипогликемии как для врачей, так и для пациентов является одним из основных факторов, лимитирующих своевременное назначение инсулина, то Лантус позволяет если не преодолеть полностью, то, по крайней мере, снизить этот барьер на пути к достижению адекватного контроля.
Результаты последних двух исследований значимы еще и тем, что данные, полученные при применении Лантуса в европейской популяции, закономерно воспроизводятся в разных этнических группах, что не может не представлять интереса для российских эндокринологов и пациентов – граждан многонационального государства.
Интенсификация инсулинотерапии – основа современного лечения сахарного диабета типа 2
Мы знаем, что наряду с генетической предрасположенностью изменение образа жизни играет драматическую роль в увеличении количества больных СД типа 2. И не случайно наше внимание сегодня приковано к висцеральному или абдоминальному ожирению. Висцеральное ожирение провоцирует инсулинорезистентность, в результате чего развивается дефицит секреции инсулина, увеличивается уровень гликемии натощак, далее – вследствие двух предыдущих процессов, увеличивается общий уровень глюкозы в крови, происходят дегенеративные процессы в тканях, в данном случае – мышечной и жировой, затем, вследствие повышенного синтеза триглицеридов в печени, развивается дислипидемия, в результате глюкозотоксического действия на β-клетки поджелудочной железы нарушаются синтез и секреция инсулина. Затем начинаются поражения надпочечников, сосудистой стенки, развиваются артериальная гипертензия, сердечно-сосудистые заболевания, диабетическая ретинопатия, нейропатия, нефропатия. И только на этой стадии больному устанавливается диагноз сахарный диабет типа 2. Но, заметьте, к моменту появления этого диагноза у него есть уже весь комплекс осложнений, связанных с хронической гипергликемией. Этот факт не вызывает сомнения, и он наглядно доказан исследованием, проведенным в Великобритании (UKPDS) с участием 3867 пациентов с впервые выявленным сахарным диабетом типа 2. Поэтому основной целью лечения является как можно более полная компенсация нарушений углеводного обмена. В ходе вышеупомянутого исследования было доказано, что контроль гликемии позволяет предупредить развитие ретинопатии и других микрососудистых осложнений так же, как и у больных сахарным диабетом типа 1. При снижении гликированного гемоглобина (HbA1c) c 7,9% до 7% риск ретинопатии уменьшается на 21%, а нефропатии – на 34%. Течение диабета типа 2 сопровождается ухудшением функции β-клеток, которое начинается задолго до постановки диагноза. Это делает необходимым усиление сахароснижающей терапии. В настоящее время в рекомендациях Американской диабетической ассоциации показатель снижения HbA1c до уровня менее 7% свидетельствует об эффективности терапии больных сахарным диабетом типа 2. У Европейской ассоциации более жесткий критерий: HbA1c – менее 6,5%. Основой программы компенсации сахарного диабета типа 2 являются диета, физические нагрузки и прием пероральных сахароснижающих препаратов (ПССП). Однако пациенты, применяющие ПССП, редко достигают значения HbA1c < 7% и подвергаются риску осложнений. Через 3 года после манифестации СД типа 2 вторичная резистентность к сульфаниламидным препаратам развивается у 11% пациентов. Исследование, проводившееся в рамках UKPDS, подтвердило, что раннее начало инсулинотерапии может поддерживать HbA1c близко к 7% в течение первых 6 лет после установления диагноза. Но у большинства пациентов с длительным течением диабета и получающих терапию ПССП инсулинотерапия часто назначается поздно, либо – в недостаточном объеме. Одним из способов улучшения контроля гликемии является внедрение в практику новых препаратов инсулина, обладающих улучшенными фармакокинетическими и фармакодинамическими свойствами. Длительно действующий инсулин должен поддерживать постоянную базальную инсулинемию. В настоящее время в клиническую практику вошел инсулин гларгин (Лантус, «Санофи-авентис груп», Франция). Сегодня инсулин гларгин является единственным инсулином длительного действия, однократное введение которого обеспечивает контроль базальной гликемии в течение 24 часов. После введения препарат обеспечивает плавный профиль кривой «концентрация-время», а также большую длительность действия. Начало действия наступает примерно через 1 час. Гларгин, аналогично человеческому инсулину, подавляет липолиз и протеолиз, усиливает синтез белка. При однократном подкожном введении Лантуса устойчивая концентрация инсулина в крови достигается через 2-4 суток после введения первой дозы. Кроме того, Лантус обеспечивает базальный контроль гликемии в течение 24 часов независимо от времени введения (утром или перед сном). Точный подбор дозы Лантуса на фоне терапии сахароснижающими препаратами улучшает контроль гликемии. Лантус можно сочетать с «ультракороткими» и «короткими» аналогами инсулина, которые начинают действовать через 5-10 минут после инъекции и «работают» до двух часов. Можно адаптировать их дозы, которые будут адекватны для ликвидации постпрандиальной гипергликемии, не затрагивая в дальнейшем уровень сахара. Кроме того, частота ночных гипогликемий после применения Лантуса ниже в сравнении с другими инсулинами. Большинство пациентов с СД типа 2 имеют либо избыточную массу тела, либо ожирение разной степени на фоне инсулинотерапии. Различные исследования больных, получавших терапию инсулином гларгин в комбинации с глимепиридом, показывают, что масса тела уменьшилась по сравнению с начальной. Доказана эффективность и безопасность добавления инсулина Лантус к метформину у больных СД типа 2 с избыточным весом или ожирением.
Было показано, что простой алгоритм подбора дозы инсулина гларгина значительно улучшает контроль уровня глюкозы при низком риске тяжелой гипогликемии. Анализ эффективности Лантуса в подгруппах больных СД типа 2 показал, что, независимо от вида исходной терапии, ее интенсификация за счет добавления Лантуса позволила улучшить контроль гликемии во всех подгруппах. Мотивация и поведение больного являются критическими факторами при составлении терапевтического плана. Как известно, долгосрочный контроль диабета предполагает активное вовлечение пациента в программу лечения и эффективный контроль гликемии, который напрямую зависит от мотивации больных и врачей к раннему началу инсулинотерапии. И те, и другие зачастую избегают этого, боясь гипогликемий и развития осложнений, предпочитая контролировать уровень глюкозы при помощи пероральных сахароснижающих препаратов. Поэтому информированность врачей о новых и безопасных методах лечения играет основополагающую роль в эффективности терапии.
Исследования показали, что Лантус помогает добиться жесткого контроля уровня глюкозы – главной цели лечения сахарного диабета и его осложнений.
Фармакоэкономический анализ в создании современных стандартов лечения сахарного диабета типа 2
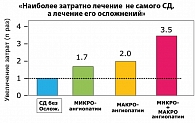
К фармакоэкономической оценке сахарного диабета типа 2 можно подходить с нескольких позиций. Утилитарный взгляд подразумевает подсчет затрат на лекарственные препараты, учет госпитализации по основному заболеванию, а также нетрудоспособности по поводу сахарного диабета типа 2. Если оценивать это заболевание с концептуальной точки зрения, то следует учитывать затраты на предупреждение осложнений СД типа 2 и инвалидности, стоимость сохраненной жизни и сохраненного качества жизни. Опираясь на вышеуказанные критерии оценки, проанализируем экономические преимущества выбора препарата Лантус на примере таких грозных осложнений сахарного диабета типа 2, как инсульт и острый инфаркт миокарда.
Для начала обратимся к фармакоэкономическим аспектам инсульта за 2007 г. Начнем с того, что средняя заработная плата на конец декабря 2007 г. составляла 13518 руб., а средняя пенсия по инвалидности – 2359 руб., что составляет 17,5% от заработной платы. Учитывая тот факт, что больные в 75% случаев становятся нетрудоспособными, они теряют возможность обеспечивать себя и свою семью. При этом «общественные расходы» на стационарное лечение одного больного обходятся в 16,4 тыс. руб. в год; на лечение и реабилитацию – в 65 тыс. руб.; на выплаты по нетрудоспособности – в 50,3 тыс. руб., по инвалидности – в 19 тыс. руб.; недополучение ОПП – 47 тыс. руб.
В целом расходы на одного больного инсультом составляют 198 тыс. руб. в год. Теперь сопоставим расходы на терапию препаратом Лантус в комбинации с пероральными препаратами с потерями.
Итак, стоимость вышеуказанной терапии составляет 30 тыс. руб. в год на одного больного; стоимость расходов на инсульт, как мы помним, составляет 198 тыс. руб.; далее – соотношение количества инсультов у больных с СД типа 2 без компенсации на один случай инсульта при компенсации СД равно 2,47, и при стоимости инсульта у больных СД типа 2 без компенсации, равной 489 тыс. руб. в год, эффективность вложений в терапию Лантусом составляет около 2,14. Таким образом, один рубль, вложенный в препарат Лантус, дает возможность получения 1,14 руб. «общественного» экономического эффекта в год за счет снижения риска развития инсульта и 1,97 руб. «личного» экономического эффекта. Итого, получается 3,11 руб. экономической отдачи на 1 рубль, вложенный в лечение препаратом Лантус.
Обратимся к базовым экономическим показателям острого инфаркта (ОИМ) миокарда. Госпитализация – 9,5 тыс. руб. в год, реабилитация в первые 6 месяцев – 12,5 тыс. руб., реабилитация во вторые 6 месяцев – 8,4 тыс. руб., выплаты по нетрудоспособности в первые 4 месяца – 54, 1 тыс. руб., недополучение ОПП в течение 4 месяцев – 14,4 тыс. руб. Общая стоимость составляет 98,9 тыс. руб. А теперь рассмотрим расходы на лечение осложнений СД типа 2 при адекватном (стратегия «Лантус») и неадекватном контроле. Итак, стоимость ишемического инсульта, купируемого стратегией «Лантус», на 100 человек составляет 594 руб., при других способах лечения – 1259 руб.; купирование ишемического инсульта в течение последующих 7 лет при помощи стратегии «Лантус» – 1838 руб., другие способы – 3243 руб.; острый инфаркт миокарда после инсульта в течение 7 лет: 141 руб. – стратегия «Лантус», другие методы – 243 руб.; острый тромбоз глубоких сосудов: стратегия «Лантус» – 144 руб., другая тактика – 307 руб.; диабетическое поражение почек в течение 7 лет: стратегия «Лантус» – 15531 тыс. руб., другая стратегия – 22606 руб.;
ОИМ в течение 7 лет: стратегия «Лантус» – 819 руб., другие методы – 1891,9 руб.
Разница стоимости терапии осложнений СД типа 2 между стратегией «Лантус» и другими способами составляет 10482 руб. в пользу первой.
Исходя из этих подсчетов, становится понятным, что концептуальная оценка проблем сахарного диабета типа 2 с учетом таких препаратов, как Лантус, наиболее выгодна с точки зрения «общественного» и «личного» экономических аспектов.
Управление кардиометаболическим риском у пациентов с сахарным диабетом типа 2
Эндоканнабиноидная система у здорового человека обычно находится в «немом» состоянии, активируясь «по требованию» под воздействием стресса. Рецепторы к каннабиноидам были открыты во время поисков точек приложения действия основного производного конопли – дельтатетрагидроканнабинола. К настоящему времени описаны два типа рецепторов. Рецепторы СВ1 обнаружены в головном мозге (гипокампе, базальных ганглиях, коре, мозжечке, гипоталамусе, лимбических структурах, стволе головного мозга). Эндоканнабиноиды образуются из фосфолипидов-предшественников, локализованных в мембранах клеток. Они действуют локально и немедленно метаболизируются после того, как реализовали свой эффект. Эндоканнабиноидная система – общая система восстановления после стресса. Она временно активируется для того, чтобы восстановить гомеостаз организма, помогая человеку: расслабиться (уменьшение боли и тревоги; модулирование температуры тела, образование гормонов, снижение тонуса гладких мышц и артериального давления); отдохнуть (ингибирование моторного поведения и успокоение); поесть (эффекты, индуцирующие аппетит и усиливающие удовольствие от пищи). Однако при некоторых патологических состояниях – переедании, стимуляции никотином – система становится чрезмерно активной. Тогда, действуя на уровне мозга, она индуцирует увеличенное потребление пищи, действуя на уровне адипоцитов, – стимулирует отложение жира.
В 1993 г. компания «Санофи Авентис» начала разработку блокатора СВ1рецепторов – римонабанта (Акомплия), в 2008 г. препарат зарегистрирован в России. Римонабант обладает следующими эффектами: на уровне гипоталамуса – стимулирует модуляцию секреции гормонов и анорексигенные эффекты; на уровне прилежащих ядер – снижает мотивацию к приему вкусной еды; усиливает утилизацию глюкозы в мышцах, стимулирует анорексигенные сигналы в ЖКТ; подавляет липогенез и формирование стеатоза в печени; стимулирует адипонектин, ГЛЮТ4 и блокирует ферменты липогенеза в жировой ткани. Римонабант применялся в нескольких многоцентровых рандомизированных плацебо-контролируемых исследованиях у больных с висцеральным ожирением и продемонстрировал обнадеживающие результаты в отношении снижения массы тела, улучшения липидного профиля и контроля гликемии у пациентов с СД типа 2, не получавших и получавших инсулинотерапию, влияния на кардиометаболические факторы риска, профилактики заболеваний сердечно-сосудистой системы. Были получены удовлетворительные результаты исследования влияния римонабанта на толщину атеросклеротической бляшек у больных с висцеральным ожирением в сочетании с кардиометаболическим риском. Результаты эндоваскулярного УЗИ-контроля коронарных артерий в течение 18 месяцев показали регрессию толщины атеромы. У больных сахарным диабетом типа 2, принимавших римонабант в дозе 20 мг в течение 6 месяцев, уровень гликированного гемоглобина снизился с 7,9 до 7,1%.
Комитет медицинской продукции для использования человеком Европейского медицинского агентства рекомендовал римонабант как добавку к диете и физическим упражнениям для лечения пациентов с ожирением или лиц с повышенной массой тела с сопутствующими факторами риска, такими как сахарный диабет типа 2 или дислипидемия.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.