Глитазоны: что назначать пациентам с инсулинорезистентностью?
- Аннотация
- Статья
- Ссылки
Сахарный диабет, в частности 2 типа, твердо ассоциируется с более чем двухкратным ростом частоты случаев инфаркта миокарда, инсульта и кардиоваскулярной смертности [1]. Согласно исследованиям [2], 65% больных сахарным диабетом 2 типа (СД 2) умирают именно от сердечно-сосудистых заболеваний или инсульта, а риск этих заболеваний среди пациентов в 3 раза превышает популяционные показатели. Высокий кардиоваскулярный риск у больных СД 2 обусловлен многими факторами: дислипидемией, прокоагулянтной активностью, усилением экспрессии провоспалительных цитокинов, гемодинамическими нарушениями, эндотелиальной дисфункцией [3, 4], хронической гипергликемией, оксидативным стрессом и др.
Cахарный диабет 2 типа характеризуется прогрессирующим нарушением функции β-клеток поджелудочной железы на фоне развития инсулинорезистентности [5, 6]. При манифестации СД 2 секреция инсулина снижается на 50%, чувствительность к инсулину – на 70% [7]. Инсулинорезистентность (ИР) сопутствует стрессам, инфекциям, уменьшению физической активности, пожилому возрасту, приему алкоголя. Степень ИР зависит от ряда факторов, включая генетические особенности организма, условия внутриутробного развития и средовые воздействия [8, 9].
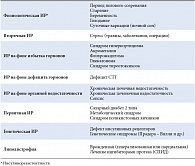
К факторам внешней среды, способствующим возникновению ИР, относят высококалорийное питание атерогенного характера, избыточную массу тела, стрессы, вредные привычки. Недостаточная физическая активность способствует развитию ожирения и снижает чувствительность скелетных мышц к инсулину. В последние годы получены новые данные о механизмах ИР и ее роли в развитии многочисленных гормонально-метаболических нарушений, характерных для данного синдрома. ИР может быть как генетически детерминированной, так и приобретенной. В настоящее время известно более 40 различных состояний и заболеваний, при которых развивается ИР (табл. 1).
Изучение генетических факторов показало, что ИР – это полигенная патология, в развитии которой могут иметь значение мутации генов субстрата инсулинового рецептора (IRS-1 и IRS-2), гликогенсинтетазы, гексокиназы типа II, b3-адренорецепторов, разобщающего протеина (UCP-1), а также молекулярные дефекты белков сигнального пути инсулина (внутриклеточные транспортеры глюкозы), белков, связывающих жирные кислоты (FABP-II), и др. [10]. Следствием инсулинорезистентности является стимуляция секреции инсулина, которая со временем приводит к истощению β-клеточной функции. Уменьшение чувствительности клеток печени к действию инсулина в свою очередь ведет к снижению синтеза гликогена, усилению гликогенолиза и глюконеогенеза, проявляющегося гипергликемией натощак. Однако инсулинорезистентность при СД 2 носит генерализованный характер и охватывает кроме печени такие массивные ткани, как мышечная и жировая. Таким образом, снижение экспрессии глюкозных транспортеров в мышечной и жировой тканях приводит к ограниченному поглощению ими глюкозы, а ИР печени – к повышенной гепатической продукции глюкозы. Развивается хроническая гипергликемия, в основе которой лежит в первую очередь ИР.
В условиях ИР и гиперинсулинемии (ГИ) формируется атерогенная дислипидемия, характеризующаяся гипертриглицеридемией, повышением содержания холестерина липопротеидов низкой плотности (ХС ЛПНП) и снижением концентрации холестерина липопротеидов высокой плотности (ХС ЛПВП) [11]. Известно, что гипертриглицеридемия в сочетании с низким уровнем ХС ЛПВП является независимым и существенным фактором риска инфаркта миокарда и/или инсульта у больных СД 2.
Проблема лечения сахарного диабета 2 типа по-прежнему остается в центре внимания практических врачей. Основная цель терапии больных СД 2 – максимальное снижение риска развития сердечно-сосудистых заболеваний и их осложнений. Лечение СД 2 включает изменение образа жизни: снижение калорийности рациона, полное исключение алкоголя, ограничение жиров животного происхождения и холестерина (менее 300 мг/сут), употребление полиненасыщенных жирных кислот (в частности, морской рыбы), активную физическую нагрузку (4–5 занятий в неделю по 30 минут в день при отсутствии клинических признаков ишемической болезни сердца). Снижение массы тела позволяет уменьшить ИР, а также получить положительный эффект в отношении артериальной гипертензии и показателей липидного спектра крови.
Основным направлением фармакотерапии СД 2 типа является коррекция ИР – важного звена патогенеза заболевания. Это признается всеми национальными и международными организациями, занимающимися проблемами диабетологии. Во всех разработанных этими организациями алгоритмах лечения СД 2 в качестве препарата выбора для стартовой терапии рекомендован метформин. Однако эта мера лишь частично решает проблему, поскольку влияние метформина на чувствительность мышечной и жировой ткани к инсулину незначительно. Данный пробел могут восполнить тиазолидиндионы (глитазоны).
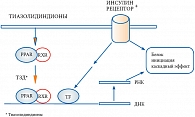
Тиазолидиндионы (ТЗД) являются агонистами рецептора, активируемого пролифератором пероксисом (PPAR-гамма). Активация рецепторов PPAR-гамма повышает чувствительность к инсулину через увеличение экспрессии многочисленных генов, кодирующих протеины или белки, которые модулируют метаболизм глюкозы и жиров (рис. 1). В результате улучшается чувствительность печени, мышечной и жировой ткани к инсулину. Тиазолидиндионы пересекают плазменную мембрану и проходят через цитоплазму к ядру, где они соединяются с комплексами PPAR/RXR. Этот активированный комплекс соединяется с рибосомными структурами и повышает функцию и эффективность процессов транскрипции, которые инициировал инсулин. Это повышение увеличивает эффекты инсулина на ядро. В результате включается сигнал для формирования белков, участвующих в энзиматических процессах, росте клеток, регуляции активности инсулиновых рецепторов. Благодаря уникальному механизму действия глитазоны снижают резистентность к инсулину преимущественно в мышечной и жировой ткани, превосходя в этом метформин. Являясь классическим сенситайзером (препаратом, повышающим чувствительность), глитазоны эффективно влияют на постпрандиальную и натощаковую гликемию при наличии у пациента собственной достаточной секреции инсулина.
Опубликованная в 2007 г. в New England Journal of Medicine работа Стивена Ниссена (Steven E. Nissen) и Кэти Вольски (Kathy Wolski) «Влияние росиглитазона на риск развития инфаркта миокарда и смерти от сердечно-сосудистых причин» [12] вызвала широчайший резонанс среди мировой медицинской общественности. Авторы представили метаанализ данных 42 рандомизированных клинических исследований (РКИ), в которых участвовали пациенты, получавшие росиглитазон (Авандия) (n = 15 565) и пациенты контрольных групп на плацебо или других сахароснижающих препаратах (n = 12 282). В метаанализ были включены и такие известные исследования, как ADOPT (A Diabetes Outcome Progression Trial) и DREAM (Diabetes Reduction Assessment with ramipril and rosiglitazone Medication).
Проанализировав результаты 42 РКИ, авторы обнаружили повышенные риски развития инфаркта миокарда (коэффициент вероятности 1,43; 95-процентный доверительный интервал 1,03–1,98; p = 0,03) и смерти от кардиоваскулярных событий (коэффициент вероятности 1,64; 95-процентный доверительный интервал 0,98–2,744; p = 0,06) среди больных СД 2 типа, получавших росиглитазон. На основании этих данных был сделан вывод, что применение росиглитазона (Авандия) достоверно связано с повышенным риском инфаркта миокарда и смерти вследствие сердечной недостаточности по сравнению с плацебо или активной контрольной группой, получавшей другие сахароснижающие препараты. Причиной развития сердечной недостаточности исследователи склонны считать задержку жидкости в организме, которая приводит к повышению нагрузки на левое предсердие и увеличению легочного венозного давления.
Публикация C. Ниссена и К. Вольски [12] побудила ряд исследователей обратиться ко второму препарату из группы тиазолидиндионов – пиоглитазону (Амальвия) и сравнить его с росиглитазоном по параметру сердечно-сосудистого риска. Чарльз Герритс (Charles M. Gerrits) и соавт. [14] провели ретроспективное когортное исследование пациентов, которым терапия сахарного диабета проводилась пиоглитазоном или росиглитазоном. Относительный риск госпитализации по поводу острого инфаркта миокарда (ОИМ) после инициации лечения этими препаратами был оценен с помощью мультивариантного анализа методом Кокса, в котором учитывались конечные точки: госпитализация или коронарная реваскуляризация. В общей сложности 29 911 пациентов соответствовали критериям включения в эту ретроспективную когорту. Из них 14 807 получали пиоглитазон, 15 104 – росиглитазон. В среднем пациенты обеих групп принимали препараты в течение 11 месяцев. В обеих группах превалировали мужчины (две третьих от общего числа пациентов), средний возраст больных составил 56 лет. В целом пациенты были сопоставимы по демографическим параметрам, анамнезу и схемам фармакотерапии.
Однако между группами наблюдались небольшие различия: статины и фибраты чаще получали пациенты в группе пиоглитазона, более высокая распространенность гиперлипидемии и более частое применение метформина фиксировалось в группе росиглитазона. Коэффициент вероятности госпитализации по поводу ОИМ составил 0,78 (95-процентный доверительный интервал 0,63–0,96); относительный риск по ОИМ или коронарной реваскуляризации – 0,85 (95-процентный доверительный интервал 0,75–0,98). Среди пациентов, принимавших пиоглитазон в течение исследуемого периода, по поводу острого инфаркта миокарда были госпитализированы 161 пациент (1,1%), в то время как среди принимавших росиглитазон – 214 пациентов (1,4%). Это ретроспективное когортное исследование показало, что применение пиоглитазона привело к относительному снижению риска госпитализации больных СД 2 типа по поводу ОИМ на 22% по сравнению с росиглитазоном [14].
Несмотря на то что пиоглитазон и росиглитазон имеют сходное влияние на углеводный обмен, отчетливо проявляются различия в метаболизме липидов. Анализ, проведенный Ч. Герритсом и соавт., показал: пиоглитазон способствовал снижению уровня триглицеридов, в то время как в группе росиглитазона наблюдался рост этого показателя. Кроме того, пиоглитазон способствовал повышению холестерина липопротеинов высокой плотности в большей степени, чем росиглитазон. Исследователи также выявили благоприятные изменения в концентрации и размерах атерогенных частиц холестерина липопротеинов низкой плотности при применении пиоглитазона.
Положительное влияние пиоглитазона на липидный обмен было обнаружено в ходе трехлетнего исследования PROactive (PROspective pioglitAzone Clinical Trial In macroVascular Events) [15], в котором участвовали 5238 больных сахарным диабетом 2 типа с макрососудистыми осложнениями в анамнезе, получавшие на момент начала исследования диетотерапию и сахароснижающую терапию различными препаратами. Пациенты были рандомизированы на две группы: одна группа дополнительно к существующей терапии получала пиоглитазон в дозе 45 мг, а другая – плацебо.
В результате в группе пиоглитазона уровень ЛПВП повысился на 9%, а уровень триглицеридов снизился на 13%. Что особенно интересно, частота смертельных исходов или развитие новых макрососудистых осложнений у пациентов на пиоглитазоне снизилась на 10% при небольшом повышении частоты развития сердечной недостаточности по сравнению с контрольной группой (10,8% и 7,5% соответственно).
Противопоказания: гиперчувствительность, сахарный диабет 1 типа, диабетический кетоацидоз, тяжелая сердечная недостаточность, беременность, лактация. Применять с осторожностью при отечном синдроме, анемии, печеночной недостаточности (повышение активности ферментов печени в 1–2,5 раза выше верхней границы нормы), сердечной недостаточности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.