Эффективная моно- и комбинированная терапия сахарного диабета типа 2 с помощью вилдаглиптина
- Аннотация
- Статья
- Ссылки




Основные патогенетические нарушения при СД 2 включают отсутствие первой фазы секреции инсулина при внутривенном либо пероральном введении глюкозы. Кроме того, у больных СД 2 наблюдается снижение реакции β-клеток в ответ на другие секретогоги (аргинин, секретин и т.д.), подавление пульсирующего характера секреции инсулина, уменьшение максимальных секреторных резервов, гиперпродукция проинсулина. По сути, при сахарном диабете типа 2 секреция инсулина недостаточна по отношению к нарастающей гипергликемии. Наибольшая диспропорция между секрецией инсулина и потребностью в нем возникает после приема пищи (выпадение ранней фазы секреции инсулина). На сегодняшний день уточнены далеко не все механизмы указанных нарушений. Предположительно, главенствующую роль в развитии функциональных и структурных изменений β-клеток играют возрастные факторы, наследственная предрасположенность, инсулинорезистентность, липо-, глюкозотоксичность, накопление амилоида, влияние провоспалительных цитокинов, нарушение эффектов инкретинов (1, 7, 10, 22, 24). Физиологическая реакция печени на гиперинсулинемию заключается в снижении продукции глюкозы. Инсулинорезистентность печени сопровождается снижением синтеза гликогена, активизацией гликогенолиза и глюконеогенеза. Длительное время инсулинорезистентность компенсируется нефизиологической гиперинсулинемией, пока не произойдет истощение железы, приводящее к гипергликемии натощак. При СД типа 2 наблюдается повышенная продукция эндогенной глюкозы печенью, обусловленная, с одной стороны, инсулинорезистентностью, а с другой – парадоксальным повышением секреции глюкагона, несмотря на пищевую нагрузку. Именно этим обусловлена утренняя гипергликемия натощак, а не погрешностями в диете. Отражением несоблюдения диетического режима является постпрандиальная гипергликемия, имеющая тесную корреляцию с сердечно-сосудистой смертностью.
Традиционный подход к лечению СД типа 2 включает низкокалорийное питание, физические нагрузки, поведенческую и фармакотерапию, обучение больных, а также профилактику и лечение осложнений (4, 8, 21). Большим препятствием к достижению компенсации углеводного обмена является избыточная масса тела или ожирение, наблюдающееся практически у всех больных сахарным диабетом типа 2. Те же 12-15% лиц с нормальной массой тела, но при установлении диагноза с клиникой СД 2, на самом деле представляют собой LADA (медленно прогрессирующий СД типа 1 у взрослых), что было блестяще доказано в исследовании UKPDS на основании выявления антител к глютаматдекарбоксилазе (GAD).
Современные рекомендации по лечению СД типа 2 построены на принципах низкокалорийного питания с исключением легкоусвояемых углеводов, снижении потребления холестерина (менее 300 мг в день), регулярных физических нагрузок. Четко установлена способность регулярных физических упражнений снижать риск осложнений сахарного диабета путем повышения чувствительности к инсулину (5). Однако нефармакологические методы лечения СД типа 2 обеспечивают достижение и поддержание целевых показателей гликемии, в течение 1 года после установления диагноза, не более чем у 5-10% пациентов (8, 19). Фармакотерапия СД 2 должна воздействовать на основные патофизиологические нарушения, присущие СД 2: дисфункция β-клеток и инсулинорезистентность (12, 16). Традиционные препараты, применяемые в терапии СД типа 2, связаны с определенными барьерами и побочными явлениями, которые осложняют и ограничивают возможности достижения контроля и комплаентность терапии. К ним относятся повышенный риск гипогликемии, увеличение массы тела, диспепсия, отеки, неудовлетворительный контроль постпрандиальных показателей гликемии. С учетом этого, большие надежды у клиницистов возлагаются на разработанные в последние годы принципиально новые сахароснижающие средства, механизм действия которых тесно связан с эффектами инкретинов.
Инкретины относятся к семейству гормонов, стимулирующих секрецию инсулина в ответ на прием пищи. До 70% постпрандиальной секреции инсулина у здоровых людей обусловлено именно эффектом инкретинов, который значительно снижен у больных СД типа 2 и НТГ (рисунок 1).
Двумя самыми важными гормонами-инкретинами являются: глюкозозависимый инсулинотропный полипептид (ГИП), прежде известный как желудочный ингибиторный полипептид; глюкагон подобный пептид (ГПП-1).
Инсулинотропный эффект ГИП, циркулирующего в несниженных концентрациях, значительно снижается; в частности, часто наблюдается полная утрата нормального индуцированного ГИП потенциирования секреции инсулина второй фазы. Бета-клетки у пациентов с СД 2 типа крайне нечувствительны к ГИП. Экспрессия ГИП рецептора, по-видимому, остается нормальной, и дефект, по всей вероятности, заключается во внутриклеточных сигнальных путях, идущих от рецептора. И наоборот, введение экзогенного ГПП-1 восстанавливает нормальный инсулиновый ответ на глюкозу у пациентов с СД 2 типа.
Физиологические эффекты ГПП-1 реализуются после его взаимодействия с ГПП-1 рецепторами, которые экспрессируются во многих органах и тканях, включающих поджелудочную железу, желудок, тонкий кишечник, мозг, гипофиз, легкие, почки, сердце. Их функции во многих из этих тканей остаются до конца неизученными. Основным органом-мишенью для ГПП-1 являются островки Лангерганса. Инсулинотропная активность ГПП-1, которая четко зависит от уровня гликемии, реализуется путем взаимодействия ГПП-1 со специфическими рецепторами, расположенными на мембране β-клетки. Необходимо отметить, что ГПП-1 активирует ген глюкокиназы и ген, кодирующий транспортер глюкозы GLUT 2, которые ответственны за внутриклеточный механизм секреции инсулина.
Показано, что инфузия ГПП-1 вызывает снижение концентрации глюкозы крови до уровня гликемии натощак. Как только уровень гликемии снижается и приближается к нормальным значениям, влияние ГПП-1 на секрецию инсулина прекращается.
Таким образом, клинически важным следствием зависимости эффектов ГПП-1 от уровня глюкозы крови является то, что ГПП-1 не может вызывать развития выраженной гипогликемии. Действие ГПП-1 способствует адекватному секреторному ответу β-клеток в ответ на глюкозу. Это важное свойство ГПП-1 может улучшить способность β-клеток к восприятию глюкозы и их секреторный ответ на глюкозу у пациентов с нарушенной толерантностью к глюкозе. Существует обратная зависимость между пищевой секрецией ГПП-1 и ростом инсулинорезистентности.
Другим важным физиологическим эффектом ГПП-1 является его влияние на секрецию глюкагона. ГПП-1 глюкозозависимым механизмом подавляет секрецию глюкагона панкреатическими α-клетками.
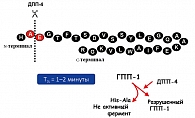
Таким образом, ГПП-1 регулирует концентрацию глюкозы плазмы, модулируя секрецию, как инсулина, так и глюкагона в период постпрандиальной секреции инсулина. ГПП-1 имеет короткий период полужизни, который составляет около 60-90 секунд. Элиминация ГПП-1 из циркуляции осуществляется тремя основными механизмами: почечная и печеночная экскреция, а также – деградация в циркуляции. Под влиянием дипептидилпептидазы 4 (ДПП-4) происходит его быстрая инактивация, с образованием неактивных метаболитов (рисунок 2). Отсюда очень многообещающий терапевтический подход – подавить действие фермента ДПП-4, увеличив, таким образом, уровни эндогенных ГПП-1 и ГИП. Ингибиторы ДПП-4 продлевают период полужизни инкретинов, благодаря чему усиливается их инсулинотропное действие. В настоящее время новые терапевтические подходы в лечении СД типа 2 связывают с модуляцией активности и уровня инкретинов посредством назначения ингибиторов фермента дипептидилпептидазы 4 типа (ДПП 4).
Ингибиторы дипептидилпептидазы-4 – чрезвычайно перспективный, активно развивающийся класс сахароснижающих препаратов. Основные его представители приведены в таблице 1.
Вилдаглиптин (Галвус) является ингибитором ДПП-4, который применяется уже в течение 2 лет в Российской Федерации. Препарат Галвус включен в список ЖНВЛС в декабре 2009 года. Вилдаглиптин является субстратом ДПП-4 с высокой степенью селективности, которая обеспечивает высокую степень ингибирования фермента (рисунок 3). В связи с продолжительным периодом ингибирования, в 10 раз превышающим силу и степень ингибирования других представителей ингибиторов ДПП-4, в клинической практике применяется в 2 раза меньшая разовая доза вилдаглиптина. Галвус (вилдаглиптин) уже в течение 4 лет широко и детально применяется в международных рандомизированных клинических испытаниях с участием более 22000 пациентов с СД типа 2 по всему миру, в том числе и у российских пациентов.
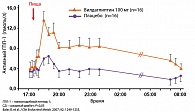
На рисунке 4 представлены результаты исследования влияния Галвуса на секрецию инсулина и чувствительность тканей к инсулину. Все пациенты получали метформин, доза которого стабильно поддерживалась с момента старта терапии.
Исследование было плацебо-контролируемым, поэтому результаты соответствуют принципам доказательной медицины. Полученные данные свидетельствуют о статистически значимом, по сравнению с плацебо, повышении секреции инсулина, чувствительности тканей к нему, а значит – снижении инсулинорезистентности.
Заслуживает внимания исследование продолжительностью 52 недели с участием пациентов, ранее не получавших терапии. Исходные значения HbA1с составили 8,7%. В конце исследования сравнивались результаты назначения вилдаглиптина (50 мг дважды в день, n = 526), либо метформина (1 г дважды в день, n = 254) у больных СД типа 2. Динамика HbA1c в группе вилдаглиптина составила минус 1,0%, что было статистически значимо по сравнению со стартовыми показателями, однако без преимущества по сравнению с метформином (ΔHbA1с в группе контроля составила 1,4%) (9). В последние годы появились сведения о том, что метформин способствует увеличению уровня ГПП-1. Среди предполагаемых механизмов обсуждается роль бигуанида в непосредственном усилении секреторной функции L-клеток кишечника, активации транскрипции / трансляции гена проглюкагона, снижении почечной экскреции ГПП-1, блокаде дипептидил-пептидазы-4 (13).
Преимущества сочетанного назначения вилдаглиптина и метформина (аддитивное влияние на углеводный обмен и комлементарный механизм действия) предопределили необходимость создания фиксированной комбинации этих препаратов. Возможность одномоментного воздействия на ключевые звенья патогенеза СД 2 – инсулинорезистентность и нарушение функции островковых клеток поджелудочной железы – обеспечивает высокий потенциал данного вида терапии. В странах Евросоюза фиксированная комбинация вилдаглиптина с метформином (Eucreas) используется с 2007 года. В Российской Федерации более года применяются фиксированные комбинации Галвуса с метформином – Галвус Мет в трех дозировках (50/500 мг, 50/850 мг и 50/1000 мг).
К настоящему времени, проведена серия работ, в которых убедительно доказана целесообразность комбинированной терапии вилдаглиптином и метформином.
Так, уже в одном из наиболее ранних рандомизированных исследований было показано, что подобная комбинация позволяет добиться значимого улучшения показателей углеводного обмена, причем эти результаты остаются стабильными в течение года. В данной работе вилдаглиптин в дозе 50 мг добавлялся к терапии метформином, что уже через 12 недель привело к снижению HbA1с на 0,6% по сравнению с исходным уровнем (7,7%). В группе контроля (монотерапия метформином) существенных изменений не отмечалось. Все последующие 40 недель на фоне комбинированной терапии сохранялся положительный результат лечения, в то время как в контрольной группе наблюдалась прогрессирующая отрицательная динамика (увеличение HbA1с на 0,066% ежемесячно). За счет этого разница между группами по HbA1с изменилась с минус 0,7% (12-я неделя наблюдения) до минус 1,1% (40-я неделя) (2).
В двойном слепом исследовании, выполненном E. Bosi с соавт. (2007), вилдаглиптин в дозе 50 мг однократно либо дважды в день комбинировали с метформином (≥ 1500 мг в сутки) у 416 больных. В среднем уровень HbA1с, изначально составлявший 8,4%, через 24 недели возрос на 0,2% на фоне метформина в сочетании с плацебо. В группе, получавшей помимо метформина, вилдаглиптин в дозе 50 мг либо 100 мг, показатели HbA1с снизились на 0,5% и 0,9% соответственно, уровень гликемии натощак – на 0,8 ммоль/л и 1,7 ммоль/л (3). Важно, что при сочетанном назначении вилдаглиптина и метформина побочные эффекты со стороны желудочно-кишечного тракта наблюдались реже, чем на фоне монотерапии метформином (6).
С 2008 года Галвус и Галвус Мет также оцениваются в ходе наблюдательных постмаркетинговых программ, в которых на сегодняшний день уже более 4000 пациентов с СД 2 типа принимает или приняло участие.
Альтернативные ADA/EASD Рекомендации по выбору режимов терапии были опубликованы по итогам завершившегося Конгресса Международной Федерации Диабета (FDA) в Монреале (18-23 октября 2009). Рекомендации выпущены Американской ассоциацией клинических эндокринологов (AACE) и в них ингибиторы ДПП-4 и ГПП-1 миметики вставлены во все ряды терапии СД типа 2 в качестве препаратов выбора (рисунок 5, рисунок 6). Это революционный шаг, который показывает, что научное и мировое сообщество приняло новые группы препаратов, оценило их эффективность и преимущество и будет активно их продвигать и применять.
Следует отметить и высокую эффективность в терапии СД типа 2 при комбинации вилдаглиптина с инсулином. V. Fonseca и соавт. (2006) в течение 24 недель изучали эффективность добавления вилдаглиптина (50 мг в день) к инсулину (средняя суточная доза – 82 ед.) у 256 больных с неудовлетворительными показателями углеводного обмена (исходно HbA1с в среднем составлял 8,5%). На протяжении всего периода исследования режим инсулинотерапии не менялся. К концу наблюдения значение гликированного гемоглобина в основной группе уменьшилось на 0,5%, в то время как в группе контроля (инсулин в сочетании с плацебо) – на 0,3%. Интересно, что у больных в возрасте от 65 лет и старше комбинация инсулина с вилдаглиптином способствовала уменьшению HbA1с на 0,7%, в то время как в контрольной группе статистически значимой разницы не отмечено. Эпизоды гипогликемии регистрировались существенно реже в основной группе, что, вероятно, обусловлено повышением чувствительности a-клеток поджелудочной железы к глюкозе (11).
Заключение
Прогрессирующее течение сахарного диабета типа 2 убедительно подтверждено результатами многолетних проспективных исследований с мониторингом гликемии и оценкой секреции инсулина, а также данными аутопсии. В связи с этим наиболее перспективной является терапия, позволяющая кардинально изменить характер естественного течения заболевания. Инкретины – глюкагоноподобный пептид-1 и глюкозозависимый инсулинотропный полипептид – стимулируют рост островковых клеток и защищают их от разрушения под действием неблагоприятных факторов. Как показали исследования у животных с индуцированным диабетом, такими же свойствами обладают инкретиномиметики и ингибиторы дипептидилпептидазы-4.
Селективный ингибитор дипептидилпептидазы-4 вилдаглиптин (Галвус) – представитель принципиально нового класса сахароснижающих препаратов, стремительно вошедшего в клиническую практику за сравнительно короткий период времени. Механизм действия вилдаглиптина основан на предотвращении инактивации эндогенного глюкагоноподобного пептида-1, что способствует усилению секреции инсулина, подавлению продукции глюкагона.
К числу преимуществ терапии сахарного диабета типа 2 с использованием вилдаглиптина при монотерапии и комбинированном лечении, помимо клинически значимого улучшения показателей углеводного обмена, является хорошая переносимость, низкий риск развития гипогликемии, нейтральное воздействие на массу тела. Применение в клинической практике препарата Галвус Мет в фиксированной комбинации обеспечивает одномоментное воздействие на инсулинорезистентность и нарушение функции β-клеток поджелудочной железы – важнейшие звенья патогенеза СД2. Для уточнения спектра побочных эффектов и оценки потенциального цитопротективного эффекта ингибиторов ДПП-4 у больных СД типа 2 необходимо проведение новых долгосрочных клинических исследований.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.